利培酮通过影响Wnt/β-catenin信号通路诱导人成骨细胞系hFob1.19凋亡
时间:2023-06-30 17:15:03 来源:雅意学习网 本文已影响 人 
庞 兰,李佩璠,郑 蕾*,王艺明*
1.贵州医科大学,贵州 贵阳 550004;
2.贵州医科大学附属医院 精神科,贵州 贵阳 550004
非典型抗精神病药物的广泛应用明显提升了精神分裂症患者精神症状的缓解率和社会功能的恢复率[1]。然而,有报道精神分裂症患者服用非典型抗精神病药会引起骨密度下降,使精神分裂症患者发生骨折的风险明显增高[2]。目前国内外对于非典型抗精神病药物对骨代谢的影响的研究多集中在由非典型抗精神病药物引起的高泌乳血症继发引起骨质疏松上[3],而关于非典型抗精神病药物是否对人成骨细胞直接起作用以及其影响人成骨细胞的分子机制的研究少有文献报道。近年来,有研究发现Wnt/β-catenin信号通路可以调控成骨细胞凋亡以及诱导成骨细胞发生,与骨肿瘤、骨质疏松等疾病关系密切[4]。
基于目前研究基础,本研究旨在探讨非典型抗精神病药是否诱导人成骨细胞凋亡以及是否与Wnt/β-catenin信号通路相关,希望为非典型抗精神病药物临床应用对人成骨细胞的影响提供理论依据。
1.1 材料
1.1.1 细胞:人成骨细胞系(human osteoblast cell line,hFob1.19)(ATCC)。
1.1.2 药品:利培酮(risperidone,Ris)(Sigma-Aldrich公司)。
1.1.3 主要试剂:RPMI-1640液体培养基(Gibco公司);
DSMO(Sigma-Aldrich公司);
CCK-8(东仁化学科技(上海)有限公司);
RNA提取试剂盒、PCR反转录试剂盒、PCR 荧光试剂盒[赛默飞世尔科技(中国)有限公司];
兔抗羊β-catenin、Lamin B、BCL-2、BAX、MCL-1、caspase-3、cleaved caspase-3和β-actin(Cell Signaling Technology公司);
Annexin V-FITC/PI双染法细胞凋亡检测试剂盒(Biosciences公司)。
1.2 方法
1.2.1 细胞的分组及处理:将收到的装有hFob1.19细胞置于RPMI-1640培养基(包含15%胎牛血清、青霉素100 U/mL、链霉素100 μg/mL)混匀并接种到培养瓶,放入含5%的CO2和95%饱和湿度的37 ℃恒温培养箱中,持续培养至细胞汇合达到 80%以上以 0.25%胰蛋白酶消化传代,待细胞稳定增殖后将其分为对照组、利培酮(0、5、20、40、60、80、100和120 μmol/L)干预组,各组细胞干预12、24和48 h后进行后续实验。
1.2.2 CCK-8法检测增殖抑制率:收集对数增殖期的hFob1.19细胞,在3块96孔板中以每孔5×104个/mL的浓度接种各组细胞,每组设置5个副孔,用酶标仪在490 nm波长处测定各孔吸光度值。
1.2.3 流式细胞测量术检测细胞凋亡率:收集对数增殖期的hFob1.19细胞接种于各组培养瓶中,每瓶细胞含1×107个细胞,干预24 h,收集全部细胞进行800×g离心5 min,收集细胞沉淀。加入200 μL缓冲液,轻轻重悬细胞。加入10 μL annexin V-FITC室温下孵育15 min,随后加入5 μL碘化丙啶(PI)染色液,室温下避光孵育20 min,放入流式细胞仪进行细胞凋亡率检测。
1.2.4 RT-qPCR检测基因表达:在收集的不同干预组细胞中加入1 mL Trizol,震荡混匀;
加入200 μL氯仿,振荡混匀15 s,室温放置3 min,低温12 000×g离心15 min;
离心后溶液分层,用移液器将无色水样上层转移至无菌的Eppendorf管中,加入500 μL异丙醇,轻轻摇匀,室温静置20 min,随后在低温12 000×g离心10 min,RNA(白色絮状物)沉于管底,收集沉淀并检测浓度;
根据RNA浓度,将模板RNA转移至Rnase-free的PCR管中,依次加入反转录试剂,混匀后瞬时离心,随后上机反应将RNA转cDNA。依据PCR荧光试剂盒配置引物终浓度0.2 μmol/L,总体积50 μL的RT-qPCR反应体系,采用2-△△CT法处理实验结果(引物序列见表1)。

表1 目的基因引物序列
1.2.5 细胞核内外蛋白质提取:根据用量取适当的浆蛋白质抽提试剂和核蛋白质抽提试剂加入PMSF。各组hFob1.19细胞采用胰蛋白酶消化好后置于15 mL离心管,浓缩后放置于1.5 mL离心管中,800×g离心5 min,吸尽上清留下沉淀备用。每20 μL细胞沉淀加入200 μL浆蛋白质抽提试剂,高速涡旋使细胞沉淀完全分散开成单细胞悬液,冰浴10 min后低温12 000×g离心10 min,上清即为抽提得到的细胞浆蛋白质。沉淀为细胞核,加入50~100 μL核蛋白质抽提试剂。高速涡旋使细胞沉淀完全分散开成单细胞悬液,冰浴10 min后低温12 000×g离心10 min,上清即为抽提得到的细胞核蛋白质。
1.2.6 Western blot检测蛋白质表达:将收集的hFob1.19细胞放入配置好的蛋白裂解液中,置冰上充分裂解25 min,将裂解物在低温12 000×g离心15 min获得蛋白质样品,将等量的蛋白质样品用于Western blot检测。将蛋白质样品电泳后转移到PVDF膜中,并将膜在蛋白质封闭液中封闭2 h,再将膜浸没于稀释后的一抗于低温温育过夜。配制辣根过氧化物酶偶联二抗,将PVDF膜浸没于二抗中,室温下慢摇孵育1 h。准备ECL发光试剂盒,等量混合ECL显色A液及B液,将混合液均匀的铺在PVDF膜上,放入自动曝光机上曝光。采用Quantity One软件对蛋白质样品进行吸光度值进行数字化分析。
1.3 统计学分析
2.1 利培酮以浓度和时间依赖性抑制hFob1.19细胞活力
不同浓度利培酮处理hFob1.19细胞不同时间后,细胞活力呈浓度和时间依赖性降低(P<0.05)(表2)。
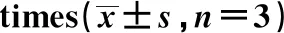
表2 不同浓度和时间利培酮处理后hFob1.19细胞活力的变化
2.2 利培酮对hFob1.19细胞凋亡的影响
不同浓度利培酮处理hFob1.19细胞24 h后,检测细胞凋亡率呈剂量依赖性升高(图1)。

*P<0.05 compared with control;
*P<0.01 compared with control
2.3 利培酮对hFob1.19细胞β-catenin及凋亡相关基因表达的影响
利培酮40 μmol/L处理hFob1.19细胞24 h后, β-catenin表达水平下降,抗凋亡基因BCL-2、 MCL-1表达水平下降,而促凋亡基因BAX表达水平升高(P<0.01)(图2)。

*P<0.01 compared with control
2.4 利培酮对hFob1.19细胞β-catenin及凋亡蛋白表达的影响
利培酮40 μmol/L处理hFob1.19细胞24 h后,β-catenin和抗凋亡蛋白BCL-2、MCL-1表达水平下降,而促凋亡蛋白BAX、cleaved caspase-3表达水平升高(P<0.01)(图3)。

*P<0.01 compared with control
2.5 利培酮对hFob1.19细胞β-catenin蛋白核内外表达的影响
利培酮40 μmol/L处理hFob1.19细胞24 h后,β-catenin蛋白核内外表达水平均下降(P<0.05)(图4)。

*P<0.05 compared with control
迄今为止,关于非典型抗精神病药对人成骨细胞造成的影响及机制尚未完全阐明,特别是关于非典型抗精神病药直接对人成骨细胞的影响。本研究结果表明利培酮抑制hFob1.19细胞活力,诱导细胞凋亡,细胞凋亡是细胞在多种基因精确调控下的主动的、程序化的死亡过程[5]。其中,BCL2基因家族可以通过编码多种促凋亡和抗凋亡蛋白质来调节细胞凋亡,BCL2家族在调控细胞凋亡的重要的地位已得到广泛的认可[6],但其在利培酮诱导hFob1.19细胞凋亡中的作用机制尚没有深入报道。在本次研究中, 利培酮通过调控hFob1.19细胞凋亡蛋白质质的表达,使其BCL-2、MCL-1水平降低,BAX、cleaved caspase-3水平升高。增加的促凋亡BAX因子可与线粒体外部结合导致线粒体外膜透化和细胞色素C的释放[7]。在细胞凋亡诱导信号的趋势中,活化的caspase-3是细胞凋亡过程中的关键执行者[8],它可以水解细胞内的目标物质,降解细胞内蛋白质,导致不可逆转的死亡[9]。反之,抗凋亡蛋白BCL-2,MCL-1的表达降低,使其阻断促凋亡蛋白质介导的线粒体外膜透化导致细胞凋亡增加的作用降低[10]。此外,本研究初步揭示了Wnt/β-catenin信号通路与利培酮诱导的细胞凋亡之间的联系。β-catenin是该信号通路的关键性调控蛋白质。稳定的β-catenin在胞质中聚集达到一定浓度后进入细胞核,随后与Tcf/Lef结合形成β-catenin-Tcf/Lef,继而介导下游靶基因的转录[11-12]。本次研究结果也显示β-catenin减少同时,核内β-catenin也随之减少。当β-catenin信号通路下调时,hFob1.19细胞凋亡增加,同时BAX,caspase-3上调以及BCL-2,MCL-1下调。类似的研究表明Wnt/β-catenin信号通路参与保护成骨细胞和骨细胞免于凋亡,其抑制与促凋亡BAX,caspase-3上调和抗凋亡BCL-2,MCL-1下调有关[13],这与本次研究结果一致。
综上所述,本次研究结果提示利培酮通过调节BCL2家族中抗凋亡与促凋亡蛋白质的平衡诱导人成骨细胞凋亡,这一过程可能与利培酮抑制Wnt/β-catenin信号通路相关。也初步探明了非典型抗精神病药诱导骨质疏松的潜在靶点,为预防和治疗抗精神病药引起的骨的副作用提供了新思路。
猜你喜欢非典型利培成骨细胞非典型内脏异位综合征1例中国临床医学影像杂志(2022年2期)2022-05-25非典型抗精神病药物导致的代谢紊乱天津医科大学学报(2021年3期)2021-07-21淫羊藿次苷Ⅱ通过p38MAPK调控成骨细胞护骨素表达的体外研究安徽医科大学学报(2016年12期)2017-01-15土家传统药刺老苞总皂苷对2O2诱导的MC3T3-E1成骨细胞损伤改善中国民族医药杂志(2016年6期)2016-05-09城市边缘区“非典型传统村落”保护与开发探讨中国房地产业(2016年9期)2016-03-01认知行为与利培酮联合治疗精神分裂症残留型的临床疗效分析中国卫生标准管理(2015年24期)2016-01-14利培酮治疗精神分裂症22例临床观察中国卫生标准管理(2015年2期)2016-01-14Bim在激素诱导成骨细胞凋亡中的表达及意义中国医科大学学报(2015年10期)2015-03-01非典型纤维黄瘤一例中华皮肤科杂志(2014年4期)2014-12-19氨磺必利与利培酮治疗精神分裂症对照研究中国药业(2014年17期)2014-05-26







