基于miR-34a-5p/SIRT1通路探讨壮医药线点灸治疗偏头痛模型大鼠的作用机制
时间:2023-06-16 21:35:02 来源:雅意学习网 本文已影响 人 
范小婷 ,沈小淞 ,施学丽 ,刘姣 ,梁弘 ,赵明阳 ,林辰
1.广西中医药大学壮医药学院,广西 南宁 530001;
2.广西中医药大学第一附属医院,广西 南宁 530023;
3.广西中医药大学研究生院,广西 南宁 530001
偏头痛是一种以头部疼痛为主症,伴发恶心、呕吐等自主神经功能障碍的慢性神经血管性疾病[1]。有文献报道,按失能所致生命年损失计算,偏头痛为我国第5位致残性疾病,其高发病率及致残率对患者生活质量造成巨大影响[2]。现代医学治疗偏头痛多以缓解疼痛为主,但所用药物对消化系统、心血管系统等有一定不良反应[3]。壮医药线点灸具有降低炎症、提高机体免疫功能作用[4-5],对偏头痛防治有独特优势[6]。三叉神经血管系统(TGVS)激活引起的神经源性炎症反应是偏头痛发病的关键环节[7],miR-34a与炎症反应关系密切,其高表达可促进炎症发展[8]。沉默信息调节因子(SIRT)1是组蛋白修饰的去乙酰化酶,通过去乙酰化核因子(NF)-κB发挥抗炎作用[9],是miR-34a的靶基因[10]。研究发现,miR-34a-5p/SIRT1通路介导偏头痛发病过程,调控miR-34a-5p/SIRT1通路,抑制乙酰化NF-κB p65(Ac-NF-κB p65)表达可缓解大鼠偏头痛[11]。壮医药线点灸能调控SIRT1/NF-κB通路[12]。本研究以硝酸甘油诱导偏头痛模型大鼠为研究对象,观察壮医药线点灸对脑组织miR-34a-5p/SIRT1信号通路的影响,揭示其治疗偏头痛的作用机制。
1.1 动物与分组
SPF级雄性SD大鼠40只,体质量(200±25)g,购于长沙市天勤生物技术有限公司,动物许可证号SCXK(湘)2019-0014。饲养于广西中医药大学实验动物中心清洁级动物房,室温(23±2)℃,湿度50%~65%,12 h明暗交替,自由摄食饮水。本实验相关操作均按照《关于善待实验动物的指导性意见》有关规定进行,并通过广西中医药大学实验动物福利伦理委员会审批(DW20211224-222)。
1.2 主要试剂与仪器
硝酸甘油注射液(山西康宝生物制品股份有限公司,批号200707L2641),SIRT1抑制剂EX-527(美国Selleck,批号S1541),降钙素基因相关肽(CGRP)、NF-κB、肿瘤坏死因子(TNF)-α ELISA Kit(武汉贝茵莱生物科技有限公司,批号均为20220410),RIPA裂解液(北京索莱宝科技有限公司,批号20220310),SIRT1抗体(北京索莱宝科技有限公司,批号20220413),Ac-NF-κB p65抗体(江苏亲科生物研究中心有限公司,批号AF3795),NF-κB p65抗体、TNF-α抗体(武汉贝茵莱生物科技有限公司,批号20211210、20210910),反转录试剂盒、荧光定量mix(武汉莫纳生物科技有限公司,批号140609、140450),TUNEL试剂盒(武汉赛维尔生物科技有限公司,批号MPC2103014)。酶标分析仪(南京德铁,型号HBS-1096A),低温离心机(德国Eppendorf,型号5418R),多功能酶标仪(美国MD,型号FilterMax F3),蛋白转印模块(美国Bio-Rad,型号Mini Trans-Blot Cell),凝胶成像系统(上海碧云天生物技术有限公司,型号EI600C),荧光定量PCR仪(瑞士Roche,型号Light Cycler®96),病理切片机(上海徕卡仪器有限公司,型号RM2016),石蜡包埋机(武汉俊杰电子有限公司,型号JB-P5),显微镜、成像系统(日本尼康,型号E100、DS-U3)。
1.3 分组及造模
大鼠适应性饲养1周后,随机分为空白对照组、模型对照组、点灸组、点灸+EX-527组和点灸+生理盐水组,每组8只。参考文献[13-14]建立偏头痛大鼠模型,分别于第1、5、9、13、14日颈部皮下注射硝酸甘油注射液10 mg/kg,空白对照组注射0.9%氯化钠注射液10 mg/kg,共5次。大鼠注射后出现前肢频繁挠头、双耳发红、咬尾、爬笼次数增多、往返运动增多、烦躁不安等行为提示造模成功[15-16]。
1.4 干预
第1日造模成功30 min后开始干预,点灸组、点灸+EX-527组和点灸+生理盐水组选取大鼠“合谷”(双)、“太冲”(双)和“脐环穴”[17-19],脐环穴3穴、6穴、9穴、12穴分别位于肚脐正左方、正下方、正右方和正上方(旁开2.5 mm)。将大鼠固定于特制鼠板,剃除穴位处毛发,将壮医药线(直径0.7 mm)点燃,待火候形成珠火,立刻用轻手法施灸于穴位上,火灭即起为1壮,每穴点灸2壮,每日1次,连续14 d;
点灸+EX-527组于点灸后腹腔注射EX-527(5 mg/kg)[20];
点灸+生理盐水组于点灸后腹腔注射生理盐水(5 mg/kg)。空白对照组和模型对照组仅固定,不干预。
1.5 取材
第14日对大鼠进行行为学评分后,2%戊巴比妥钠40 mg/kg腹腔注射麻醉,快速腹主动脉采血5 mL,3 000 r/min离心10 min,收集血清,-20 ℃冰箱保存备用。将大鼠断头处死,冰上分离中脑导水管周围灰质区,沿矢状位平均分成2部分:一部分于-80 ℃冰箱保存,用于Western blot、qPCR检测;
另一部分用4%多聚甲醛固定后,制作石蜡切片,用于HE染色和TUNEL染色。
1.6 指标检测
1.6.1 行为学评分
第14日干预后对大鼠进行行为学评分[21]。记录各组大鼠挠头、咬尾、爬笼、往返运动次数,每个行为出现1次计1分。
1.6.2 ELISA检测
根据ELISA试剂盒说明书进行操作,测定各组大鼠血清CGRP、NF-κB、TNF-α含量。
1.6.3 qPCR检测
取中脑组织20 mg加入1 mL Trizol,低温研磨机研磨,加入氯仿200 μL漩涡震荡30 s,4 ℃、12 000 r/min离心15 min,取上清液,沉淀、干燥RNA后,DEPC水溶解,酶标仪测定浓度和纯度。配制反转录体系,反转录得到cDNA,用cDNA作为扩增模板,配制20 μL PCR体系。反应条件:95 ℃预变性30 s,95 ℃变性15 s,60 ℃退火/延伸30 s。采用2-ΔΔCt法计算mRNA相对表达量。引物序列见表1。

表1 各基因PCR引物序列
1.6.4 Western blot检测
取中脑组织剪碎,每20 mg组织加入200 μL裂解液,低温高速组织研磨仪研磨,4 ℃、12 000 r/min离心15 min,取上清,BCA试剂盒测定蛋白浓度。快速凝胶制备试剂盒制胶,加样,电泳,转膜,PVDF膜放入快速封闭液中封闭30 min,分别置于SIRT1一抗(1∶1 000)、Ac-NF-κB p65一抗(1∶1 000)、NF-κB p65一抗(1∶2 000)、TNF-α一抗(1∶1 000)、GAPDH一抗(1∶2 000)中,4 ℃摇床孵育过夜。TBST洗膜,将膜放入HRP标记山羊抗兔二抗(1∶10 000)中,37 ℃摇床孵育1 h。TBST洗膜,ECL超敏化学发光液浸泡,凝胶成像系统显色,Image J软件分析条带灰度值。
1.6.5 HE染色
石蜡切片65 ℃烤片2 h,脱蜡至水,滴加苏木素染液染色5 min,自来水浸泡,分化,返蓝,水洗,滴加伊红染液染色5 min,无水乙醇脱水,中性树胶封片,显微镜下观察中脑组织病理变化。
1.6.6 TUNEL染色
根据凋亡试剂盒说明书进行TUNEL染色,光学显微镜下采集图像,细胞核棕黄色代表凋亡细胞,每张切片随机选取5个不重叠视野,用CMIAS图像分析系统计算凋亡细胞数。
1.7 统计学方法
2.1 壮医药线点灸对模型大鼠行为学评分的影响
与空白对照组比较,模型对照组大鼠行为学评分明显升高(P<0.01);
与模型对照组比较,点灸组、点灸+EX-527组和点灸+生理盐水组大鼠行为学评分明显降低(P<0.05);
与点灸组比较,点灸+EX-527组大鼠行为学评分明显升高(P<0.05);
与点灸+EX-527组比较,点灸组+生理盐水组大鼠行为学评分明显降低(P<0.05)。见表2。
表2 各组大鼠行为学评分比较(,分)

表2 各组大鼠行为学评分比较(,分)
注:与空白对照组比较,**P<0.01;
与模型对照组比较,#P<0.05;
与点灸组比较,△P<0.05;
与点灸+EX-527组比较,&P<0.05
评分组别 只数12.13±1.64 43.88±4.19**27.63±2.39#33.25±3.28#△27.50±3.38#&空白对照组模型对照组点灸组点灸+EX-527组点灸+生理盐水组8 8 8 8 8
2.2 壮医药线点灸对模型大鼠血清降钙素基因相关肽、核因子-κB、肿瘤坏死因子α含量的影响
与空白对照组比较,模型对照组大鼠血清CGRP、NF-κB、TNF-α含量明显增加(P<0.01);
与模型对照组比较,点灸组、点灸+EX-527组和点灸+生理盐水组大鼠血清CGRP、NF-κB、TNF-α含量明显减少(P<0.05);
与点灸组比较,点灸+EX-527组大鼠血清CGRP、NF-κB、TNF-α含量明显增加(P<0.05);
与点灸+EX-527组比较,点灸组+生理盐水组大鼠血清CGRP、NF-κB、TNF-α 含量明显减少(P<0.05)。见表3。
表3 各组大鼠血清CGRP、NF-κB、TNF-α含量比较()

表3 各组大鼠血清CGRP、NF-κB、TNF-α含量比较()
注:与空白对照组比较,**P<0.01;
与模型对照组比较,#P<0.05;
与点灸组比较,△P<0.05;
与点灸+EX-527组比较,&P<0.05
组别TNF-α/(pg/mL)只数CGRP/(pg/mL)NF-κB/(μmol/L)空白对照组模型对照组点灸组点灸+EX-527组点灸+生理盐水组54.01± 9.01 151.14±21.58**85.06± 9.09#104.15±17.26#△89.21± 8.25#&8 8 8 8 8 104.87±12.45 248.02±22.84**151.65±12.81#194.69±28.75#△149.69±18.68#&32.54± 4.55 93.66±11.30**51.69± 6.53#66.29± 8.40#△47.83± 4.96#&
2.3 壮医药线点灸对模型大鼠中脑组织miR-34a-5p、沉默信息调节因子1、核因子-κB p65 mRNA表达的影响
与空白对照组比较,模型对照组大鼠中脑组织miR-34a-5p、NF-κB p65 mRNA表达升高(P<0.01),SIRT1 mRNA表达降低(P<0.01);
与模型对照组比较,点灸组、点灸+EX-527组和点灸+生理盐水组大鼠中脑组织miR-34a-5p、NF-κB p65 mRNA表达降低(P<0.05),SIRT1 mRNA表达升高(P<0.05);
与点灸组比较,点灸+EX-527组大鼠中脑组织miR-34a-5p、NF-κB p65 mRNA表达升高(P<0.05),SIRT1 mRNA表达降低(P<0.05);
与点灸+EX-527组比较,点灸组+生理盐水组大鼠中脑组织miR-34a-5p、NF-κB p65 mRNA表达降低(P<0.05),SIRT1 mRNA表达升高(P<0.05)。见表4。
表4 各组大鼠中脑组织miR-34a-5p、SIRT1、NF-κB p65 mRNA表达比较()

表4 各组大鼠中脑组织miR-34a-5p、SIRT1、NF-κB p65 mRNA表达比较()
注:与空白对照组比较,**P<0.01;
与模型对照组比较,#P<0.05;
与点灸组比较,△P<0.05;
与点灸+EX-527组比较,&P<0.05
组别空白对照组模型对照组点灸组点灸+EX-527组点灸+生理盐水组NF-κB p65 1.01±0.16 2.11±0.23**1.25±0.13#1.55±0.16#△1.30±0.14#&只数8 8 8 8 8 miR-34a-5p 1.01±0.11 1.89±0.24**1.32±0.15#1.63±0.17#△1.33±0.12#&SIRT1 1.01±0.14 0.37±0.05**0.76±0.12#0.62±0.08#△0.74±0.10#&
2.4 壮医药线点灸对模型大鼠中脑组织沉默信息调节因子1、乙酰化-核因子-κB p65、核因子-κB p65、肿瘤坏死因子α蛋白表达的影响
与空白对照组比较,模型对照组大鼠中脑组织SIRT1蛋白表达降低(P<0.01),Ac-NF-κB p65、NF-κB p65和TNF-α蛋白表达升高(P<0.01);
与模型对照组比较,点灸组、点灸+EX-527组和点灸+生理盐水组大鼠中脑组织SIRT1蛋白表达升高(P<0.05),Ac-NF-κB p65、NF-κB p65和TNF-α蛋白表达降低(P<0.05);
与点灸组比较,点灸+EX-527组大鼠中脑组织SIRT1蛋白表达降低(P<0.05),Ac-NF-κB p65、NF-κB p65和TNF-α蛋白表达升高(P<0.05);
与点灸+EX-527组比较,点灸+生理盐水组大鼠中脑组织SIRT1蛋白表达升高(P<0.05),Ac-NF-κB p65、NF-κB p65和 TNF-α 蛋白表达降低(P<0.05)。见图1、表5。
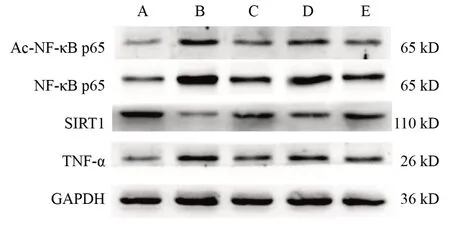
图1 各组大鼠中脑组织SIRT1、Ac-NF-κB p65、NF-κB p65、TNF-α蛋白免疫印迹
表5 各组大鼠中脑组织SIRT1、Ac-NF-κB p65、NF-κB p65、TNF-α蛋白表达比较()

表5 各组大鼠中脑组织SIRT1、Ac-NF-κB p65、NF-κB p65、TNF-α蛋白表达比较()
注:与空白对照组比较,**P<0.01;
与模型对照组比较,#P<0.05;
与点灸组比较,△P<0.05;
与点灸+EX-527组比较,&P<0.05
组别空白对照组模型对照组点灸组点灸+EX-527组点灸+生理盐水组0.46±0.06 0.92±0.11**0.59±0.07#0.75±0.09#△0.60±0.09#&8 8 8 8 8 1.10±0.11 0.49±0.07**0.84±0.10#0.67±0.07#△0.85±0.10#&0.38±0.07 0.86±0.09**0.57±0.07#0.71±0.08#△0.54±0.06#&0.46±0.06 1.15±0.13**0.65±0.09#0.86±0.10#△0.64±0.08#&TNF-α只数SIRT1Ac-NF-κB p65NF-κB p65
2.5 壮医药线点灸对模型大鼠中脑组织病理变化的影响
空白对照组大鼠中脑组织染色均匀,神经细胞排列紧密、整齐,边缘清晰,未见明显细胞肿胀、坏死等病理改变及炎症细胞浸润;
模型对照组大鼠中脑组织未见明显细胞肿胀、坏死等病理改变和炎症细胞浸润;
点灸组、点灸+EX-527组和点灸+生理盐水组大鼠中脑组织均未出现明显变化。总体上,各组大鼠中脑组织HE染色均未发现明显器质性病变,未见明显水肿、坏死等。见图2。
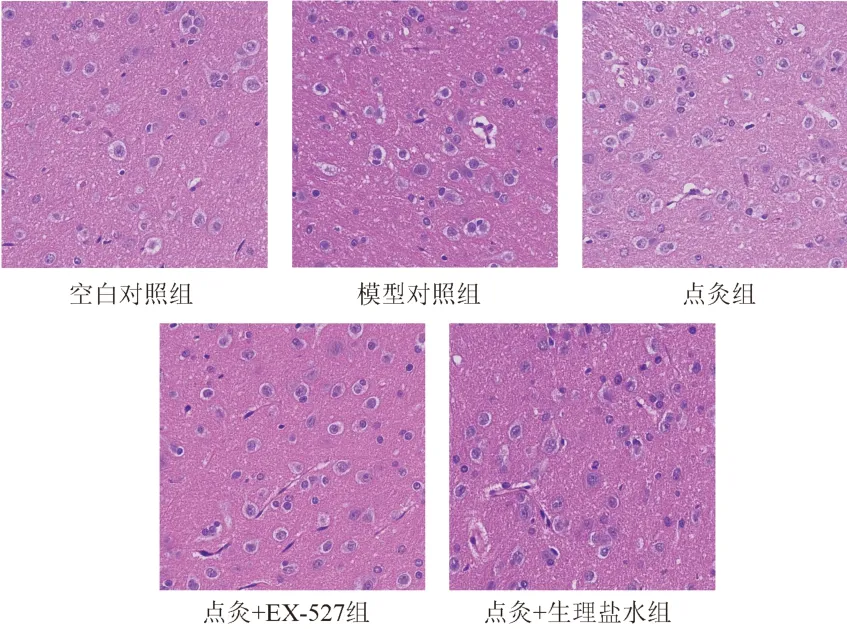
图2 各组大鼠中脑组织形态(HE染色,×400)
2.6 壮医药线点灸对模型大鼠中脑组织细胞凋亡的影响
各组大鼠中脑组织神经细胞均未见胞体缩小及胞核固缩,无明显细胞凋亡,胞核染色均匀,形态正常。见图3。

图3 各组大鼠中脑组织细胞凋亡阳性表达(TUNEL染色,×400)
壮医药线点灸是国家级非物质文化遗产,具有祛毒通络、调气止痛等功效,且无不良反应。临床应用壮医药线点灸治疗偏头痛效果满意[22]。壮医学认为,偏头痛发病主要与外来毒邪或内生毒邪阻滞“巧坞”(大脑)之龙路、火路,致机体三道两路不畅,气血失衡,天、地、人三气不能同步运行,终致“巧坞”道路网络不通或失养相关[23]。因此,治疗以通路止痛、均衡气血,复归天、地、人三气同步运行为要。壮医将肚脐比作“命蒂”,不仅能沟通五脏六腑与先天、后天,还与人整体相通应。且脐部位于人体中央,聚集天、地、人三部之精华,可承上启下,是气血运行之枢纽,与人体天气之下降、地气之上升、人气之调和密切相关。壮医药线点灸脐环穴(3穴、6穴、9穴、12穴)不仅能畅通道路,调整机体气机,还可沟通先天与后天,鼓舞正气,祛邪外出,从而恢复机体气血均衡、三气同步的自然状态,实现镇静安神止痛。从现代医学角度分析,刺激脐环穴可能通过神经、体液而调节神经、内分泌和免疫系统,从而改善各组织器官的功能活动[19]。合谷可行气通降,开窍镇静止痛以安神;
太冲善于理气止痛,调和气血以安神。文献报道,针灸合谷、太冲可调控NF-κB信号通路,改善大脑动脉血流速度及偏头痛症状[24]。
硝酸甘油制备偏头痛模型已得到认可[25],其在体内产生一氧化氮同时作用于血管和神经元,一方面通过强烈的扩血管作用,在血管周围产生无菌性炎症;
另一方面通过激活TGVS,激活神经源性炎症反应产生CGRP等,进一步引发偏头痛[26]。而CGRP释放入血是TGVS激活的重要环节,是引发偏头痛的重要因子[27]。本研究中,大鼠造模后出现行为学改变,与空白对照组比较,模型对照组大鼠行为学评分升高,且血清炎症因子TNF-α、NF-κB含量和舒血管神经肽CGRP含量增加,提示偏头痛模型造模成功。TNF-α、NF-κB、CGRP均参与偏头痛发生,TGVS被激活,处于炎症反应状态。干预后,点灸组、点灸+EX-527组和点灸+生理盐水组大鼠行为学评分均显著降低,血清TNF-α、NF-κB、CGRP含量减少,提示壮医药线点灸治疗可以抑制炎症因子NF-κB、TNF-α分泌,减少舒血管神经肽CGRP释放,有效调控偏头痛模型大鼠神经源性炎症反应,抑制神经血管扩张。有文献指出,TGVS存在炎症因子-CGRP-血管舒缩异常正反馈环路,进一步加强炎症反应和血管扩张,维持偏头痛持续状态[28]。由此,本研究中模型大鼠血清CGRP含量增加可能与炎症因子TNF-α含量增加相关,TGVS中炎症因子-CGRP-血管舒缩异常正反馈环路被激活,炎症因子TNF-α诱导CGRP释放,且存在恶性循环,而壮医药线点灸可以调控炎症因子-CGRP-血管舒缩异常环路,抑制炎症因子TNF-α合成与表达,从而拮抗CGRP。
miRNA是一类非编码单链RNAs,具有调控靶基因表达作用。目前已发现一些miRNAs与炎症反应[29]、慢性疼痛[30]等相关,其中miR-34a-5p与偏头痛发作相关[31]。静息状态下,NF-κB(p50、p65等亚单位)通常与其抑制因子以异源二聚体形式存在于细胞质中[32],当机体受到炎症等信号刺激时,NF-κB被激活,快速移位进入细胞核并大量转录,促使下游炎症因子分泌[33],从而参与炎症反应[34]。SIRT1是一种去乙酰化酶,也参与偏头痛病理过程[35]。SIRT1可直接作用于NF-κB p65,通过去乙酰化作用降低Ac-NF-κB p65水平,抑制机体炎症反应,调控下游炎症因子转录,进而改善炎症症状[36]。本研究发现,模型组大鼠中脑组织miR-34a-5p表达升高,SIRT1基因与蛋白表达降低,Ac-NF-κB p65、TNF-α蛋白及NF-κB p65基因和蛋白表达升高,提示miR-34a-5p能抑制SIRT1表达,导致SIRT1去乙酰化能力降低,NF-κB p65乙酰化,诱发NF-κB核移位,激活其介导的炎症信号通路,从而释放大量炎症因子。经壮医药线点灸干预后,miR-34a-5p表达降低,SIRT1基因和蛋白表达升高,Ac-NF-κB p65、TNF-α蛋白及NF-κB p65基因和蛋白表达降低,提示壮医药线点灸可通过抑制miR-34a-5p表达,促进SIRT1转录,提高其去乙酰化能力,抑制NF-κB激活,进而抑制下游炎症因子释放。注射SIRT1抑制剂EX-527后,出现拮抗壮医药线点灸的抗炎效应,而点灸+生理盐水组并未出现此种拮抗效果,进一步提示壮医药线点灸可通过上调SIRT1表达抑制炎症信号通路。
在本研究中模型对照组大鼠虽处于炎症状态,而中脑未出现组织形态改变和细胞凋亡,推测可能是在炎症早期,炎性细胞虽释放炎症因子,但炎症反应尚未达到引发炎性细胞浸润的程度,因而HE染色未见组织形态改变。尽管炎症会引发细胞凋亡,但与炎症因子浓度有关,并呈浓度依赖性[37]。本研究中,模型组大鼠中脑组织无明显细胞凋亡,推测低浓度的炎症因子虽引发了神经细胞功能障碍,但不足以导致神经细胞凋亡。
综上所述,壮医药线点灸脐环穴(3穴、6穴、9穴、12穴)、合谷、太冲可能通过调控miR-34a-5p/SIRT1信号通路,抑制miR-34a-5p表达,促进SIRT1转录,降低Ac-NF-κB p65水平,从而抑制NF-κB p65核转移,减少炎症因子分泌及舒血管神经肽CGRP释放,发挥治疗偏头痛作用。
猜你喜欢 生理盐水偏头痛空白对照 外源性透明质酸对人牙周膜细胞增殖及成牙骨质、成纤维分化的影响中日友好医院学报(2022年4期)2022-10-15Physiological Saline疯狂英语·初中天地(2022年5期)2022-07-06生理盐水疯狂英语·初中版(2022年5期)2022-05-11例析阴性对照与阳性对照在高中生物实验教学中的应用看世界·学术下半月(2020年7期)2020-09-10自制生理盐水中学生数理化·八年级物理人教版(2018年5期)2018-06-21过表达H3K9me3去甲基化酶对猪克隆胚胎体外发育效率的影响(内文第 96 ~ 101 页)图版广东农业科学(2017年10期)2018-01-25镜像治疗截肢后幻肢痛的随机对照试验中国医学创新(2017年22期)2017-11-15偏头痛与脑卒中关系的研究进展西南军医(2016年2期)2016-01-230.9g/dl生理盐水稀释解决EDTA依赖性血小板假性减少的方法研究现代检验医学杂志(2015年2期)2015-02-06穴位埋线治疗发作期偏头痛32例中医研究(2014年4期)2014-03-11







