新型冠状病毒N蛋白优势表位区段抗原的克隆表达及其诊断价值初步评价
时间:2023-06-16 16:00:05 来源:雅意学习网 本文已影响 人 
王坤,张玲,王超男,陈远哲,范占科,李垚,刘念,冯晓燕,付强,张贺秋,
1.滨州医学院,山东 烟台 264003;
2.东方海洋(北京)医学研究院,北京 100071
2019年底,全球陆续出现了一系列原因不明的肺炎病例,2020年2月11日,国际病毒分类委员会(ICTV)将该病原体新型冠状病毒正式命名为严重急性呼吸综合征冠状病毒2(severe acute respiratorysyndrome coronavirus2,SARS-CoV-2),世界卫生组织(WHO)将这一病毒导致的疾病正式命名为新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)[1]。SARS-CoV-2 属于冠状病毒β属,其遗传物质是单正链RNA,基因组包含29 891个核苷酸,与2003年暴发的SARS冠状病毒(SARS-CoV)的同源性为82%。SARS-CoV-2的结构蛋白主要包括棘突糖蛋白(S)、包膜糖蛋白(E)、膜糖蛋白(M)和核衣壳蛋白(N)。N蛋白与基因组RNA形成复合物,在病毒粒子组装过程中与病毒膜蛋白相互作用,在提高病毒转录和组装效率方面起关键作用。同时,N蛋白相对保守,在病毒的结构蛋白中所占比例最大,感染早期机体就能产生抗N蛋白的高水平抗体[2]。
血清学改变是COVID-19患者疾病发展过程中的普遍事件,会发生在感染的早期并一直持续至感染后期,甚至康复期。检测COVID-19患者血清中产生的抗体,可做到早诊断、早隔离、早治疗。病毒感染时,血清中出现的抗体主要是IgM和IgG。IgM抗体表明活跃或最近的感染;
IgG抗体在感染中出现较晚,通常表明既往感染,但不排除最近感染的患者,这些患者可能仍然具有传染性,特别是当同时检测到IgM抗体时[3]。为了提高抗体检测试剂的性能,我们利用生物学软件分析了N蛋白氨基酸序列的B细胞表位分布及疏水性,选取含有优势表位的抗原区段进行克隆表达,并对其诊断价值进行了初步评价。
1.1 材料
23例经临床确诊的COVID-19患者血清标本、20例乙肝患者血清样本和40例健康体检者血清样本均由广州市第八人民医院提供。大肠杆菌BL21、质粒pColdi为本室保存;
DNA限制内切酶BamHⅠ、EcoRⅠ购自Promega公司;
HRP标记的抗人IgG、IgM二抗购自Bethyl公司。
1.2 N蛋白抗原性分析及优势表位区段筛选
采用BIOSUN生物信息学软件分析新型冠状病毒N蛋白氨基酸序列,首先输入全长序列,然后利用B细胞表位分析功能,根据表位峰值的高低筛选确定优势表位区段。
1.3 N蛋白优势表位区段抗原表达质粒构建
由北京诺赛生物技术有限公司合成N蛋白优势表位抗原的编码基因,采用BamHⅠ、EcoRⅠ酶切位点,通过双酶切,将N蛋白优势表位抗原的编码基因插入同样经BamHⅠ、EcoRⅠ双酶切的pColdi质粒,获得pColdi-NP重组质粒。
1.4 抗原纯化及制备
将测序正确的重组表达质粒转化大肠杆菌BL21感受态细胞,挑取单菌落于3 mL含氨苄西林钠的LB液体培养基中,37℃振荡培养过夜,次日接种于250 mL新鲜的LB液体培养基中,37℃、160 r/min培养4 h至对数生长期,加150 μL 1 mol/L 的 IPTG,15℃诱导12~14 h,4℃、6000 r/min离心10 min收集菌体;
用25 mmol/L Tris-HCl(pH8.5)重悬菌体,冰浴超声,4℃、12 000 r/min离心10 min收集上清,过滤备用。Ni柱纯化,平衡后,将处理好的样品缓慢上样,待吸光度值开始上升时收集穿过液;
平衡后,依次用含25、250 mmol/L 咪唑的 25 mmol/L Tris-HCl(pH8.5)溶液洗脱,分别收集蛋白峰,电泳分析纯化产物,验证纯化后的目的蛋白。
1.5 抗原纯度及相对分子质量测定
利用Gel-ProR Analyzer Version 3.0 for Windows软件分析纯化后N蛋白优势表位抗原的相对分子质量和纯度。
1.6 N蛋白优势表位抗原活性鉴定
采用Biocore结合实验检测抗原抗体的相互作用,分别用PBS以1∶100稀释阳性血清和阴性血清。传感器预处理后,以5 μL/min的速率通入血清进行抗体绑定,通入时间分别为1.2 min。随后将1 mg/mL N蛋白优势表位抗原以30 μL/min的速率通入进行结合,通入时间为6 min。解离时间与结合时间相同。
1.7 ELISA法鉴定N蛋白优势表位抗原活性和特异性
采用ELISA方法检测人血清样本中抗新型冠状病毒N蛋白IgM/IgG抗体。用碳酸盐包被缓冲液(pH9.6)稀释N蛋白优势表位抗原,浓度为2.5 μg/mL,每孔包被100 μL,4℃过夜;
用洗涤液洗板2 次,200 μL/孔;
加入 110 μL/孔封闭液(0.01 mol/L PBS,1%BSA,pH7.2),室温封闭6 h;
用洗涤液洗板 5 次,200 μL/孔;
真空干燥 4~6 h。检测时,每孔加入100 μL样品稀释液后,分别加入5 μL待测血清,37℃反应30 min,弃液,用洗涤液洗板 5 次,300 μL/孔,拍干,加入 100 μL/孔 HRP标记的抗人IgM/IgG抗体,37℃孵育20 min;
用洗液洗板5次,200 μL/孔;
加入TMB显色底物A、B液各50 μL,充分混匀,37℃避光反应10 min;
加入 50 μL/孔 2 mol/L H2SO4终止反应,终止后 10 min内采用酶标仪测定各孔的D450nm值。
1.8 统计学分析
运用GraphPad Prism 5软件对检测结果进行t检验,以P<0.05为差异有统计学意义,绘制ROC曲线,以约登指数最大判断Cut-off值,≥Cut-off值判定为阳性,<Cut-off值判定为阴性,并计算灵敏度与特异性。
2.1 新型冠状病毒N蛋白优势表位抗原区段的确定
利用BIOSUN生物学软件分析寻找B细胞表位,根据表位分布图最终确定N蛋白优势表位抗原区段为15~215 aa(图1)。
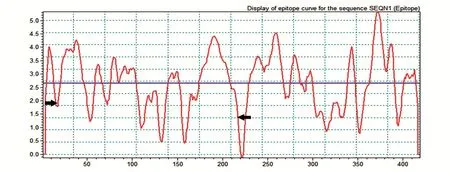
图1 新型冠状病毒N蛋白B细胞表位分析
2.2 抗原表达、纯化与鉴定
将测序正确的重组质粒转化大肠杆菌诱导表达,Ni柱纯化后获得纯化抗原,电泳分析纯化产物,验证纯化后的目的蛋白在250 mmol/L咪唑洗脱液中(图2)。Gel-ProR Analyzer Version 3.0 for Windows软件分析结果表明,纯化后N蛋白优势表位抗原的相对分子质量为28.10×103,纯度为96.23%(图3)。

图2 N蛋白优势表位区段抗原SDS-PAGE鉴定

图3 N蛋白优势表位抗原相对分子质量(A)和纯度(B)分析
2.3 N蛋白优势表位区段抗原活性的初步评价
采用Biocore结合实验检测抗原抗体的相互作用,动力学数据见表1。ka为结合速率常数,反映大分子间的作用结合速度;
kd为解离速率常数,反映分子复合物解离速度;
KD为解离平衡常数(KD=kd/ka)。结果显示,阳性血清与N蛋白优势表位抗原的结合速率常数显著高于阴性血清,同时,阳性血清与N蛋白优势表位抗原的解离速率常数显著低于阴性血清。

表1 抗原抗体结合力分析
2.4 COVID-19患者血清中的IgM、IgG抗体检测
用N蛋白优势表位区段抗原包被酶联板,间接ELISA法对23例经临床确诊的COVID-19患者血清标本、20例乙肝患者和40例健康体检者血清样本进行抗N抗原IgM和IgG抗体检测,结果如图4。COVID-19患者血清中IgM和IgG抗体水平均显著高于健康体检者和乙肝患者组(P<0.0001)。根据ROC曲线,IgM抗体诊断COVID-19的AUC值为0.797,IgG抗体诊断COVID-19的AUC值为0.998。对于IgM检测,以约登指数最大时的D450nm=0.123为临界值,IgM对COVID-19检测的灵敏度为 60.87%(14/23),特异性为 90%(36/40)。对于IgG检测,以约登指数最大时的D450nm=0.178为临界值,IgG对COVID-19检测的灵敏度为95.65%(22/23),特异性为100%(40/40)。

图4 N蛋白优势表位区段抗原血清学检测性能
2019年12月暴发的COVID-19感染性疾病在全球蔓延,成为国际关注的重大突发事件,据报道人与人之间的传播潜伏期为2~14 d,通过飞沫、受污染的手或物体表面传播[4]。随着SARSCoV-2感染的流行,迫切需要一种准确、快速、低成本的实验室病原学诊断方法。COVID-19流行数据表明,血清学反应,尤其是病毒特异性IgM和IgG,是有效的血清学辅助诊断标志物[5],有助于COVID-19的诊断,包括PCR结果阴性或无临床症状的感染者[6]。冠状病毒所编码的抗原中,N蛋白具有较高的免疫原性,可在早期感染时分泌到体液中,有可能作为抗原检测的生物标志物,同时抗N蛋白抗体可被用于检测冠状病毒感染[7]。
本研究为了获得高活性N蛋白抗原,通过生物学软件分析选取了优势表位区段抗原并获得了高效表达,采用Biocore结合实验初步确定15~215 aa优势表位区段抗原可以与COVID-19患者血清样本发生特异性抗原抗体反应。接下来放大样本进行检测,结果显示基于本研究优势表位区段抗原所建立的IgM和IgG检测方法可以很好地区分COVID-19患者和健康对照,尤其是IgG检测具有优异的检测性能。
在本研究中,抗NP-IgM(90%)和抗NP-IgG(100%)检测的特异性均较高,但本次实验检测的COVID-19患者中抗NP-IgG的阳性率(95.65%)却显著高于抗NP-IgM的阳性率(60.87%),这可能是由于IgM抗体出现在感染最早期,抗NP-IgM的血清转化发生在发病后7~12 d,而有些患者则发生在症状出现后1 d[8]。随着感染时间延长,一些患者的IgM抗体发生阴转,继而出现IgG抗体。血清中抗体的转化时间是因人而异的,同样,由于病情严重程度不同,患者的血清学反应也会有所不同[9]。本研究入组的COVID-19患者均已确诊并入院治疗,并非全部为早期感染者,所以NP-IgM的阳性率较低。根据本研究结果综合考虑,抗NP-IgG和抗NP-IgM对COVID-19的鉴别诊断都有价值,在早期筛查诊断中应该将两者联合使用,以提高诊断效率和筛查准确率。而在大规模流行病学调查中,由于IgG在患者体内存在时间更长久,NP-IgG是更好的检测标志物。
据报道,COVID-19抗体检测方法还可检测针对SARS-CoV-2中S蛋白的血清IgM/IgG抗体[10]。研究发现,抗N蛋白与抗S蛋白抗体联合检测可在发病后1周内将阳性率从41.7%显著提高至75%[11-12],将抗N蛋白抗体与抗S蛋白抗体检测相结合,是提高COVID-19筛查能力的更有效策略。因此,为了进一步提高抗体检测的灵敏度,我们在后期研究中设计将易表达的N蛋白优势表位区段与难表达的S蛋白优势表位区段构建成一个融合表达抗原,进一步提高检测的灵敏度和特异性。
猜你喜欢 表位区段抗原 中老铁路双线区段送电成功云南画报(2021年11期)2022-01-18生物信息学方法预测病原体抗原蛋白序列中多肽疫苗候选表位生命科学研究(2021年4期)2021-09-08负载抗原DC联合CIK对肝癌免疫微环境的影响昆明医科大学学报(2021年1期)2021-02-07乙型肝炎病毒B和C基因型S蛋白特异性CTL表位保守性分析温州医科大学学报(2019年4期)2019-04-28站内特殊区段电码化设计铁道通信信号(2018年8期)2018-11-10站内轨道区段最小长度的探讨铁道通信信号(2018年8期)2018-11-10联合T、B细胞表位设计多肽疫苗的研究进展①中国免疫学杂志(2017年1期)2017-01-17浅析分路不良区段解锁的特殊操作铁道通信信号(2016年4期)2016-06-01结核分枝杆菌抗原Lppx和MT0322人T细胞抗原表位的多态性研究医学研究杂志(2015年6期)2015-07-01APOBEC-3F和APOBEC-3G与乙肝核心抗原的相互作用研究癌变·畸变·突变(2015年3期)2015-02-27









