微生物通过巨噬细胞RIG-I乳酸化修饰促进结直肠癌肝转移的机制研究
时间:2023-06-12 12:50:11 来源:雅意学习网 本文已影响 人 
朱晓文,岳磊,赵文虎,古鉴,钱晓峰
南京医科大学第一附属医院普通外科,江苏 南京 210029
结直肠癌(colorectal cancer,CRC)是最常见的消化系统肿瘤之一,结直肠癌肝转移(colorectal cancer liver metastases,CRLM)是CRC 最常见的转移方式,也是其致死的主要因素。研究已表明,15%~25%的CRC患者在确诊同时伴有肝转移,另有20%~30%的患者在原发灶切除术后出现肝转移;
CRLM 患者的5 年生存率明显低于无转移的早期CRC 患者[1]。在治疗方面,转移灶切除是治疗CRLM 患者的唯一治愈手段,但超过75%的患者亦可出现术后复发[2];
现有的标准化疗方案使得部分患者受益,然而仍有部分患者会出现化疗耐药[3];
而新型靶向药物,免疫治疗等对提高患者长期存活效果不明显。因此,阐明CRLM 发生发展的分子机制是CRLM治疗领域亟待解决的核心问题。
CRLM 的发生机制主要包括肿瘤的器官倾向性、上皮间质转化、血管生成及肿瘤微环境[4]。近年来研究发现微生物存在于肿瘤微环境中,并是其重要组成部分。微生物主要通过诱导基因突变、调节致癌基因和免疫系统来促进肿瘤进展[5]。已有报道证实微生物参与调控CRC 发生发展,如Liu等[6]报道肿瘤内微生物群的异质性直接与CRC 的发生相关;
CRC 内微生物可通过干扰素基因刺激因子(stimulator of interferon genes,STING)信号调控抗肿瘤治疗效果[7];
Triner等[8]证实中性粒细胞通过限制微生物抑制小鼠结肠癌肿瘤生长。此外,在CRC中,细菌还可以突破肠道血管屏障定植到肝脏,招募先天免疫细胞如巨噬细胞,创造促肿瘤炎症环境,形成有利于癌细胞播种的转移前生态位,促进了CRLM的形成[9]。
巨噬细胞是肿瘤微环境中最丰富的浸润性免疫细胞,可极化为M1和M2两种细胞表型,M1以促炎为主,具有抗菌和免疫刺激特性;
而M2以抑炎为主,具有抑制T 细胞反应,促进肿瘤细胞生长、侵袭和转移的功能。肿瘤微环境代谢中调节巨噬细胞的主要是乳酸和腺苷。乳酸(lactate,Lac)是糖酵解的最终产物,积累的Lac与多种细胞过程密切相关,例如血管生成、缺氧、细菌刺激、巨噬细胞极化和T细胞活化等,同时也与多种疾病有紧密联系,包括肿瘤形成、败血症和自身免疫性疾病等。Lac主要通过其代谢功能发挥作用,如Lac可以被肿瘤细胞吸收转运至线粒体进行氧化磷酸化并提供能量;
但近期研究报道组蛋白赖氨酸乳酸化修饰作为Lac的非代谢功能参与感染、肿瘤发生发展等病理过程[10],如组蛋白H3K18的乳酸化修饰通过调控YTH 结构域家族蛋 白2(YTH domain-containing family protein 2,YTHDF2)的表达促进眼黑色素瘤的发生与发展[11]。本研究旨在探讨微生物对CRLM的影响及机制。
1.1 材料
结肠肿瘤及肝脏肿瘤组织样本来自南京医科大学第一附属医院因同时性结肠癌肝转移行结肠癌根治术及肝部分切除术的患者,获取组织并标记好患者信息,在液氮中冷冻转运,放置于-80 ℃深低温冰箱长期保存。
本研究使用的6~8 周雄性C57BL/6 小鼠,饲养条件为22 ℃恒温恒湿,12 h/12 h 昼夜交替光照,饲养笼独立通风,饮食水不限。
DMEM 细胞培养基,RPMI 细胞培养基,胎牛血清,青霉素-链霉素双抗(Gibco 公司,美国);
巨噬细胞集落刺激因子(macrophage-stimulating factor,MCSF)、脂多糖、Lac、氯膦酸二钠脂质体(clodronate liposome,Clod-Lip)(Sigma 公司,美国);
乳酸脱氢酶抑制剂(lactate dehydrogenase inhibitor,LDHi)、肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)(Med Chem Express 公司,美国);
大肠杆菌(Escherichia coli,E.coli)(河北北纳生物公司);
iNOS、CD206等PCR引物(Invitrogen 公司,美国);
HE 染色试剂盒、免疫组化试剂盒、DAB 显色试剂盒(浙江迈新公司);
RNA 逆转录试剂盒、SYBR®Premix Ex TaqTM(南京诺唯赞生物公司);
蛋白裂解液、蛋白酶抑制剂和磷酸酶抑制剂、聚丙烯酰胺凝胶配置试剂盒(南通碧云天生物公司);
Lac 测定试剂盒(南京建成公司);
BCA 蛋白定量试剂盒(Biosharp 公司,中国);
NF-κB(AF5006)兔单抗、羊抗兔多克隆IgG(#S0001)(Affinity Biosciences公司,美国)。
1.2 方法
1.2.1 16S rDNA测序
取40~70 mg 肿瘤组织,CTAB 法提取总DNA 后用Qubit 检查基因组DNA 的质量和浓度。对16 S rRNA 基因的可变区V2、V3、V5、V6、V8进行多重扩增,在Illumina Novaseq 6000 平台进行测序,最后使用QIME软件处理测序数据。
1.2.2 小鼠CRLM模型建立及分组
取6~8 周雄性C57BL/6 小鼠,麻醉后行左上腹横行切口,打开腹腔,于腹外侧游离并显露脾脏,用1 mL 注射器从脾下极平行进针约3 mm,注入MC38 肿瘤细胞悬液至脾被膜下,肿瘤细胞悬液浓度为1×106个/mL,每只注入0.1 mL,见注射部位脾被膜发白肿胀后拔出针头,压迫止血2 min,逐层关腹。共分为5 组:①对照组(Con 组);
②抗生素组(Abx组):将抗生素复合物(氨苄青霉素1 g/L,万古霉素500 mg/L,新霉素1 g/L,甲硝唑1 g/L)放入小鼠饮用水中混匀,持续饮用至建模结束;
③E.coli组:建模第11~15天抗生素处理(同上)后,第19~21天E.coli(1×109CFU/mL)100 μL 灌胃;
LDHi 组:④第7 天开始按照6 mg/kg 予以灌胃,持续至建模结束;
⑤Clod-Lip4组:建模前1 d腹腔注射200 μL,后间隔3 d给药,直至建模结束。第24 天处死小鼠,收集肝脏组织,每个实验组的样本量为5。计算肝表面转移结节体积[用直尺测量肿瘤的长径和短径(cm),代入公式计算肿瘤体积:V(cm3)=0.5×长径×短径2],并将转移肝组织做病理切片及HE染色。
1.2.3 骨髓来源巨噬细胞(bone marrow derived macrophages,BMDM)培养及分组
脱颈处死小鼠,分离股骨和胫骨。剥除骨骼上附着组织,用DMEM完全培养基将骨髓冲入50 mL离心管,1 250 r/min,离心5 min。加入红细胞裂解液混匀,再次离心,加入含有M-CSF的DMEM完全培养液,以1×106个/mL 密度铺在6 孔板上,添加培养基,置于37 ℃、5%CO2培养箱内培养,第4天换液,第7天观察细胞形态及贴壁情况。根据已发表文献结合String数据库查找与巨噬细胞有关的乳酸化位点并定制抗体RIG-Ilys852Ab、HMGB1lys88Ab和HMGB1lys114Ab。处理分为6组:①对照组(Con);
②乳酸组(15 mmol/L Lac);
③RIG-Ilys852Ab 组(15 mmol/L Lac+RIG-Ilys852Ab 3.7 mg/mL);
④HMGB1lys88Ab 组(15 mmol/L Lac +HMGB1lys88Ab 3.8 mg/mL);
⑤HMGB1lys114Ab 组(15 mmol/L Lac+HMGB1lys114Ab 1.6 mg/mL);
⑥TNFα组(15 mmol/L Lac+50 ng/mL TNF-α)。置于37 ℃、5%CO2培养箱内培养24 h 后收集细胞蛋白或RNA进行下一步实验。
1.2.4 细菌感染MC38细胞模型
用RPMI完全培养基培养MC38细胞,根据细胞数量,调整细菌与MC38细胞之比为感染复数=100∶1,在37 ℃、5%CO2培养箱内,E.coli与MC38 细胞共培养。
1.2.5 CCK8实验
将MC38细胞接种于96孔板上,每孔加入100 μL细胞悬液(细胞数约5×103个)。按上述建立E.coli感染MC38 细胞共培养模型为实验组,以无细菌感染MC38 细胞为对照组,每组设立5 个复孔,每孔加入10 μL CCK8 检测液,孵育2 h,酶标仪在450 nm处检测吸光值。
1.2.6 细胞外酸化率(extracellular acidification rate,ECAR)
将上述共培养细胞制成细胞悬液,每孔接种80 μL(细胞数约1×104个)至Seahorse专用96孔板。室温静置1 h,放入培养箱继续培养23 h。分别向探针板A、B 和C 孔加入葡萄糖、寡霉素和2-脱氧核糖各25 μL,校正探针板后,加入细胞培养板检测。
1.2.7 Lac浓度的测定
将肿瘤组织制备成组织匀浆,按照说明书配置酶工作液、显色剂。依次在酶标板上加入样本、酶工作液、显色剂,37 ℃孵育10 min,随后加入终止剂终止反应。取反应液250 μL,设置酶标仪波长530 nm,读数。
1.2.8 组织病理学分析
切除肝脏组织后,将其固定在10%的福尔马林缓冲液中,随后包埋在石蜡中。肝肿瘤组织切片用HE染色。
1.2.9 免疫荧光检测CD206、iNOS的表达
肝脏肿瘤标本石蜡切片脱蜡、抗原修复、血清封闭后,与一抗4 ℃孵育过夜,再加对应的HRP标记的二抗室温孵育50 min。PBS洗涤3次后滴加TSA,避光室温孵育10 min,TBST洗涤3次。滴加DAPI复染,封片,于荧光显微镜下观察并采集图像。
1.2.10 细胞免疫荧光检测
将细胞悬液接种的6 孔板中,培养过夜后用PBS 冲洗2次,加入4%多聚甲醛溶液固定15 min。再加入0.3%Triton通透10 min,PBS冲洗后血清封闭30 min,再次PBS 冲洗。与一抗4 ℃孵育过夜,PBS冲洗3 次;
与二抗室温孵育2 h,PBS 冲洗3 次;
DAPI染核后行荧光检测。
1.2.11 qPCR检测
收集经处理的各组细胞,提取RNA,使用Nano-Drop检测RNA的浓度及纯度。将其逆转录为cDNA后,按照纯水:SYBR mix:前引物:后引物:cDNA=3.6∶5.0∶0.2∶0.2∶1.0比例避光配置q-PCR体系(10 μL),行qPCR检测。反应结束后,拷贝数据进行后续分析。
1.2.12 Western blot实验
收集经处理的各组细胞,加入RIPA 裂解液提取总蛋白,BCA法进行定量。取等量蛋白进行SDS-聚丙烯酰胺凝胶电泳、转膜、5%脱脂奶粉溶液封闭1 h,加入一抗NF-κB(1∶1 000),于4 ℃孵育过夜,清洗后加入HRP标记的兔二抗(1∶200)室温孵育2 h,清洗后加入ECL发光剂于暗室中显影、曝光。
1.3 统计学方法
实验数据用均值依标准误(x 依Sx)表示。两组间比较用t检验,多组比较先用单因素方差分析(ANOVA),后用LSD法进行两两比较。P<0.05为差异有统计学意义。
2.1 微生物促进结直肠癌肝转移
群落Bar 图显示CRLM 患者的肝肿瘤与结肠肿瘤样本中存在微生物,同一个患者中肝转移瘤和结肠肿瘤菌群相似,但不同患者之间菌群丰度存在差异(图1A),提示微生物可能参与CRLM的发展。建立小鼠CRLM 模型,分别用抗生素(抑制菌群生长)和E.coli(加重菌群负荷)处理。相较于Con组,E.coli组肝转移瘤明显增多,体积增大,瘤内微生物浓度升高,HE 染色显示肿瘤细胞失去正常肝小叶结构,异型性更加明显,细胞形态紊乱,核深染。而抗生素处理后的Abx 组肝转移瘤明显少于Con组,体积明显减少(图1B~D),提示微生物促进CRLM 的发展。由于肝内存在大量巨噬细胞,其极化为M2 可促进肿瘤增殖转移[12],本研究运用免疫荧光染色分析了肿瘤内巨噬细胞的极化情况,发现E.coli组中CD206 表达相较于Con 组明显增强,而Abx 组表达减弱(图1E),提示微生物促进肿瘤内巨噬细胞M2极化。

图1 微生物促进结直肠癌肝转移Figure 1 Microbes promote liver metastasis of colorectal cancer
2.2 微生物通过影响巨噬细胞促进结直肠癌肝转移
为了验证微生物是否通过巨噬细胞来影响CRLM发展,在CRLM模型中将Clod-Lip注射到小鼠体内,其可被巨噬细胞吞噬,在细胞内代谢成不可水解的ATP类似物,抑制线粒体中的ADP/ATP转运机制,阻断线粒体呼吸链诱导巨噬细胞凋亡(图2A),结果显示耗竭巨噬细胞后肝转移瘤体积相较E.coli组显著减小(图2B),说明微生物通过调控巨噬细胞来影响CRLM。
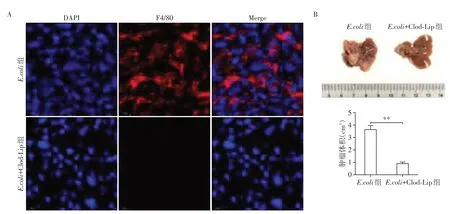
图2 微生物通过影响巨噬细胞促进小鼠结直肠癌肝转移Figure 2 Microbes promote liver metastasis of colorectal cancer in mice through macrophage
2.3 微生物影响肿瘤细胞糖酵解水平促进结直肠癌肝转移
为了探究微生物对肿瘤细胞的影响,将E.coli与肠癌细胞MC38共培养,发现与对照组相比,E.coli处理后MC38 的增殖率变化无明显差异(P=0.795),但其细胞外酸化率值及Lac 水平显著高于Con 组(图3A)。LDHi可抑制糖酵解过程中限速反应的关键分子乳酸脱氢酶(LDH),使丙酮酸不能转化为Lac。用LDHi 进行体内实验,结果显示抑制LDH后,肿瘤内Lac水平及肝转移瘤体积均低于E.coli组(图3B),提示微生物通过提高肿瘤细胞的糖酵解及Lac水平来影响CRLM。

图3 微生物影响肿瘤细胞糖酵解水平促进结直肠癌肝转移Figure 3 Microbes promote liver metastasis of colorectal cancer in mice through affecting tumor cellular glycolysis
2.4 Lac 通过RIG-Ilys852乳酸化修饰促进巨噬细胞M2 极化并降低线粒体抗病毒信号蛋白(mitochondrial antiviral signaling protein,MAVS)及其下游NFκB活化
为了探讨Lac 对巨噬细胞是否有调控作用,用15 mmol/L Lac 处理小鼠BMDM,免疫荧光检测发现Lac组CD206表达增多,iNOS表达减少(图4A);
qPCR显示Lac 组CD163 和ARG 的mRNA转录水平显著高,iNOS 和CD86 的mRNA 转录水平显著降低(图4B),说明Lac 可直接促进巨噬细胞极化为M2 细胞。Western blot检测显示不同浓度的Lac刺激巨噬细胞后,蛋白的泛乳酸化水平上升,其上升程度与Lac 浓度成正比,存在剂量依耐性(图4C)。将其与Lac、巨噬细胞共培养24 h,免疫荧光检测显示相较于Lac组,RIG-Ilys852Ab 处理后巨噬细胞的CD206 表达降低,iNOS表达升高;
而HMGB1lys88,HMGB1lys114处理后巨噬细胞CD206及iNOS表达均比Con组高(图4D),提示RIG-Ilys852是决定巨噬细胞极化方向的乳酸化修饰位点。为了探讨视黄酸诱导基因I(RIG-I)的乳酸化修饰是否影响下游通路,运用分子模拟预测发现RIG-I的乳酸化修饰可导致原阳离子-π(CATIONPI)键的丢失,降低了MAVS 的活化(图4E);
Western blot显示RIG-I-MAVS 下游核因子κB(NF-κB)在Lac 处理巨噬细胞后表达明显减弱(图4F),提示RIG-I 的乳酸化修饰可降低NF-κB 的表达。用NFκB 激动剂TNF-α与乳酸一同处理巨噬细胞,qPCR显示TNF-α 处理后巨噬细胞ARG 和CD163 的mRNA 转录水平较Lac 组降低(图4G),表明NF-κB可抑制巨噬细胞M2极化。综上,乳酸通过RIG-Ilys852乳酸化修饰下调NF-κB调控巨噬细胞极化。

图4 乳酸通过RIG-Ilys852乳酸化修饰促进巨噬细胞M2极化并降低MAVS及其下游NF-κB活化Figure 4 Lactate promoted M2 polarization of macrophages and decreased the activation of MAVS and NF-κB through RIG-Ilys852lactylation
肝脏因其独特的解剖学位置和免疫抑制环境,使得肝外肿瘤易于转移播种至肝脏形成肝转移瘤,最常见的原发性肿瘤是CRC,高达60%的患者在5年内发生远处转移。当转移到远处器官时,患者的5年生存率由64.9%下降至至12.5%[13]。近年来,越来越多研究报道微生物组已成为许多消化道恶性肿瘤(包括喉癌、食道癌、胃癌和CRC)、胰腺癌、原发性肝癌的致癌因素[14]。但微生物在CRLM中的作用尚不明确。
为研究微生物是否促进CRLM,课题组在前期运用16S rDNA 测序研究了同步发生肝转移的CRC患者临床切除样本中的肿瘤微生物组成,发现CRLM患者的肝肿瘤与结肠肿瘤样本中均存在微生物,且组成相似。然后进一步在小鼠模型上验证,结果发现大肠杆菌处理后肿瘤内微生物含量显著升高,肿瘤体积增大,肿瘤细胞异型性更为明显;
而抗生素治疗减少肠道微生物负荷后发现肿瘤减少。在肿瘤的发生及恶性进展中,Warburg效应(有氧糖酵解)是其关键代谢特征之一,指肿瘤细胞在有氧条件下,葡萄糖通过糖酵解产生Lac。既往研究表明糖酵解关键酶GLUT1 的高表达可促进肿瘤的有氧糖酵解和转移[15]。另有报道实体肿瘤中的Lac水平与肿瘤远处转移的发生率呈正相关[16]。本研究发现,微生物可提升其糖酵解和Lac水平;
同时小鼠模型中LDHi 灌胃可通过抑制Lac 形成影响肿瘤进展,说明微生物通过提升肿瘤细胞糖酵解水平产生Lac 来影响CRLM。巨噬细胞是肿瘤微环境中最常见的免疫细胞,微环境中的多种因素如Lac、缺氧、淋巴细胞衍生因子、纤维化可诱导巨噬细胞表现出不同的表型[17]。小鼠CRLM 模型中,大肠杆菌处理后的小鼠肝转移瘤内M2 样巨噬细胞明显增多,此外运用Clod-Lip 耗竭体内巨噬细胞可废除微生物对肿瘤大小的影响,提示微生物调控巨噬细胞来促进CRLM,但其否通过乳酸直接调控巨噬细胞尚不明确。
在体外实验中Lac 刺激巨噬细胞后,巨噬细胞M2相关基因表达增加,泛乳酸化抗体检测验证了乳酸化修饰存在于Lac 对巨噬细胞的极化调控过程。组蛋白的赖氨酸乳酸化是一种全新表观遗传修饰,是Lac发挥功能的重要方式。目前研究已表明乳酸化修饰在炎症、纤维化、干细胞分化及肿瘤中起重要作用[10]。为进一步明确乳酸化修饰的位点,定制了不同乳酸化修饰位点的抗体并检测这些抗体对Lac调控巨噬细胞极化的影响,发现RIG-Ilys852位点是决定巨噬细胞极化方向的乳酸化修饰位点。而在脓毒症中巨噬细胞是通过p300/CBP 依赖性机制促进高迁移率族蛋白B1(high mobility group box 1,HMGB1)的乳酸化,加重疾病的进展[18],提示Lac通过不同的乳酸化修饰位点影响疾病的进展。RIG-I样受体是DExD/H 盒RNA 解旋酶家族,在识别病毒RNA启动并调节抗病毒免疫反应中起重要作用。RIG-I活化后,其构象发生改变,招募线粒体外膜的MAVS发生聚集,一方面引起下游干扰素调节因子3(interferon regulatory factor,IRF3)和IRF7 磷酸化,驱动入核,促进I型干扰素的产生,另一方面通过肿瘤坏死因子受体相关因子2/6(TNF receptor associated factor,TRAF2/6)招募核因子κB 激酶抑制剂(inhibitor of kappa B kinase,IKK)复合物,磷酸化核因子κB 抑制剂(inhibitor of NF-κB,IκB)蛋白,释放NF-κB,发生二聚化入核,诱导促炎细胞因子的表达[19]。为了探讨RIG-I的乳酸化修饰是否影响下游通路,运用分子模拟显示RIG-Ilys852位点乳酸化可降低其与MAVS的结合,并发现其下游NF-κB 在Lac 处理后巨噬细胞后表达明显减弱。此外,用NF-κB 激动剂TNF-α与Lac一同处理巨噬细胞后发现,巨噬细胞M2标志物转录水平下降,提示乳酸通过RIG-Ilys852乳酸化修饰下调NF-κB调控巨噬细胞极化。
综上所述,本研究表明微生物促进CRLM,其可能机制是微生物促进瘤内糖酵解和Lac 形成,Lac 则通过RIG-Ilys852乳酸化修饰降低MAVS 及其下游NF-κB 活化,诱导巨噬细胞发生M2 样极化,发挥负性免疫调节作用促进肿瘤进展。本研究有助于进一步了解CRLM 进展的相关机制,同时对乳酸化修饰调控巨噬细胞功能的病理生理机制进行深入挖掘,为临床相关疾病的预防、诊断和治疗提供新思路和理论依据。
猜你喜欢 糖酵解极化孵育 认知能力、技术进步与就业极化现代财经-天津财经大学学报(2022年5期)2022-06-01极化雷达导引头干扰技术研究航天电子对抗(2022年2期)2022-05-24基于干扰重构和盲源分离的混合极化抗SMSP干扰北京航空航天大学学报(2021年9期)2021-11-02优化后精液孵育时间对精子DNA完整性、顶体反应率及IUI临床结局的影响江西医药(2020年4期)2020-04-28糖酵解与动脉粥样硬化进展中国循证心血管医学杂志(2020年11期)2020-01-08白头翁皂苷PSA对SW480人结直肠癌细胞糖酵解途径关键蛋白及调节因子HIF-1α的影响中成药(2019年12期)2020-01-04非理想极化敏感阵列测向性能分析航天电子对抗(2019年4期)2019-06-02三物黄芩汤组分(群)配伍在大鼠肝微粒体孵育模型中的相互作用中成药(2017年9期)2017-12-19大鼠肝微粒体孵育体系中2种成分的测定及其代谢中成药(2017年5期)2017-06-13放射对口腔鳞癌细胞DNA损伤和糖酵解的影响中华老年口腔医学杂志(2016年4期)2017-01-15







