脂肪间充质干细胞条件培养基通过降低细胞氧化应激水平改善皮肤衰老表型
时间:2023-05-29 16:40:14 来源:雅意学习网 本文已影响 人 
汪婧雯,杜方舟,3,汪季琳淋,武月,余爽,张京钟
(中国科学院苏州生物医学工程技术研究所1医学检验室,2医学电子室,苏州 215163;
3中国科学技术大学,合肥 230026;
4苏州京赛诺生物科技有限公司,苏州 215163)
皮肤衰老是目前皮肤科学领域较热门的研究方向[1]。紫外线辐射是皮肤衰老的主要因素,对皮肤的伤害最为严重[2,3]。当过量的紫外线照射皮肤,会使皮肤组织细胞因氧化应激水平升高而产生过量的活性氧簇(reactive oxygen species,ROS),过量的ROS会破坏细胞的抗氧化系统,损伤细胞结构,引起细胞凋亡[4,5]。
干细胞是一种具有自我更新和分化潜能的功能细胞,为多种难治性重大疾病提供新的解决策略[6]。脂肪间充质干细胞(adipose-derived mesenchymal stem cells,ADSCs)来源于脂肪组织,是目前被广泛研究的一类成体干细胞,来源丰富且易提取,是理想的种子细胞[7-9]。干细胞在生长过程中向培养基中分泌大量的生物活性物质,这些旁分泌物会改善细胞的生理状态,具有免疫调节能力、抗炎能力等生物活性[10,11]。干细胞的条件培养基(conditioned medium,CM)不仅富含干细胞的旁分泌物,而且具备比干细胞存储容易和应用更安全的优势。
研究表明CM能够抑制细胞衰老或降低细胞氧化应激水平[12],但对于CM治疗皮肤光老化与抑制细胞氧化应激水平的直接联系研究较少。本文针对皮肤光老化与细胞氧化应激之间的关系展开研究,证明CM改善皮肤衰老是通过下调细胞氧化应激水平实现的,为临床上治疗皮肤衰老提供新的研究依据。
1 主要试剂
Ultra CULTURE无血清培养基(瑞士Lonza公司);
CCK-8试剂盒(cell counting kit-8,CCK-8)(日本Dojindo公司);
超氧化物阴离子荧光探针(上海碧云天公司);
细胞衰老β-半乳糖苷酶(senescence-associated β-galactosidase,SA-β-gal)染色试剂盒(上海碧云天公司);
总超氧化物歧化酶(superoxide dismutase,SOD)测试盒(南京建成生物工程研究所);
谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)测试盒(南京建成生物工程研究所);
Masson染色试剂盒(美国Solarbio公司);
Weigert弹力纤维染色液(雷根生物公司);
RNA提取试剂盒(美国Omega公司)。
2 主要仪器
V arioskan LUX VL0L00D0酶 标 仪(Thermo Fisher Scientific);
QuantStudio 1实时荧光定量PCR仪(Thermo Fisher Scientific);
Nexcope NIB900倒置荧光显微镜(宁波永新光学股份有限公司);
日立U-3900H紫外可见分光光度计(日立科学仪器)。
3 皮肤衰老动物模型及治疗
选择6周龄雌性BALB/c Nude裸鼠用于构建皮肤衰老动物模型,购入后于SPF级动物实验室中饲养一周。采用UVB-313灯管安装于自制的紫外线辐射箱中,作为辐射光源。待光源稳定后,将裸鼠固定于辐射箱中进行照射,根据说明,最小红斑量(minimal erythema dose,MED)为75 mJ/cm2,第一周按1 MED进行照射,以后每周递增1个MED,直至第四周4 MED为止(图1)。在裸鼠背部划分四个实验区域,每个区域中心设置一个注射点并进行标记,分别在标记的点位上给予皮下注射生理盐水和CM 50 μL,隔日一次,连续4周。所有动物实验均按照《美国国立卫生研究院实验动物护理与使用指南》进行,并经过中国科学院生物研究伦理委员会批准(批准号:2018-A21)。
4 组织化学及免疫荧光染色
施加干预4周后处死裸鼠,在对应的背部皮肤位置切取约1×1 cm2组织,浸泡在4%多聚甲醛溶液中固定,4 ℃过夜。按常规方法制备6 μm石蜡切片。对组织切片进行Masson染色和Weigert弹力纤维染色,在倒置显微镜下观察并拍照,用Image J软件对染色结果进行量化。用抗Ki-67抗体(1:100)和抗α-SMA抗体(1:300)孵育组织切片,然后进行免疫荧光染色,用DAPI(4’,6-Diamidino-2-phenylindole)染料复染细胞核。置于荧光显微镜下观察。
5 细胞制备及氧化应激细胞模型建立
所有研究遵守《人类胚胎干细胞研究伦理指导原则》(中华人民共和国科学技术部和卫生部,2003年)。经机构审查委员会批准,从苏州大学附属第一医院获得脂肪或皮肤样本。
ADSCs的原代培养:取新鲜脂肪组织浸泡于含1%青霉素-链霉素的磷酸缓冲盐溶液(phosphate buffered saline,PBS)中,剔除血管、结缔组织等,加入胶原酶振荡消化30 min,终止消化后离心,弃上层液体,用PBS重悬沉淀,筛网过滤较大组织块,再次离心5 min,用含有10% FBS的DMEM培养基重悬细胞后接种至培养瓶培养。本研究中采用ADSCs培养至3~6代进行实验(图1)。
人真皮成纤维细胞的原代培养:取包皮环切术切除的新鲜组织,用含1%青霉素和链霉素的PBS漂洗两次后,浸泡30 min,剔除皮下脂肪、结缔组织等。将组织剪成0.5~1 cm2的皮片,用2 mg/mL的dispase Ⅱ 酶溶液,4 ℃消化过夜。分离表皮和真皮,将真皮剪碎置于培养瓶中,在培养箱静置2 h后,加入完全培养基继续培养(图1)。
氧化应激损伤细胞模型的建立:采用人真皮成纤维细胞。取传代培养至第3~6代的成纤维细胞接种于孔板内,置于37 ℃,5% CO2培养箱中培养24 h,待细胞贴壁后,更换含有H2O2(终浓度为200 μmol/L)的DMEM培养基培养2~4 h,之后更换正常DMEM培养基或CM继续培养48 h(图1)。
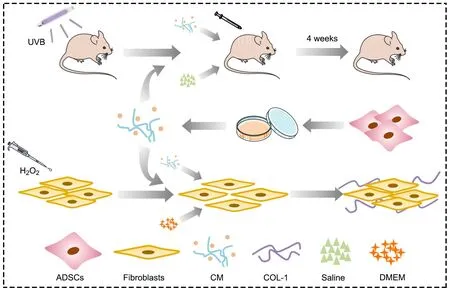
图1 CM影响皮肤衰老表型和细胞氧化应激水平的实验总体流程图。ADSCs扩增培养后收集CM,经皮下注射到皮肤衰老裸鼠模型或体外应用于H2O2处理的成纤维细胞,从细胞层面和在体实验两方面评估CM对皮肤衰老及氧化应激的影响Fig. 1 The experimental diagram of studying the CM effects on skin aging and oxidative stress in fibroblasts. CM was collected from ADSCs culture, followed by subcutaneous injection into the aging nude mouse model or application on the H2O2-treated fibroblasts. The effects of CM on senescent phenotype and the underlying mechanism were evaluated at both histological and cellular levels
6 CM制备
将ADSCs以8×104个/mL的密度接种于75 cm2培养瓶中,正常培养至细胞生长融合度为70%~80%时,吸弃原有含血清培养基,更换Ultra CULTURE无血清培养基继续培养48 h。收集细胞上清液。在4 ℃,200 g条件下离心15 min,弃沉淀。上清液用0.22 μm的滤膜过滤,所得滤液即为本研究中的CM。
7 CCK-8法细胞增殖实验
分别用无血清DMEM培养基和CM处理氧化应激细胞模型48 h后,加入CCK-8于培养箱中孵育2 h,酶标仪检测波长450 nm处的吸光度值,以630 nm为参比波长。
8 SA-β-gal染色
将细胞室温固定15 min,加入染色工作液37 ℃避光孵育过夜,次日用倒置显微镜随机选取5个视野进行拍照计数。计算公式为:SA-β-gal阳性率%=(蓝染细胞数/总细胞数)×100%。
9 细胞氧化应激水平测定
用终浓度为1 μmol/L的二氢乙锭(dihydroethidium,DHE)溶液避光处理细胞45 min,将细胞室温固定10 min,用DAPI染料复染细胞核,在倒置荧光显微镜的555 nm激发波长下观察红色荧光细胞强度,拍照并随机选取5个视野计数,计算细胞荧光阳性率,以此表示细胞内ROS含量。
用胰蛋白酶消化收集细胞,冰浴环境下超声破碎至细胞完全裂解,4 ℃,2000 r/min离心10 min,留取上清液,严格按照试剂盒上说明书操作,使用紫外可见分光光度计测定吸光度并计算SOD和GSHPX活性。
10 实时定量荧光PCR
用Trizol提取细胞的总RNA,并反转录成cDNA。在Real-time PCR仪上完成去乙酰化酶1(Sirtuin1,SIRT1)、I型胶原(collagen type I,COL-1)、Ⅲ型胶原(collagen type Ⅲ,COL-3)的基因定量及分析。相关基因的引物序列见表1,内参为GAPDH基因,采用2-ΔΔCt方法。

表1 实时定量 PCR 中的引物序列Tab. 1 Primer sequences in real-time PCR
11 统计学处理
以上实验均重复大于等于3次,所有数据采用GraphPad Prism 6.0统计软件进行分析。实验数据以平均数±标准差(±s)表示,采用单因素方差分析(ANOVA)对相关数据进行统计处理,以P<0.05视为具有统计学意义。
1 注射CM改善裸鼠皮肤光老化的表型
ADSCs扩增培养后收集的CM皮下注射到裸鼠光老化皮肤模型(图1),4周后Masson三色染色显示,裸鼠光老化皮肤模型中,注射Saline组胶原纤维层较薄,胶原纤维(蓝色部分)稀疏、松散。注射CM组的皮肤组织胶原纤维层相对较厚,胶原纤维排列均匀,纤维密度高于Saline组(图2A)。用Image J对染色结果进行量化,CM组胶原纤维面积占总面积的85.06 ± 3.47%,显著高于Saline组71.85 ± 3.92%(图2B)。
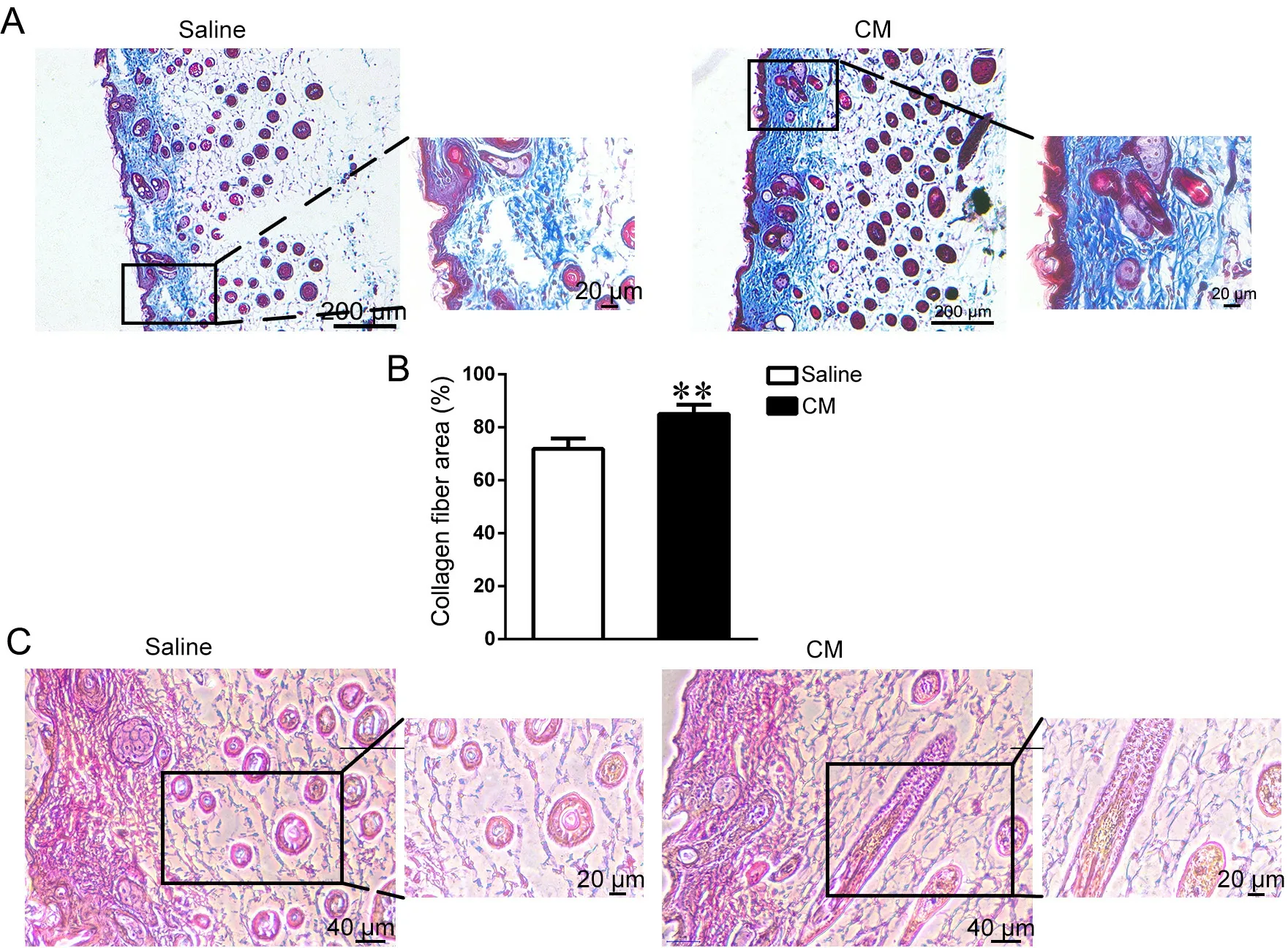
图2 注射CM对UV照射裸鼠模型皮肤组织中胶原纤维和弹力纤维的修复作用。A,裸鼠皮肤组织Masson三色染色结果(比例尺,200 μm和20 μm);
B,Masson染色结果ImageJ量化(n=3,**P<0.01);
C,裸鼠皮肤组织弹力纤维染色结果(比例尺,40 μm和20 μm)Fig. 2 The rescuing effects of CM on collagen and elastic fiber in skin tissue of nude mouse model exposed to UV radiation. A, Masson staining results of nude mouse skin tissue (scale bar, 200 μm and 20 μm); B, Image J quantification of Masson staining results (n=3, **P<0.01); C, elastic fiber staining of nude mouse skin tissue (scale bar, 40 μm and 20 μm)
弹力纤维染色结果显示,Saline组弹力纤维(蓝色部分)增粗且稀疏,呈现松散、断裂的状态,几乎没有延续,断裂的弹力纤维成点片状。CM组的皮肤组织弹力纤维则纤细、连续,且较Saline组数量增多(图2C)。
2 CM促进衰老皮肤中的细胞增殖和血管新生
对细胞增殖相关抗原ki67和α-平滑肌肌动蛋白α-SMA进行标记,免疫荧光染色结果显示(图3A、B),CM组皮肤组织中Ki-67和α-SMA的荧光强度和阳性率均明显高于Saline组。表明CM有助于提高皮肤组织内的细胞增殖活力和血管生成。

图3 CM对裸鼠皮肤组织血管生成和细胞增殖的影响。免疫荧光染色用于检测皮肤组织中α-SMA(A)和Ki-67(B)的表达;
比例尺,20 μmFig. 3 The Effects of CM on angiogenesis and cell proliferation in nude mice skin tissue. Immunofluorescence was used to detect the expression of α-SMA(A) and Ki-67 (B); scale bar, 20 μm
3 CM改善成纤维细胞衰老表型
成纤维细胞是皮肤胶原分泌的主要细胞类型,与皮肤衰老表型密切相关。ADSC来源的CM应用于H2O2处理的成纤维细胞,进一步观察CM对成纤维细胞衰老表型、胶原分泌及氧化应激相关基因的影响(图1)。CCK-8法分析显示,CM组细胞增殖数量显著高于Ctrl组,表明CM具有明显的促进成纤维细胞增殖的作用(图4A)。将H2O2诱导的氧化应激细胞模型记为H2O2模型组,H2O2诱导后CM培养的细胞记为H2O2+CM组,未经H2O2诱导正常培养的细胞记为Ctrl组。与Ctrl组相比,H2O2模型组SA-β-gal阳性细胞数显著增加(44.90 ± 3.84%);
与H2O2模型组相比,H2O2+CM组的阳性细胞率则显著下降(21.57 ± 1.60%)(图4C、D)。由此可见表明H2O2诱导后的成纤维细胞衰老模型建立成功,且CM可改善H2O2诱导的细胞衰老表型。
在分子水平上,SIRT1与胶原I及III的比例也与细胞衰老状态密切相关。与H2O2模型组相比,H2O2+CM组细胞中SIRT1和COL-1的mRNA相对水平显著上调(图4B、E),而COL-3的mRNA相对水平则显著下调(图4E)。
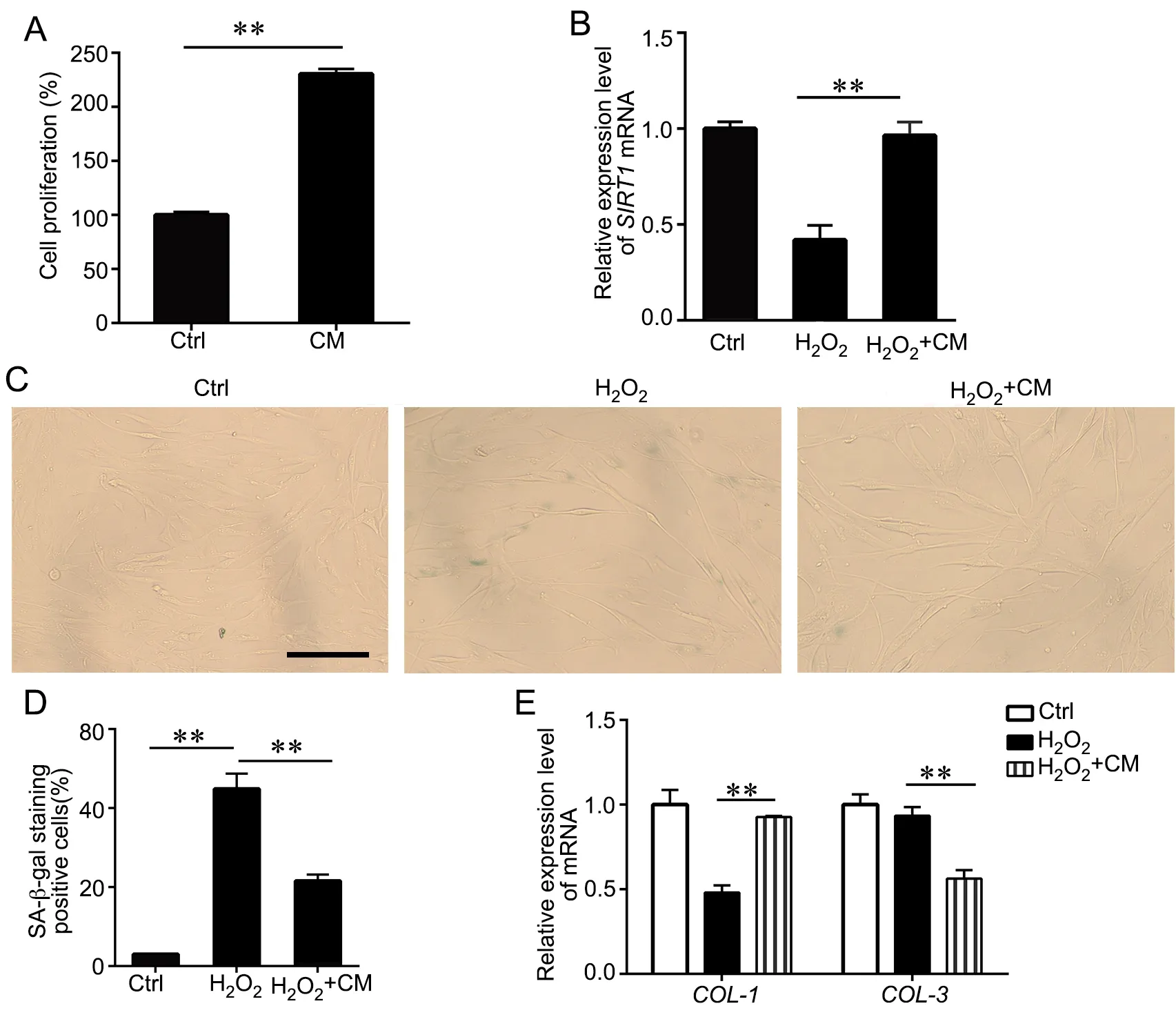
图4 CM和H2O2对成纤维细胞培养中细胞增殖和衰老的影响。A,CCK-8法评价细胞增殖活性;
B,SIRT1 mRNA在成纤维细胞中表达的qRT-PCR检测及定量分析;
C和D,成纤维细胞中SA-β-gal染色的代表性图像(C)(比例尺,100 μm)及定量分析(D);
E,COL-1和COL-3 mRNA在成纤维细胞中表达的qRT-PCR检测与定量分析。n=3;
**P<0.01Fig. 4 The effects of CM and H2O2 on cell proliferation and aging in the fibroblast culture. A, the cell proliferation activity was evaluated by CCK-8 assay; B, qRT-PCR detection and quantitative analysis of expression of SIRT1 mRNA in the fibroblasts; C and D, representative images (C)(scale bar, 100 μm) of SA-β-gal staining in fibroblasts and the quantitative analysis (D); E, qRT-PCR detection and quantitative analysis of the mRNA expression of COL-1 and COL-3 in the fibroblasts. n=3; **P<0.01
4 CM减轻H2O2导致的细胞氧化应激水平
与Ctrl组相比,H2O2模型组ROS水平升高至62.70 ± 2.5%(图5A、B),表明H2O2的强氧化性能有效诱导细胞产生ROS,ROS水平的升高与细胞衰老密切相关。经过CM培养后细胞内ROS水平下降至21.40 ± 3.24%,显著低于H2O2模型组(图5A、B)。
对细胞内SOD和GSH-PX活性测定显示,与Ctrl组相比,H2O2模型组的SOD、GSH-PX水平明显降低(图5C、D),表明在H2O2的强氧化性诱导下,细胞内的抗氧化酶活性明显下降,这与ROS水平结果相符合。与H2O2模型组相比,H2O2+CM组SOD水平明显升高(图5C、D)。由此表明CM能够降低细胞氧化应激水平,提高细胞抗氧化能力。
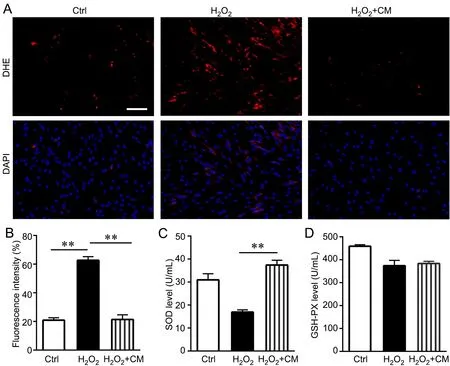
图5 CM对成纤维细胞氧化应激的影响。A,成纤维细胞中ROS含量的DHE荧光探针检测(比例尺,20 μm);
B,成纤维细胞中ROS水平的定量分析;
C,成纤维细胞中SOD含量的定量分析;
D,成纤维细胞中GSH-PX含量的定量分析。n=3;
**P<0.01Fig. 5 Effect of CM on oxidative stress in the fibroblasts. A, detection by DHE fluorescence probe of the content of ROS in the fibroblasts (scale bar, 20 μm); B, quantitative analysis of ROS level in the fibroblasts; C, quantitative analysis of SOD content in the fibroblasts; D, quantitative analysis of GSHPX content in the fibroblasts. n=3; **P<0.01
构建衰老模型的方法主要有H2O2诱导、UV射线诱导、D-半乳糖诱导[13]等,一般外源性老化多采用UV辐射诱导或H2O2诱导衰老模型[14]。本研究采用UV辐照的方法建立皮肤衰老裸鼠模型,模拟人皮肤衰老最主要的诱因;
细胞水平上则采用H2O2干预的方法,成功建立氧化应激细胞模型。
在体实验结果表明,CM促进了真皮层中的胶原纤维合成,使胶原密度显著升高,明显改善了由于UV辐照导致的弹力纤维增粗、稀疏、松散、断裂的情况,显著抑制皮肤衰老的表现。皮肤的衰老伴随着细胞增殖能力下降和血供减少,本研究利用KI-67和α-SMA标记细胞,来反应细胞增生的能力和血管新生情况。结果显示CM组皮肤组织的Ki-67和α-SMA的荧光强度以及阳性率均显著升高,表明CM能够促进皮肤组织细胞增殖,并在一定程度上促进血管的新生。
依据在体实验结果,本文分别从细胞增殖、SAβ-gal及氧化应激水平3个方面探索CM在细胞水平上改善皮肤衰老的机制。SA-β-gal是检验细胞衰老的经典标志酶之一。本研究证明,CM能够显著提高成纤维细胞的增殖活力,有效降低细胞衰老的比率。Xiong等人[15]发现清除人皮肤成纤维细胞中的ROS能有效促进皮肤伤口愈合和延缓衰老。DHE是常用的超氧化物阴离子荧光探针,利用DHE荧光探针对细胞进行染色,可直接反映细胞内ROS水平,本研究检测了细胞中的ROS含量以及存在的重要内源性抗氧化酶SOD和GSH-PX的活性。研究结果证明CM能够减少细胞内ROS,提高SOD活性,从而降低细胞氧化应激水平。
皮肤衰老主要是由于真皮层中细胞外基质的改变,当皮肤老化时,真皮层中胶原蛋白和弹性蛋白合成减少、分解增加,COL-1和COL-3比值在衰老过程中逐渐倒置,胶原逐渐变粗、出现异常交链,同时弹力纤维出现排列紊乱及碎片化现象[16]。成纤维细胞主要负责调节细胞外基质、胶原蛋白产生和伤口愈合,成纤维细胞在衰老过程中COL-1表达减少,与衰老、凋亡相关的基因表达增加,SIRT1基因则通过使底物蛋白的去乙酰化而调控细胞凋亡和衰老。因此本研究以成纤维细胞为对象,从在分子水平上探究SIRT1、COL-1、COL-3与细胞衰老之间的关系。本研究表明,CM能够上调SIRT1和COL-1 mRNA的表达,降低COL-3 mRNA的相对水平,从而促进胶原合成,减轻氧化应激引起的细胞损伤,改善细胞衰老。
综上,可以认为来源于ADSCs的CM通过降低皮肤细胞的氧化应激水平,提高细胞增殖能力,上调了SIRT1和COL-1基因表达水平,从而促进成纤维细胞对胶原的合成,改善皮肤衰老表型。
猜你喜欢 纤维细胞氧化应激染色 无限路及其笛卡尔积、直积的孪生α-距离边染色西北民族大学学报(自然科学版)(2022年2期)2022-07-06灯盏花乙素抗氧化应激机制在防治心脑血管疾病中的研究进展昆明医科大学学报(2022年4期)2022-05-23环状RNA与氧化应激互作机制的研究进展上海交通大学学报(医学版)(2022年3期)2022-05-05过氧化氢体外诱导小鼠胚胎成纤维细胞氧化损伤模型的构建和分析井冈山大学学报(自然科学版)(2022年1期)2022-02-28Tiger17促进口腔黏膜成纤维细胞的增殖和迁移昆明医科大学学报(2021年8期)2021-08-13节水染色和非水介质染色技术的研究进展纺织科技进展(2021年4期)2021-07-22滇南小耳猪胆道成纤维细胞的培养鉴定云南医药(2021年3期)2021-07-21若干Mycielski图的邻点扩展和可区别全染色兰州理工大学学报(2021年3期)2021-07-05成纤维细胞在皮肤创伤修复中的作用研究进展药学研究(2021年3期)2021-04-20微小核糖核酸-125b-5p抑制Caspase 2蛋白酶活性缓解脂多糖诱导的心肌细胞凋亡和氧化应激的研究心肺血管病杂志(2020年5期)2021-01-14








