大鼠急性肺栓塞模型的建立及CD147表达水平对栓塞大鼠肺动脉压力变化的影响
时间:2023-01-15 15:30:02 来源:雅意学习网 本文已影响 人 
卢光东 贾振宇 张金星 赵林波 施海彬
急性肺栓塞(acute pulmonary embolism,APE)是一种严重危害人类健康的心血管急症[1]。APE发生后,肺血管床的突然阻塞以及肺血管收缩造成肺血管阻力急剧升高,从而导致右心功能不全甚至右心衰竭[2]。因此,迅速降低肺血管阻力是改善APE患者预后的关键[3]。研究发现,炎症反应在APE后的肺血管收缩中起重要作用[4]。肺动脉堵塞后,大量的中性粒细胞及巨噬细胞聚集并快速释放和激活大量金属基质蛋白酶(matrix metalloproteinases,MMPs)。激活的 MMPs通过促进血管收缩因子ET-1[5-6]、降钙素基因相关肽[7]及肾上腺髓质素[8]等的产生引起肺血管收缩。但是,引起APE后肺组织炎性细胞聚集的机制尚不清楚。近来的研究发现,在缺氧、感染、氧化应激等条件刺激下,多种细胞表面的白细胞分化抗原CD147通过活化ERK1/2-NF-κB途径促进炎性细胞聚集,从而加速了炎性反应的发生[9]。但其在APE后肺组织炎症反应中是否起作用尚不清楚。因此,本研究拟以大鼠为实验动物,通过介入技术建立一种制作简单、可重复性高的APE动物模型,同时初步探讨APE发生后肺组织中CD147表达水平变化对栓塞大鼠肺动脉压力变化的影响。
一、研究对象
成年健康SPF级雄性Sprague-Dawley大鼠,体重300~320 g,购于北京维通利华实验动物有限公司,饲养于南京医科大学现代毒理学教育部重点实验室动物中心(每笼5只)。实验动物自由进食、进水,饲养室每隔12 h明暗交替,环境温度为(22±2)℃,相对湿度为50%~60%。本实验经南京医科大学伦理委员会审核批准(伦理号:IACUC-1701004)。
二、制备方法及模型建立
(一)栓塞颗粒的制备
模型建立前30 min,精密电子天平称量直径约300 μm的Sephadex G-50葡聚糖微球(美国GE公司)80 mg置于5 mL离心管内,注入2 mL生理盐水,震荡,置于室温备用。使用前再次手动震荡以使颗粒充分悬浮。
(二)大鼠APE模型的建立
电子天平称量大鼠质量,经腹腔注射10%水合氯醛(4 mL/kg)麻醉大鼠;
将大鼠仰卧位固定,去除右侧大腿内侧面毛发并消毒;
用手术刀沿股动静脉走行方向在大鼠右侧腹股沟区切开约1 cm小口暴露股动静脉,右手持生理盐水冲洗过的24 G静脉留置针,在手术显微镜视野下直接穿刺股静脉置鞘;
针鞘置入后注入0.2 mL生理盐水以检测通路是否通畅,固定备用;
用1 mL注射器经鞘管向股静脉内缓慢注射之前制备好的栓塞颗粒(12 mg/kg),注射时应呈间歇脉冲式,过程持续约5 min,以防注射过快导致动物猝死。假手术组大鼠置鞘成功后仅注入0.8 mL生理盐水;
药物注入结束后拔除针鞘并按压3~5 min,丝线缝合右侧腹股沟切口;
将大鼠移至适宜的环境待其自由苏醒。(本实验已剔除中途死亡大鼠)
三、实验动物分组及数据采集
实验动物共分为4组,每组12只,具体为:假手术组(右侧股静脉置鞘,仅注射0.8 mL生理盐水);
anti-CD147对照组[置鞘,先经股静脉注射0.5 mL生理盐水,后即刻将CD147单克隆抗体(Santa Cruz Biotechnology,sc-46700)以 3 mg/kg的量注入];
APE组(置鞘,注入栓塞颗粒建立APE模型,5 min后再注入0.3 mL生理盐水);
anti-CD147干预组(置鞘,注入栓塞颗粒建立APE模型,后即刻将CD147单克隆抗体以3 mg/kg的量注入)。每组中随机选6只大鼠,右颈静脉插管,用多通道生理记录仪PowerLab 8/30测量其建模后5、10、20、30、40、50 以及 60 min 平均肺动脉压(mean pulmonary arterial pressure,mPAP)。余每组中另外6只大鼠测量其建模24 h后的mPAP,测压结束后即刻处死大鼠,留取血浆及肺组织。血浆标本用于ELISA法检测TNF-α和IL-6(ELISA试剂盒,江苏菲亚生物科技有限公司)表达水平,右下肺组织用于测定髓过氧化物酶活性及CD147表达水平(Western blot),左下肺组织用于行病理学检查。
四、统计学方法
采用 SPSS 24.0软件行统计学分析,计数资料以率或构成比表示,计量资料以均数±标准差(±s)表示,组间差异行单因素方差分析,组间两两比较行Tukey检验,P<0.05时认为差异有统计学意义。
一、模型制作情况
4组大鼠体重无明显差异,所有大鼠均建模成功,技术成功率为100%。假手术组及anti-CD147对照组大鼠全部存活。APE组及anti-CD147干预组大鼠注入栓塞颗粒过程中出现口唇紫绀、呼吸急促,部分因呼吸心跳骤停而死亡,死亡率为22.6%(7/31)。假手术组大鼠肺组织外观呈均一粉红色(图1A);
APE组大鼠的肺组织呈红白相间地图样改变(图1B),肺组织病理切片上可见肺动脉内有栓塞颗粒及血栓形成(图1C)。

图1 假手术组和APE组大鼠肺组织外观
二、CD147单克隆抗体干预对栓塞大鼠mPAP的影响
假手术组及anti-CD147对照组间大鼠mPAP在建模后压力无明显差异且无明显变化;
APE组及 anti-CD147 干预组在建模后 5、10、20、30、40、50以及60 min mPAP均较假手术组明显升高(P<0.01),在建模40 min之内,两组之间mPAP无明显差异,在建模后50、60 min,anti-CD147干预组大鼠mPAP明显低于APE组(P<0.05),但仍较基线值明显升高(图2A)。建模24 h后,anti-CD147干预组大鼠mPAP仍明显低于APE组(P<0.01)(图2B)。

图2 各组大鼠建模后60 min内及24 h后mPAP的变化及比较
三、CD147单克隆抗体干预对栓塞大鼠肺组织中MPO活性及血浆中TNF-α、IL-6水平的影响
APE模型建立24 h后,与假手术组(图3A)相比,APE组大鼠肺组织中明显可见中性粒细胞聚集(图3B),MPO活性明显升高(P<0.01,图4A),血浆中TNF-α及IL-6水平亦明显升高(P<0.01,图 4B、4C),而应用 CD147单克隆抗体干预后,肺栓塞大鼠肺组织中中性粒细胞聚集有所减轻(图 3C),MPO 活性明显下降(P<0.01,图 4A),血浆中TNF-α、IL-6水平亦明显降低,基本恢复至基线水平(P > 0.05,图 4B、4C)。
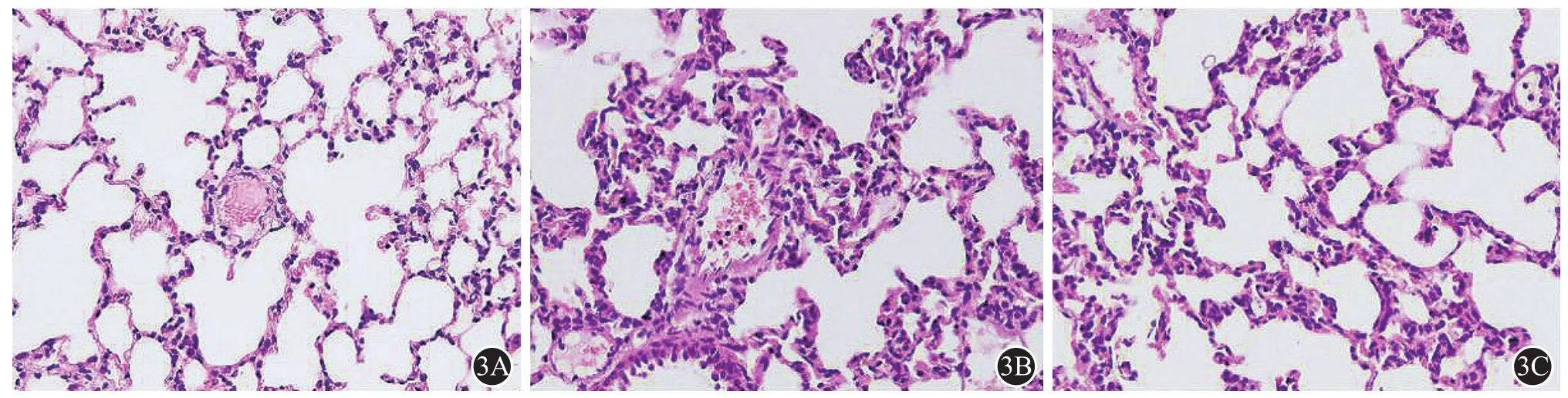
图3 APE建模24 h后各组大鼠肺组织病理切片(×400)
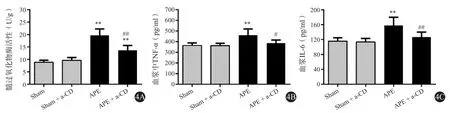
图4 各组大鼠建模24 h后肺组织中髓过氧化物酶活性及血浆中TNF-α、IL-6水平的比较
四、CD147单克隆抗体干预对栓塞大鼠肺组织中CD147表达的影响
APE模型建立24 h后,通过Western blot检测CD147单克隆抗体干预对肺组织中CD147表达的结果显示(图5A、5B),假手术组CD147呈低水平表达;
APE组大鼠肺组织中CD147表达水平明显升高(P<0.01),而应用CD147单克隆抗体干预明显降低了栓塞大鼠肺组织中CD147表达水平(P<0.01)。

图5 各组大鼠肺组织中CD147表达水平的比较
既往国内外文献中所报道的大鼠APE模型均是经颈静脉注射栓子来建立,操作过程中需先分离颈静脉再行穿刺置管。但大鼠颈部脂肪较厚且颈静脉迂曲柔软,颈静脉的分离不仅费时且容易损伤,从而导致建模容易失败。在本实验模型建立过程中,我们采用介入技术,直接在手术显微镜下用24 G静脉留置针穿刺相对平直的股静脉来注射栓子,免去了分离静脉的操作,使建模过程更加简单,大大缩短了操作时间,提高了建模成功率。我们之所以用葡聚糖微球作为栓子来取代自体静脉血,主要是考虑到两个因素:首先,SD大鼠本身具有很强的内源性纤溶活性,能够在24 h内将肺动脉内自体血栓溶解约95%[10],很难模拟人类APE时肺动脉压力在一段时间内的变化;
其次,使用规格基本统一的微球颗粒作为栓子能使APE模型的建立更加简单可控,减少大鼠的体重对模型的影响,避免各组大鼠间肺栓塞的程度存在较大的差异。注射进大鼠下腔静脉内的葡聚糖微球堆积在肺动脉,短时间内使肺动脉阻力明显增加,肺动脉压力急剧上升[4,11],这个过程很好地模拟了人类下肢深静脉血栓脱落至肺动脉时所引起的血流动力学变化。
APE发生后,除了肺血管床的机械性阻塞,肺血管的收缩也被认为是引起肺动脉压力升高的重要因素[12-14]。之前的研究证实APE后发生的肺血管收缩与炎症反应密切相关,APE发生后,大量炎性细胞聚集到栓塞血管及肺组织周围,快速释放大量含MMPs的颗粒[15],活化的中性粒细胞释放的超氧化物联合其他氧化应激因素激活MMPs[16],激活的MMPs能够通过将大ET-1裂解为ET-1或其他强有力的血管收缩剂来调节肺血管的收缩性[17-18],还能通过表皮生长因子的转录激活等途径来影响APE后的肺血管阻力[19],引起或加重肺血管的收缩。相关实验证明,应用MMPs的抑制剂多西环素能够明显降低APE动物模型中的肺动脉压力[11,20],但因其副作用及可能导致的并发症,多西环素并未在临床得到应用。因此,仍需进一步研究来明确APE后栓塞肺组织发生炎症反应的具体机制,寻找其他关键作用因子,减轻APE后的炎症反应,降低肺血管阻力。我们的研究结果表明,应用CD147单克隆抗体能够显著降低血浆中细胞因子TNF-α和IL-6的水平,减少栓塞大鼠肺组织中中性粒细胞的聚集,降低APE后的肺动脉压力。基于以上结果及相关文献,我们认为,APE发生后,CD147可能作为一个关键因子参与了APE后肺组织炎症反应的发生及维持,进而参与了肺血管收缩这一病理过程。
本实验结果中有两点需要引起我们特别注意。首先,抑制CD147对mPAP的降低作用直到APE发生后50 min才开始比较显著,而栓塞后前40 min,APE组大鼠与anti-CD147干预组大鼠的mPAP变化并无明显差异。这说明APE发生后极早期的肺血管收缩更可能由5-HT[21]、TXA2[22-23]等其他血管收缩因子主导,而炎症引起的肺血管收缩则在APE 50 min后开始占据主导地位。其次,尽管CD147单克隆抗体显著降低了APE大鼠的mPAP,但干预组大鼠mPAP即使在栓塞后24 h仍明显高于基线水平,这说明此部分升高的肺动脉压力可能主要来自于肺血管床的机械性阻塞。
本研究存在两点缺陷:首先,APE发生后肺组织中CD147发挥的作用可能比本研究中描述的要复杂的多。尽管我们的实验结果提示中性粒细胞是CD147作用的主要靶细胞,但不能排除CD147还作用于其他通路或其他细胞,比如血小板。有研究证实CD147还能通过磷酸肌醇-3-激酶/Akt-信号通路激活血小板,促进血小板的聚集和血栓的形成[24]。这一途径很有可能也存在于APE发生后的病理生理变化中。此外,我们并没有进一步探讨CD147表达升高后引起炎性细胞聚集的具体机制。未来需要进一步研究CD147对APE后肺血管中循环血小板的影响以及CD147表达促进肺组织中炎性反应的具体机制。
总之,本实验通过介入技术制作了一种简单、可重复性高的大鼠APE模型,并用该模型初步证实CD147通过促进炎症反应参与了APE后肺动脉压力的升高,提示CD147可能是治疗APE患者的一个新的靶点。
猜你喜欢 单克隆肺动脉栓塞 肺动脉肉瘤1例报告承德医学院学报(2022年1期)2022-11-23FDA批准紧急使用授权礼来新冠抗体Bebtelovimab对Omicron有效首都食品与医药(2022年19期)2022-11-19非洲猪瘟病毒P30蛋白单克隆抗体制备、鉴定及阻断ELISA方法的建立中国农业科学(2022年16期)2022-09-19不同年龄段消化系统恶性肿瘤合并静脉血栓栓塞症患者临床特征分析中华实用诊断与治疗杂志(2022年1期)2022-08-31超声心动图诊断右肺动脉异位起源于升主动脉一例云南医药(2022年3期)2022-06-17胫骨平台骨折并发肺脂肪栓塞综合征一例中国典型病例大全(2022年11期)2022-05-13Neuroform Atlas支架辅助弹簧圈栓塞治疗颅内动脉瘤的Meta分析医学概论(2022年4期)2022-04-241例单纯性肺动脉异常起源胎儿孕中期心脏超声漏诊分析安徽医学(2021年10期)2021-11-22有血液学意义的单克隆免疫球蛋白血症1例并文献复习中国实用医药(2019年36期)2019-01-30肺动脉高压可怕的“隐形”杀手健康博览(2016年8期)2016-05-14







