一株乳酸菌的分离鉴定及在香蕉饮料发酵中的应用
时间:2022-12-03 19:40:03 来源:雅意学习网 本文已影响 人 
徐鑫龙, 郝之奎, 王震豪, 车谦, 赵鹏渊, 张杭琪, 杜乐乐, 李文洁, 王丹华, 梁金溪, 廖祥儒, 李建宋*
(1.台州职业技术学院 应用生物技术研究所,浙江 台州 318000;
2.江南大学生物工程学院 工业生物技术教育部重点实验室,江苏 无锡 214122)
香蕉(Musaspp.)富含葡萄糖、果糖、果胶、纤维素、维生素及铁、钙等矿物质,因营养丰富、口感美好而深受众人喜爱[1-3]。医学研究[4]显示,香蕉具有清热、通便、解毒、降压、降疲劳、缓抑郁等功效。香蕉果皮虽厚,但果实容易机械损伤、裂口或经渗透等方式被污染变腐[5]。香蕉对温度敏感,难久藏,以香蕉为原料开发营养价值更高的发酵饮料,对促进香蕉深加工产业发展具有重要意义[6-7]。
目前,香蕉等水果的发酵多采用传统的果蔬发酵工艺,即糖加水果的发酵方法,该方法为自然接种,有害微生物难以控制,且伴随着亚硝酸盐的生成,极易产生有毒物质,无法有效控制安全隐患[8]。用乳酸菌纯种发酵工艺可有效降低亚硝酸盐等有害物质的产生,显著提高发酵产品品质[9],筛选植物源益生菌并建立果蔬发酵工艺有着更大优势。
本研究从美人蕉根际土壤中采集土样,利用加入溴甲酚紫指示剂的MRS培养基筛选产酸菌株,从形态、生理生化研究和16S rRNA基因序列分析鉴定产酸菌株,以香蕉为原料利用该植物乳杆菌进行发酵工艺优化,并对香蕉发酵饮料制造的可行性进行深入探讨。现将有关结果报道如下。
1.1 材料与仪器
土壤样本采自江南大学清苑门口观赏植物美人蕉(CannaindicaL.)根部土壤5~10 cm处;
香蕉来源于市场采购的新鲜香蕉;
酵母粉、牛肉浸膏、胰蛋白胨及葡萄糖等试剂为普通分析纯;
细菌基因提取试剂盒购于南京建成生物工程研究所。
主要设备有旋转式恒温摇床(上海苏坤实业有限公司)、超净工作台(苏净集团安泰公司)、立式压力蒸汽灭菌器(上海博讯实业有限公司医疗设备厂)、电热恒温鼓风干燥箱(上海博讯实业有限公司医疗设备厂)、紫外分光光度计(UV-2000,美国UNICO公司)、电子天平(CP214奥豪斯仪器有限公司)、XP基因扩增仪(杭州博日科技有限公司)、pH计(STARTER3100,美国OHAUS公司)、数控超声波清洗器(昆山禾创超声仪器有限公司)、L-800氨基酸自动分析仪(日本日立公司)、高效液相色谱仪(Agilent 1260,美国安捷伦公司)和高速离心喷雾干燥机(GEA Niro公司)。
1.2 培养基
MRS培养基:葡萄糖20.0 g·L-1,酵母粉5.0 g·L-1,牛肉浸膏10.0 g·L-1,胰蛋白胨10.0 g·L-1,乙酸钠5.0 g·L-1,柠檬酸氢二铵2.0 g·L-1,K2HPO42.0 g·L-1,MgSO4·7H2O 0.58 g·L-1,MnSO4·4H2O 0.25 g·L-1,吐温80 1 g·L-1,pH 6.2~6.6。固体MRS培养基另加琼脂粉(1.5%)。
1.6%溴甲酚紫乙醇溶液:取1.6 g溴甲酚紫加入100 mL无水乙醇中,溶解后备用。
PY基础培养基:胰酶水解酪蛋白5.0 g·L-1,胰蛋白胨5.0 g·L-1,酵母提取物10.0 g·L-1,盐溶液40.0 mL·L-1。盐溶液成分:NaCl 2.0 g·L-1,无水CaCl20.2 g·L-1,MgSO4·7H2O 0.48 g·L-1,K2HPO41.0 g·L-1,NaHCO310.0 g·L-1。
碳水化合物基础培养基:酵母粉2.5 g·L-1,吐温80 0.1 g·L-1,胰蛋白胨10.0 g·L-1,1.6%的溴甲酚紫乙醇溶液1.0 mL·L-1,碳水化合物溶液50 mL·L-1,调pH至6.5。碳水化合物溶液:取L-鼠李糖、海藻糖、D-半乳糖、L-山梨糖、D-甘露醇、D-甘露糖、D-山梨醇、D-果糖、纤维二糖、D-阿拉伯糖、D-木糖、棉籽糖、肌酸、肌醇、蔗糖、麦芽糖、乳糖各10 g溶于1 L水中。
柠檬酸盐利用培养基:脱脂奶粉10.0 g·L-1,胰酶水解酪蛋白2.5 g·L-1,葡萄糖5.0 g·L-1,琼脂15.0 g·L-1,溶液A 10.0 mL·L-1,溶液B 10.0 mL·L-1,用药品配制基础培养基,调pH至6.5,115 ℃灭菌15 min后冷却至45 ℃,然后加入溶液A和溶液B,混合均匀后倒平板,30 ℃避光干燥24 h备用。溶液A:高铁氰化钾10.0 g溶于100 mL蒸馏水中备用。溶液B:柠檬酸铁1.0 g和枸橼酸钠1.0 g溶于40 mL蒸馏水中备用。
1.3 菌株筛选与应用
1.3.1 菌株筛选
土壤样本采集:江南大学清苑门口观赏植物美人蕉处,清除地表土5~10 cm后采样,取1 g土样置入100 mL MRS液体培养基中,30 ℃条件下在60 r·min-1的摇床中富集培养24 h。用灭菌水梯度稀释至10-4、10-5、10-6,分别取不同梯度稀释液100 μL涂布,于30 ℃恒温箱倒置培养,至菌落长出。挑选黄色产酸的菌落,在含有0.15%溴甲酚紫的MRS固体培养基上进一步纯化,直至获得纯培养物。
1.3.2 菌株鉴定
菌株形态学观察。接种于MRS固体培养基上,30 ℃条件下,培养24 h后,观察菌落和显微特征。
菌株生理生化特征研究。参照《伯杰细菌鉴定手册》及相关文献[10-12]对获得的菌株进行生理生化特性研究,以确定菌株种属划分。
菌株16S rRNA基因序列检测。按照说明书提取基因组并以细菌通用引物27F (5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R (5′-TACGGCTACCTTGTTACGACTT-3′)扩增细菌16S rRNA基因。在50 μL反应体系中加入DNA模板1 μL,27F引物1 μL,1492R引物1 μL,2×EasyTaqPCR Supermix 25 μL,加水22 μL。95 ℃预变性5 min后,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1.5 min,35次循环,72 ℃延伸10 min。PCR产物利用3%琼脂糖电泳检测。
测序结果使用数据库http://blast.ncbi.nlm.nih.gov研究同源性。根据比对结果,构建系统进化树,找出与数据库同源性最高的已知菌种,推测待定菌株可能的属或种。
1.3.3 菌株生长特性
生长温度的影响。使用MRS培养基、1%接种量研究温度对菌株的影响,温度梯度为20、25、30、35和40 ℃,60 r·min-1摇床培养,16 h后600 nm处测定吸光度(D)。
pH的影响。使用MRS培养基、1%接种量研究起始pH对菌株的影响,起始pH值分别为4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0,在30 ℃温度条件下60 r·min-1摇床培养,116 h后600 nm处测定D。
生长曲线和产酸能力的测定。用MRS培养基、1%接种量,在30 ℃条件下60 r·min-1摇床培养,每2 h采样并于600 nm处测定D,参照相关文献[13]研究菌株产酸能力。
1.3.4 香蕉发酵饮料研制
工艺流程:新鲜香蕉→去皮→切片护色(0.1%柠檬酸浸泡15 min)→打浆→过滤→调配→灭菌(95 ℃,5 min)→冷却→接种→发酵→调配→成品。
发酵条件的优化试验。为研究水和蜂蜜的添加量对香蕉发酵饮料中氨基酸含量的影响,设计水和蜂蜜添加量两因素进行正交试验。香蕉∶水(V∶V)与蜂蜜量(%)分别为:样品1,1∶1和1.0%;
样品2,1∶1和1.5%;
样品3,1∶1和2.0%;
样品4,1∶2和1.0%;
样品5,1∶2和1.5%;
样品6,1∶2和2.0%;
样品7,1∶3和1.0%;
样品8,1∶3和1.5%;
样品9,1∶3和2.0%。1%接种量,起始pH 6.5,30 ℃、60 r·min-1发酵16 h,分别测定发酵前后氨基酸含量,以确定水和蜂蜜添加量最佳配比。
氨基酸含量的测定。采样并称量1 mL置于安瓿管中,加入6 mol·L-1HCl 8 mL,充氮封管,用细沙包围,120 ℃条件下水解22 h后用4.8 mL 10 mol·L-1NaOH中和,用25 mL容量瓶定容,双层滤纸过滤,10 000g离心10 min,取400 μL上清液置入液相专用样品瓶内,测定氨基酸含量[14]。
有机酸含量的测定。接种量1%,根据正交试验结果确定的最佳水和蜂蜜比例构建发酵体系,30 ℃条件下发酵16 h后终止,取样后10 000g离心5 min,测上清液有机酸含量(乙酸、乳酸、苹果酸和柠檬酸等),采用高效液相法[15]。
黄酮含量的测定。1)芦丁标准曲线的制定(比色法):0.2 mg·mL-1芦丁标准品溶液用95%乙醇配制,移液器吸取0、1.0、2.0、3.0、4.0、5.0、6.0 mL分别置于25 mL容量瓶中,加入1 mL 4% NaNO3溶液混匀,6 min后加入8%Al(NO3)3溶液混匀,6 min后加入10 mL 12%NaOH溶液,定容后静置,15 min后测定D(510 nm)。芦丁浓度作为横坐标,D作为纵坐标,拟合标准曲线,r>99.999 8。2)黄酮含量的测定:接种量1%,根据正交试验结果确定的最佳水和蜂蜜比例构建发酵体系,30 ℃条件下发酵16 h后终止,取5.00 mL发酵液样品于100 mL三角瓶中,加70%乙醇25 mL,振荡摇匀,超声浸浴30 min,6 000g离心10 min,滤液倒入100 mL容量瓶中,20 mL 70%乙醇再浸滤渣后超声浸浴30 min,3 000g离心5 min后取上清液,合并第一次上清液后加入70%乙醇定容至50 mL容量瓶,制成样本备用。分别取适量发酵液,置于25 mL容量瓶中,加入1 mL 4%NaNO3溶液混匀,6 min后加入8%Al(NO3)3溶液混匀,6 min后加入10 mL 12%NaOH溶液,定容后静置15 min,于510 nm处测定D,代入标准曲线得出的公式中,换算出样品浓度值,计算样品中的总黄酮含量。
香蕉饮料的感官评定。在香蕉∶水1∶2、蜂蜜添加量2.0%、接种量1%、30 ℃发酵16 h条件下,研究果葡糖浆添加量与香蕉饮料感官品质之间的关系,设果葡糖浆添加量分别为2%、4%、6%、8%、10%、12%、14%。参考国标感官评定法:邀请20位有感官评价经验的人员,从色、香、味及状态等方面进行评定,满分为100分,20位评定人员平均值为最终得分。
感官评分标准:色泽,鲜明柔和,有光泽,无杂色,均匀一致,评0~20分;
气味,有清新的香蕉果香和乳酸味,无异味,评0~30分;
滋味,酸甜适口,口感细腻,无不良气味,评0~30分;
组织状态,流动性好,均匀不分层,微混浊,无杂质,评0~20分。
2.1 乳酸菌的鉴定
2.1.1 形态特征
菌株菌落形态如图1所示,形状呈圆形,中间凸起,表面光滑,直径约3 mm,菌落细密,呈灰白色或浅黄色。显微镜下观察发现,菌体为圆端直杆菌,单个、成对或短链状,无鞭毛,但能运动,革兰氏阳性,无芽孢。

图1 Lactobacillus plantarum SYBC psL的菌落形态和显微形态特征
2.1.2 生理生化特性
参照《伯杰细菌鉴定手册》,初步判断菌株为乳杆菌属,生理生化鉴定结果见表1。
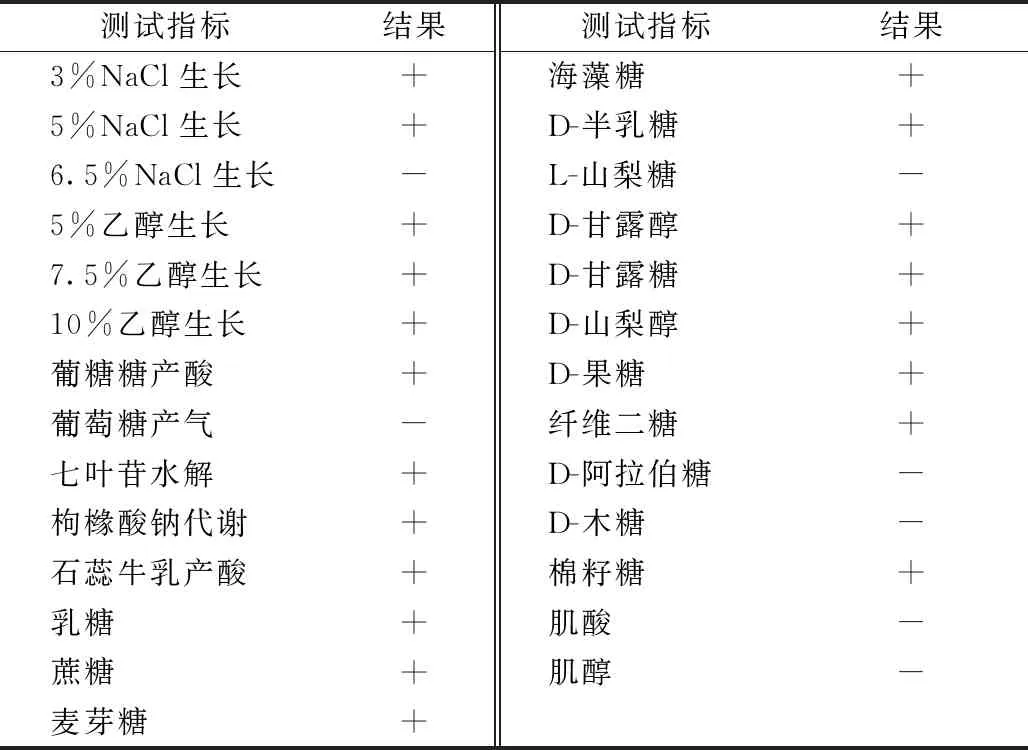
表1 Lactobacillus plantarum SYBC psL的生理生化特性
2.1.3 16S rRNA基因分析
图2是菌株16S rRNA片段PCR扩增产物的凝胶电泳结果,在1 500 bp处出现单一荧光条带,无明显拖尾。测序结果BLAST比对,与植物乳杆菌Lactobacillusplantarum16S rRNA基因序列同源性达99%。结合生理生化研究结果,确定该菌株为植物乳杆菌,并命名为植物乳杆菌SYBC psL(LactobacillusplantarumSYBC psL)。
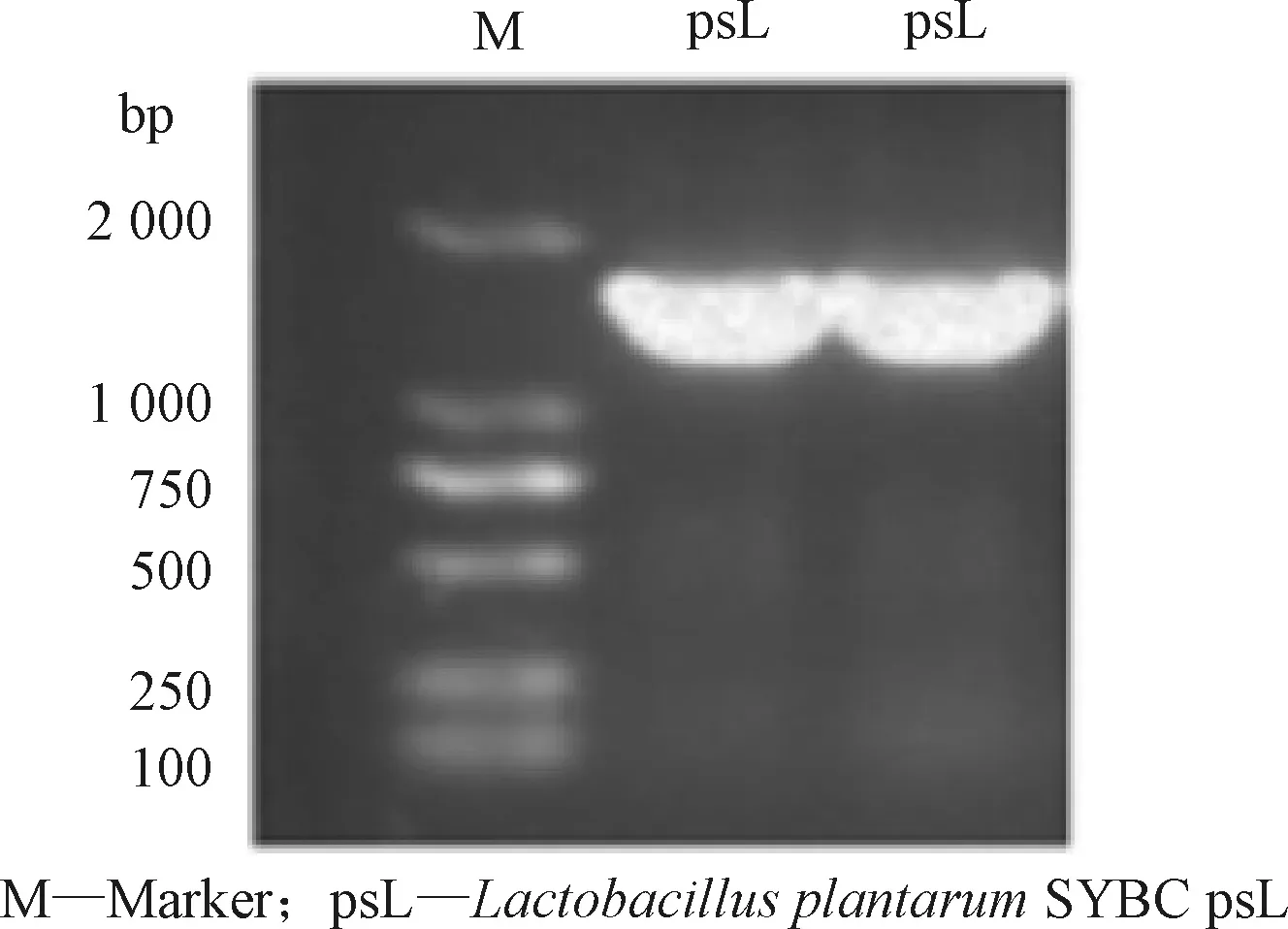
图2 Lactobacillus plantarum SYBC psL 16S rRNA片段PCR扩增产物凝胶电泳
2.2 菌株生长特性的研究
2.2.1 适宜生长温度和pH
研究结果(图3~4)表明,该菌株适宜培养温度为30 ℃,最适pH为6.5。

图3 培养温度对菌株生长的影响

图4 初始pH对菌株生长的影响
2.2.2 生长曲线和产酸能力
菌株生长曲线如图5所示,培养0~4 h为静止期,4~12 h为指数生长期,12 h后为平衡期。菌株产酸能力较强,10 h内pH由6.5下降至4.2,对数生长期过程产酸明显。

图5 菌株的生长曲线和产酸能力
2.3 菌株在香蕉饮料发酵中的应用
2.3.1 发酵条件的优化
香蕉饮料发酵前后总氨基酸含量变化如图6所示,样品6香蕉与水比例1∶2、蜂蜜2.0%时,发酵产物中氨基酸产生量最多。发酵后8种必需氨基酸含量变化情况列于表2,表中看出:除对照外,样品3的色氨酸最高;
样品9的色氨酸最低;
样品2的苏氨酸最高,样品8的苏氨酸最低;
样品6的赖氨酸、亮氨酸、异亮氨酸和苯丙氨酸最高;
样品2的缬氨酸最高;
样品2的甲硫氨酸最高,样品8最低。发酵后样品6的总氨基酸和必需氨基酸量增长最多,所以香蕉与水比例为1∶2、蜂蜜添加2.0%为最优发酵体系。

图6 发酵前后总氨基酸含量的变化

表2 发酵后必需氨基酸含量的变化情况 单位 mg·L-1
2.3.2 有机酸含量的变化
发酵后,苹果酸和柠檬酸含量明显降低,乳酸含量升高,乙酸增加少许。说明发酵过程中,该菌以苹果酸和柠檬酸为原料生产了乳酸和少量乙酸(图7)。

图7 发酵前后有机酸含量的变化
2.3.3 黄酮含量的变化
总黄酮含量发酵前为34.35 mg·g-1,发酵后为46.55 mg·g-1,说明经过发酵,总黄酮含量增加了35.5%。黄酮具有抗过敏、消炎等作用,能有效清除体内自由基,改善血液循环,阻止细胞衰老、退化和癌症的发生,说明以香蕉为原料通过发酵研制的香蕉发酵饮料具有一定的营养保健价值。
2.3.4 香蕉饮料的感官评定
果葡糖浆添加量为10%时的感官评分最高,达86分(图8),此时产品清澈透明,呈深黄色,流动性好,酸甜度合适,口感细腻,有香蕉果香,氨基酸、乳酸和黄酮含量明显提高。

图8 果葡糖浆添加量对香蕉发酵饮料感官得分的影响
本研究从美人蕉属植物根际土壤筛选获得一株产酸菌株,经形态特征、生理生化特征研究和16S rRNA基因序列分析,鉴定为一株植物乳杆菌,命名为LactobacillusplantarumSYBC psL;
对菌株生长特性进行研究,其在温度30 ℃、初始pH 6.5时,菌株生长最快,4 h后进入对数期,8 h生长速率达到最大,12 h左右达到稳定期;
以香蕉为原料,将LactobacillusplantarumSYBC psL应用于香蕉饮料发酵,经初步研究确定当香蕉与水的比例为1∶2、蜂蜜添加量为2.0%时,氨基酸含量增长最多,乳酸和黄酮含量也明显升高;
果葡糖浆添加量为10%时产品酵素的酸甜度适口,黏度适当,具有较高稳定性。








