TLR4/HIF-1α信号通路介导糖化低密度脂蛋白诱导的人脐静脉内皮细胞损伤
时间:2022-12-02 16:30:04 来源:雅意学习网 本文已影响 人 
邱军辉,刘美志,孙杜桑,潘 婷,赵维维,沙雯君,鲁 郡,雷 涛,
糖尿病是全球增长最快的疾病之一,预计到2045年将影响6.93亿成年人[1]。近年来,我国糖尿病的发病率逐年升高,其主要危害在于糖尿病的慢性并发症,而糖尿病最主要的慢性并发症是血管病变[2]。研究[3]显示血管内皮功能损伤既是血管病变的重要病理基础,也是糖尿病预后的决定性因素。糖尿病患者体内多同时存在高血糖和脂代谢紊乱状态,低密度脂蛋白极易发生非酶促糖基化,形成糖化低密度脂蛋白(glycated low density lipoprotein,Gly-LDL)[4]。Gly-LDL能够影响内皮细胞形态和功能,但具体作用机制尚未阐明。该研究旨在探讨Gly-LDL诱导人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)炎症反应的具体机制,为防治血管内皮损伤提供新的理论依据。
1.1 材料
1.1.1细胞 HUVECs购自上海中科院细胞研究所。
1.1.2主要试剂 LDL Human购自广州奕元生物科技有限公司;
葡萄糖购自上海生工生物工程股份有限公司;
CCK-8试剂盒购自日本同仁化学研究所;
ECM购自美国ScienCell公司;
0.25%胰酶消化液购自美国Gibco公司;
BCA蛋白浓度测定试剂盒、SDS-PAGE蛋白上样缓冲液(5×)购自上海碧云天生物科技有限公司;
ELISA试剂盒购自武汉博士德生物工程有限公司;
TRIzol购自Invitrogen公司;
PrimeScriptTMRT Master Mix Kit和SYBR®Primix Ex TagTMKit购自美国TaKaRa公司;
Toll样受体4(toll like receptor 4,TLR4)、缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6) 、β-actin抗体、HRP标记的山羊抗兔IgG二抗、HRP 标记的兔抗小鼠IgG二抗购自美国Abcam公司。
1.1.3主要仪器 细胞超净工作台购自ESCO公司;
全波长酶标仪购自Bio-Rad公司;
荧光显微镜购自美国莱卡公司;
电泳系统购自美国Bio-Rad公司;
离心机购自Eppendorf公司;
实时荧光定量PCR仪购自美国ABI公司。
1.2 方法
1.2.1Gly-LDL的制备 参考文献[5]报道,在无菌条件下,将0.2 mol/L葡萄糖与2 g/L LDL Human在37 ℃培养箱中避光孵育4周,同时加入1 g/L EDTA和10 μmol/L二丁基羟基甲苯。第1、7、14、21、28天提取100 μl样品保存于-80 ℃,检测Gly-LDL水平。孵育完成后在pH 7.4 的PBS缓冲液中透析48 h备用。
1.2.2细胞培养 从液氮中取出冻存细胞,在37 ℃水浴锅中解冻并离心,用完全培养基复苏细胞,置于37 ℃、5%CO2培养箱中培养。
1.2.3CCK-8法检测细胞增殖活力 将处于对数生长期的HUVECs制备细胞悬液,按照1×104个细胞/孔的密度将细胞悬液接种至96孔板中,每孔100 μl,每组设立5个重复孔。待细胞完全贴壁后,按照不同干预措施将细胞分为对照组、阳性对照组[50 mg/L普通低密度脂蛋白 (normal low density lipoprotein, n-LDL]、Gly-LDL (50、75、100 mg/L) 组,干预24 h后用含10% CCK-8的培养基进行换液,避光孵育,每隔30 min使用酶标仪测定每组在450 nm处的吸光度,取各组实验的平均值,重复3次实验。
1.2.4划痕实验检测细胞迁移能力 在6孔板中以2×105个细胞/孔的密度培养细胞,待细胞长至80%~90%时,用枪头于板底划线,PBS洗去漂浮细胞,更换含1%FBS低血清培养基后加入不同浓度Gly-LDL继续培养,于显微镜下拍摄0 h细胞划痕图片,12 h后在同一位置拍摄图片,计算划痕区域面积,求得愈合率。
1.2.5ELISA法检测细胞上清液中TNF-α、IL-6、细胞间黏附分子-1(intercellular adhesion molecule-1,ICAM-1)、血管细胞黏附分子-1(vascular cell adhesion molecule-1,VCAM-1)含量 取24 h后各组细胞上清液,按照ELISA试剂盒说明书检测上清液中TNF-α、IL-6、VCAM-1、ICAM-1含量。
1.2.6qRT-PCR检测HUVECs中TLR4、HIF-1α、TNF-α、IL-6 mRNA水平 在6孔板中培养内皮细胞,干预24 h后收集各组内皮细胞,按说明书提取内皮细胞中总RNA,采用逆转录试剂盒将RNA逆转录为cDNA,实时荧光定量PCR进行目的基因扩增。PCR扩增体系:2×TB Green 10.0 μl,引物各0.4 μl,引物序列见表1,50×ROX ReferenceDye Ⅱ 0.4 μl,cDNA 2 μl,ddH2O 6.8 μl,总体系20 μl。反应条件:95 ℃预变性30 s,95 ℃退火5 s,60 ℃延伸34 s,共40个循环,95 ℃延伸15 s。以β-actin为内参,2-ΔΔCt计算。

表1 引物序列
1.2.7Western blot检测TLR4、HIF-1α、TNF-α、IL-6蛋白水平 将3~4代HUVECs细胞接种于6孔板中,每孔2×105个细胞,待细胞长至80%时,将完全培养基更换成低血清培养基进行饥饿处理8 h,对细胞进行干预处理24 h后,吸弃6孔板中培养基,预冷PBS洗涤2次,每孔加入120 μl RIPA裂解液置于冰上充分裂解30 min,4 ℃、14 000 r/min离心15 min,取上清液至预冷离心管中,按照BCA蛋白浓度测定试剂盒说明书步骤对各组样品进行定量检测,加入适量蛋白上样缓冲液后100 ℃加热5 min变性。取20 μg总蛋白进行SDS-PAGE凝胶电泳,再将蛋白转移到PVDF膜,用5%BSA室温封闭1 h,洗膜后分别加入TLR4一抗(1 ∶1 000)、HIF-1α一抗(1 ∶1 000)、TNF-α一抗(1 ∶1 000)、IL-6一抗(1 ∶1 000)、β-actin一抗(1 ∶5 000) 4 ℃孵育过夜,次日TBST漂洗PVDF膜3次,5 min/次,加入二抗(1 ∶20 000)室温摇床孵育2 h,TBST漂洗3次,5 min/次。暗室ECL显影获取图片,用ImageJ软件分析出各组蛋白与内参的灰度值,得出各组蛋白与内参的灰度比值,反映出各组蛋白的相对表达水平。
1.2.8Gly-LDL干预下沉默TLR4、HIF-1α后TLR4、HIF-1α蛋白表达水平 在6孔板中接种3~5代细胞,每孔细胞数约为2×105个,在恒温培养箱中培养细胞生长至80%左右开始后续实验。转染前将培养基换成不含血清和双抗的培养基,以免影响转染效率。分别设为对照组、模型组(Gly-LDL 100 mg/L)、si-TLR4组(Gly-LDL 100 mg/L+si-TLR4)、TLR4空载组(Gly-LDL 100 mg/L+si-NC1)、si-HIF-1α组(Gly-LDL 100 mg/L+si-HIF-1α)和HIF-1α空载组(Gly-LDL 100 mg/L+si-NC2)。提前将si-TLR4、si-NCl、si-HIF-1α、si-NC2冻干粉用原装DEPC水进行溶解,取siRNA,用opti-MEM培养基稀释siRNA,终浓度为10 μmol/L,总体积为250 μl,静置5 min;
同时取2 μl Lipofectamine 2000与248 μl opti-MEM培养基混匀,静置5 min。将上述两种液体混合,静置20 min。每孔先加入1 500 μl opti-MEM培养基,20 min之后将500 μl混合液加入6孔板中。6 h后将opti-MEM更换为完全培养基,继续培养48 h,后续根据实验需要进行下一步操作。实验重复3次。小干扰序列见表2。

表2 小干扰序列

2.1 Gly-LDL对HUVECs增殖活力的影响不同浓度Gly-LDL处理内皮细胞,在24 h检测细胞增殖活力的改变,CCK-8法检测结果显示:细胞活力差异有统计学意义(F=69.96,P<0.001),与对照组OD值(1.09±0.10)相比,n-LDL组OD值(0.96±0.03)显示对HUVECs增殖活力无影响,差异无统计学意义(P>0.05);
而Gly-LDL(50、75、100 mg/L)组OD值分别为(0.70±0.03)、 (0.59±0.02)、 (0.53±0.03),与对照组相比,细胞存活率分别下降36.16%、45.77%、51.24%,呈剂量依赖性(P<0.01);
与n-LDL组相比,Gly-LDL 50 mg/L组细胞存活率下降27.08%(P<0.001)。
2.2 Gly-LDL对HUVECs迁移能力的影响不同浓度Gly-LDL处理HUVECs,在12 h检测细胞迁移能力的改变,细胞划痕实验结果(图1)显示:细胞迁移能力差异有统计学意义(F=139.85,P<0.001),与对照组愈合率(52.03±1.79)相比,n-LDL组愈合率(48.55±1.93)显示对细胞迁移能力无影响,差异无统计学意义(P>0.05);
而Gly-LDL(50、75、100 mg/L)组愈合率分别为(35.88±2.40)、(22.68±3.10)、(17.65±1.59),与对照组相比,细胞迁移率分别下降31.04%、56.40%、66.08%,呈剂量依赖性(P<0.001);
与n-LDL组相比,Gly-LDL 50 mg/L组细胞迁移率下降26.10%(P<0.01)。

图1 细胞划痕实验检测不同浓度Gly-LDL对HUVECs迁移能力的影响 ×100
2.3 Gly-LDL对HUVECs细胞因子表达的影响ELISA法检测TNF-α、IL-6、ICAM-1、VCAM-1分泌水平,结果(表3)显示:各组TNF-α、IL-6、ICAM-1、VCAM-1分泌量差异有统计学意义(F=333.80、68.91、127.07、79.56,P<0.001),与对照组相比, n-LDL组TNF-α、IL-6、 ICAM-1、VCAM-1分泌水平升高,差异有统计学意义(P<0.05);
与对照组相比,Gly-LDL(50、75、100 mg/L)组TNF-α、IL-6、 ICAM-1、VCAM-1分泌水平升高,差异有统计学意义(P<0.01);
与n-LDL组相比,Gly-LDL 50 mg/L组中TNF-α、IL-6、 ICAM-1、VCAM-1分泌水平增高,其中TNF-α、IL-6、ICAM-1分泌水平差异有统计学意义(P<0.05)。

表3 Gly-LDL对HUVECs细胞因子表达的影响
2.4 Gly-LDL对HUVECs中TLR4、HIF-1α、TNF-α、IL-6 mRNA表达的影响不同浓度Gly-LDL处理细胞24 h后,qRT-PCR结果(图2)显示:各组TLR4、HIF-1α、TNF-α、IL-6 mRNA表达量差异有统计学意义(F=174.35、275.06、126.54、109.70,P<0.05),与对照组相比,n-LDL组和Gly-LDL(50、75、100 mg/L)组诱导的HUVECs中TLR4、HIF-1α、TNF-α、IL-6 mRNA表达水平升高,差异有统计学意义(P<0.05);
与n-LDL组相比,Gly-LDL(75、100 mg/L)组中TLR4、TNF-α、IL-6 mRNA水平增高,差异有统计学意义,并呈剂量依赖性(P<0.05)。

图2 Gly-LDL对HUVECs中TLR4、HIF-1α、TNF-α、IL-6 mRNA表达的影响A:对照组;
B:n-LDL组;
C:Gly-LDL 50 mg/L组;
D:Gly-LDL 75 mg/L组;
E:Gly-LDL 100 mg/L组;
与对照组比较:*P<0.05;
与n-LDL组比较:#P<0.05
2.5 Gly-LDL对HUVECs中TLR4、HIF-1α、TNF-α、IL-6蛋白表达的影响不同浓度Gly-LDL处理细胞24 h后,Western blot检测炎症蛋白TLR4,HIF-1α、IL-6、TNF-α水平,结果(图3)显示:各组TLR4、HIF-1α、TNF-α、IL-6蛋白表达量差异有统计学意义(F=47.63、42.80、78.25、21.13,P<0.001),与对照组相比,n-LDL组中TLR4、TNF-α蛋白水平升高,差异有统计学意义(P<0.05);
与对照组相比,Gly-LDL 50 mg/L 组中HIF-1α、TNF-α蛋白水平升高,差异有统计学意义(P<0.05),Gly-LDL 75、100 mg/L组中TLR4、HIF-1α、TNF-α、IL-6蛋白水平升高,差异有统计学意义(P<0.05)。
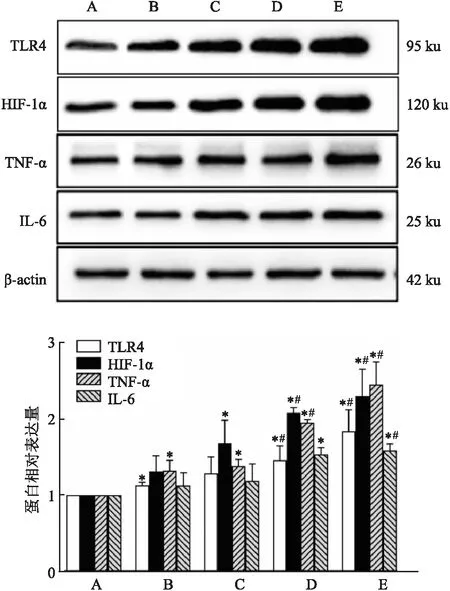
图3 Gly-LDL对TLR4/HIF-1α信号通路相关蛋白的影响A:对照组;
B:n-LDL组;
C:Gly-LDL 50 mg/L组;
D:Gly-LDL 75 mg/L组;
E:Gly-LDL 100 mg/L组;
与对照组比较:*P<0.05;
与n-LDL组比较:#P<0.05
2.6 检测HUVECs中沉默TLR4、HIF-1α蛋白效率分别用si-TLR4、si-HIF-1α转染HUVECs,Western blot结果(图4)显示:与si-NC组相比,si-TLR4组中TLR4蛋白表达下调44.18%,差异有统计学意义(P<0.001);
与si-NC组相比,si-HIF-1α组中HIF-1α蛋白表达下调69.10%,差异有统计学意义(P<0.001)。

图4 si-TLR4和si-HIF-1α对HUVECs中TLR4、HIF-1α蛋白沉默的影响A:沉默TLR4效率检验;
B:TLR4蛋白统计分析图;
C:沉默HIF-1α效率检验;
D:HIF-1α蛋白统计分析图;
与si-NC组比较:***P<0.001
2.7 Gly-LDL干预下沉默TLR4、HIF-1α后对HUVECs中TLR4、HIF-1α蛋白表达的影响分别用si-TLR4、si-HIF-1α转染HUVECs后,按照实验分组加入100 mg/L Gly-LDL干预24 h,结果(图5)显示:与对照组相比,模型组中TLR4、HIF-1α蛋白表达均升高(P<0.05);
与模型组相比,si-TLR4组中TLR4、HIF-1α蛋白表达均降低(P<0.05);
与模型组相比,si-HIF-1α组中HIF-1α蛋白表达降低(P<0.05),TLR4蛋白表达差异无统计学意义;
与对照组相比,si-HIF-1α组中TLR4蛋白升高(P<0.05)。

图5 沉默TLR4、HIF-1α对HUVECs中TLR4、HIF-1α蛋白表达的影响A:对照组;
B:模型组;
C:si-TLR4组;
D:TLR4空载组;
E:si-HIF-1α组;
F:HIF-1α空载组;
与对照组比较:*P<0.05;
与模型组比较:#P<0.05
糖尿病是一种以糖代谢紊乱为主的临床综合征,糖尿病大血管并发症是糖尿病患者致残致死主要原因[6],血管内皮损伤是导致糖尿病大血管并发症的关键因素[7-8]。因此,血管内皮损伤是防治糖尿病大血管病变的重要关注点。目前认为,血管内皮损伤的出现,在于糖尿病高血糖时,体内各种蛋白非酶促糖基化反应增强。而晚期糖基化蛋白终末产物(advanced glycated end products,AGEs)可损害内皮细胞的形态及其功能,从而诱发糖尿病血管病变[9-10]。Gly-LDL是AGEs中最主要成分之一,但目前Gly-LDL与糖尿病血管内皮损伤的关系仅停留在相关性研究中。本研究用Gly-LDL(50、75、100 mg/L)处理HUVECs 24 h,存活率降低36.16%、45.77%和51.24%;
迁移率降低31.04%、56.40%和66.08%;
并促进TNF-α、IL-6、ICAM-1、VCAM-1细胞因子分泌,表明Gly-LDL能够降低细胞生存率和迁移能力,促进炎症因子释放,并呈浓度依赖性。
大量研究[11-12]显示糖尿病血管内皮损伤与TLR4信号激活有关。在血管内皮病变患者外周血中,巨噬细胞表现为TLR4信号过度激活,使机体处于高度促炎状态[13]。TLR4参与糖尿病病理生理过程,TLR4能够调节NADPH氧化酶活性,导致体内活性氧增加,加速糖尿病大血管并发症发展[14];
在糖尿病血管内皮损伤中,树突状细胞通过RAGE-TLR4-PKCβ1信号通路介导慢性炎症反应[15];
高迁移率组蛋白(high mobility group protein B1,HMGB1)在糖尿病发生过程中通过TLR4/eNOS通路参与内皮依赖性舒张功能损伤[16]。为了验证Gly-LDL是否通过TLR4信号通路介导血管内皮炎症反应,本研究选用HUVECs作为研究对象,结果显示Gly-LDL能提高HUVECs中TLR4、HIF-1α、TNF-α和IL-6 mRNA和蛋白水平,表明Gly-LDL能够激活TLR4信号通路,促进炎症因子TNF-α和IL-6的表达,介导血管内皮细胞损伤。但是Gly-LDL通过TLR4信号如何调控炎症反应,是目前尚未解决的科学问题。研究[17]表明TLR4信号能够调控HIF-1α影响TNF-α、IL-1β分泌,HIF-1α是人和哺乳动物中关键核转录因子,常氧状态下HIF-1α的脯氨酰胺基和门冬酰胺基发生羟基化,与E3泛素化连接酶结合,VHL蛋白能募集泛素连接酶,与泛素化连接酶结合的HIF-1α被蛋白酶体降解;
低氧状态下,HIF-1α羟基化被抑制,与HIF-1β结合,在细胞核内与缺氧反应元件结合,激活靶基因转录[18]。HIF-1α能够调节血管内皮生长因子和葡萄糖转运蛋白1表达,并且涉及炎症反应[19]。为了验证TLR4能否调控HIF-1α表达,在Gly-LDL干预下沉默TLR4、HIF-1α基因,结果显示:Gly-LDL能够上调TLR4和HIF-1α蛋白水平,表明两者可能存在协同作用;
沉默TLR4基因后,TLR4和HIF-1α蛋白表达下调,而沉默HIF-1α基因后,只有HIF-1α蛋白表达下调,而TLR4蛋白在Gly-LDL干预下仍是上调,因此推测,Gly-LDL上调TLR4信号,激活HIF-1α表达介导HUVECs炎症反应。
综上所述,本研究结果显示:Gly-LDL能够上调TLR4信号,激活HIF-1α的表达介导炎症因子释放,降低HUVECs生存率和迁移能力,诱导HUVECs损伤。Gly-LDL水平有望成为衡量糖尿病血管内皮损伤指标之一,并为糖尿病血管内皮损伤临床治疗提供新的潜在靶点。
猜你喜欢 内皮培养基蛋白 内皮祖细胞和慢性阻塞性肺疾病中南药学(2022年2期)2022-11-14不同水质和培养基对紫金久红草莓组培快繁的影响江苏农业科学(2022年19期)2022-10-28术前血清miR-221-3p及血管内皮生长因子-C表达与早期宫颈鳞癌发生盆腔淋巴结转移的关系中华实用诊断与治疗杂志(2022年1期)2022-08-31RNA结合蛋白与恶性肿瘤发生发展关系的研究进展中国现代医生(2022年21期)2022-08-22基于“内皮损伤学说”探讨动脉粥样硬化的中医药防治策略世界中医药(2021年11期)2021-08-09细砂糖对法式蛋白糖的质量影响研究广东教育·职教版(2021年3期)2021-04-20勒布朗的遗产扣篮(2018年7期)2018-07-26水通道蛋白的发现学校教育研究(2018年27期)2018-05-14三种金黄色葡萄球菌选择性分离培养基的检测效果比较上海预防医学(2018年1期)2018-04-03阿尔茨海默症研究进展科学中国人(2016年1期)2016-01-13









