人工智能在宫颈癌和宫颈癌前病变筛查和诊断中的应用*
时间:2023-06-28 22:50:01 来源:雅意学习网 本文已影响 人 
穆雪峰,张 燕**,马于涛
(1.武汉大学人民医院妇产科,武汉 430000;2.武汉大学软件工程国家重点实验室,武汉 430000)
宫颈癌是严重威胁女性生命健康的恶性肿瘤,在全球女性恶性肿瘤中居第四位。2020年世界卫生组织报道,全球每年有超过60万新增病例和34万死亡病例,中国宫颈癌新增病例11万,占全球新增病例18%[1]。约99.7%的宫颈癌是由持续感染的生殖器高危型人类乳头瘤病毒(human papilloma virus,HPV)引起,持续HPV感染使宫颈发生上皮内瘤变(cervical intraepithelial neoplasia,CIN),进而进展为宫颈癌[2]。宫颈癌是唯一可通过一级预防消除的癌症,主要措施包括注射HPV疫苗、早期筛查和及时治疗。我国已开展数十年宫颈癌早期筛查工作,但筛查覆盖率低、医疗资源分布不均、百姓防癌意识弱等原因,造成大量宫颈癌被漏诊误诊。“细胞学/HPV检测→阴道镜检查→宫颈活组织病理检查”是目前临床诊断宫颈癌和癌前病变的主要方法。细胞学作为国内宫颈癌筛查的主要手段,其整体诊断准确率并不高。近年来,宫颈癌的初步筛查越来越依赖于高危HPV检测,已证明HPV检测比细胞学检测具有更高的敏感性和阴性预测值,被推荐为主要筛查策略。阴道镜检查的关键步骤在于能否准确识别宫颈异常部位并取活检,检查过程对操作人员主观经验依赖强,操作人员内部的巨大差异,易造成漏检。据文献报道,单纯使用阴道镜筛查对宫颈癌的漏诊率高达10%~14%[3]。病理切片诊断是宫颈癌诊断的金标准,诊断依据是病理切片中是否含有一定数量的异形细胞,这种方法要求病理医生有很高的阅片水平,同时病理医生判读切片的过程非常消耗时间和精力,读片效率往往不能满足临床需求。
近年来,人工智能(artificial intelligence,AI)依靠其强大的学习能力已逐渐应用于临床医学领域,尤其在疾病诊断方面,AI表现出强大的潜力。目前,已有多项研究将AI应用于宫颈癌及癌前病变的筛查和诊断中,旨在提高疾病诊断的准确率,减少漏诊率,同时为临床医生节省出更多的时间和精力。本文将从HPV检测、细胞学、阴道镜检查、影像学检查四方面阐述AI在宫颈癌筛查和诊断中的应用。
1956年,麦卡塞(McCarthy)博士在Dartmouth Workshop提出“人工智能”一词,从此开始了人工智能作为一个学术领域的研究。2006年,杰弗里·欣顿博士(Dr.Jeffrey Hinton)团队发明了使用自动编码器的深度学习,这项发明是AI领域的一个重大突破,其可在没有人类干预的情况下自动提取特征,这重新引发了全世界对AI研究的兴趣。此前,AI经历了两次发展高潮,但都由于技术发展等限制,持续时间短暂。
机器学习是指AI中所涉及的分析技术,其通过学习数据中的规则性,提取标准,再根据此标准对未知数据进行分类。深度学习是机器学习的一种,代表了AI和机器学习领域的一种新的学习模式,其通过神经网络使用数学模型来模拟人脑中的神经元。神经网络主要由输入层、中间层和输出层三种类型组成,每个类型又可分为若干层,擅长图像分类、分割、配准、目标检索等,其模型种类多,以卷积神经网络(convolutional neural network,CNN)应用最广泛。见图1。
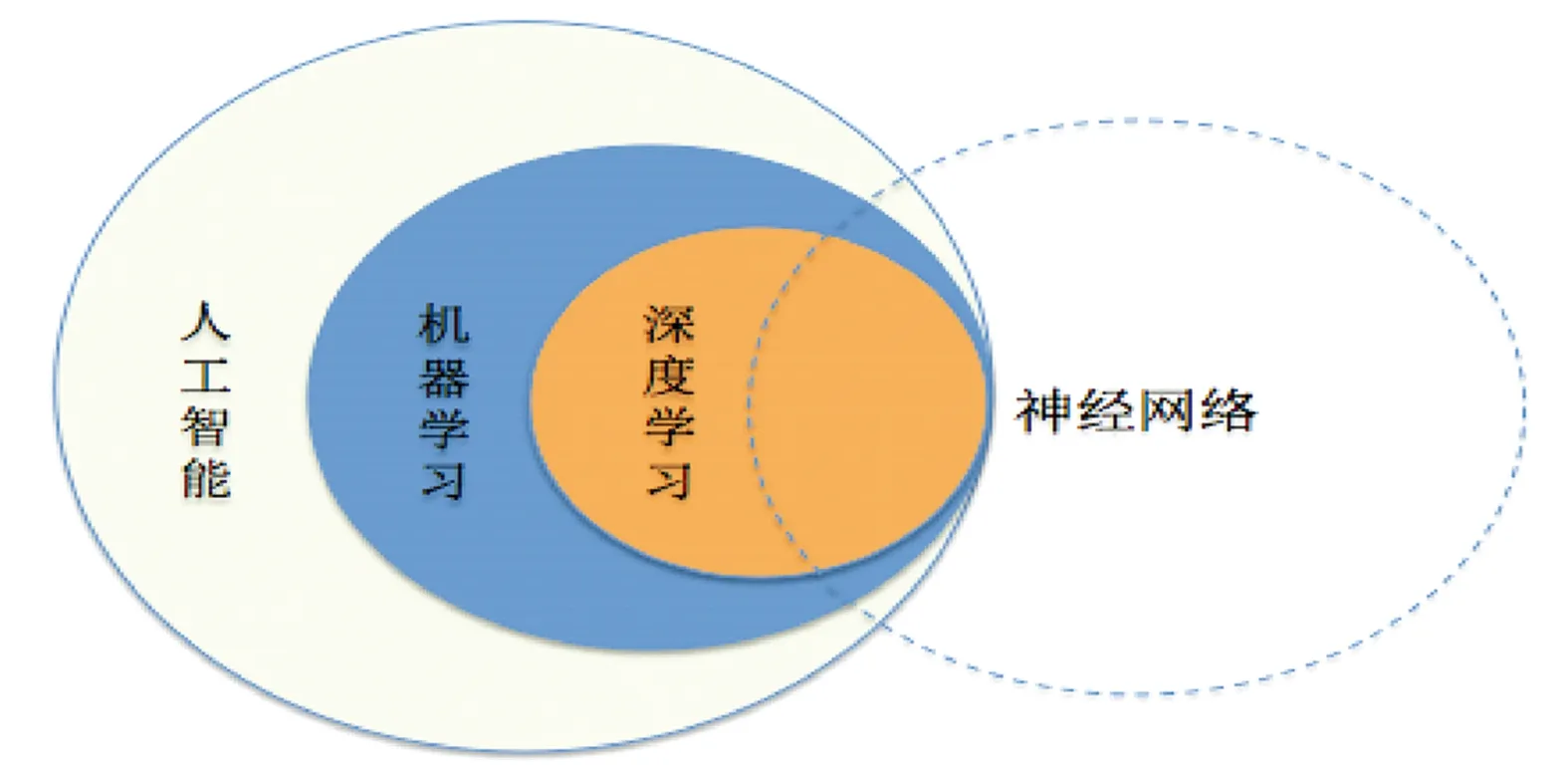
图1 人工智能、机器学习、深度学习以及神经网络之间的关系
近年来,随着机器学习和深度学习的发展,AI已广泛应用到临床医学领域,并在疾病的预防、诊断、治疗等方面表现出杰出的能力。Yanagawa等[4]用肺癌患者的CT图像训练深度学习模型,结果表明,使用模型对肺癌辅助诊断的准确率高于未使用模型;
Jiang等[5]通过分析1275例乳腺癌患者的超声图像,得到CNN模型对乳腺癌分子亚型的阳性预测率达93.29%。同时,也有研究者将AI辅助诊断技术应用到妇科疾病的诊断。Takahashi等[6]通过收集177例患者的宫腔镜视频,提取411800张宫腔镜图片对模型进行训练,最终该模型对子宫内膜病变检测的平均准确率达90.29%。目前,AI医疗设备的临床应用研究正在稳步推进,有望在全球的精准医疗趋势方面发挥重要作用,未来其在医学领域的积极引入是不可避免的。
目前,HPV检测已被推荐为宫颈癌筛查的主要策略。2018年,美国预防医学工作组(USPSTF)报道称,30~65岁女性可每5年进行一次宫颈HPV筛查,无需同时进行巴氏涂片检测[7]。表1总结了部分AI在HPV检测中的应用。
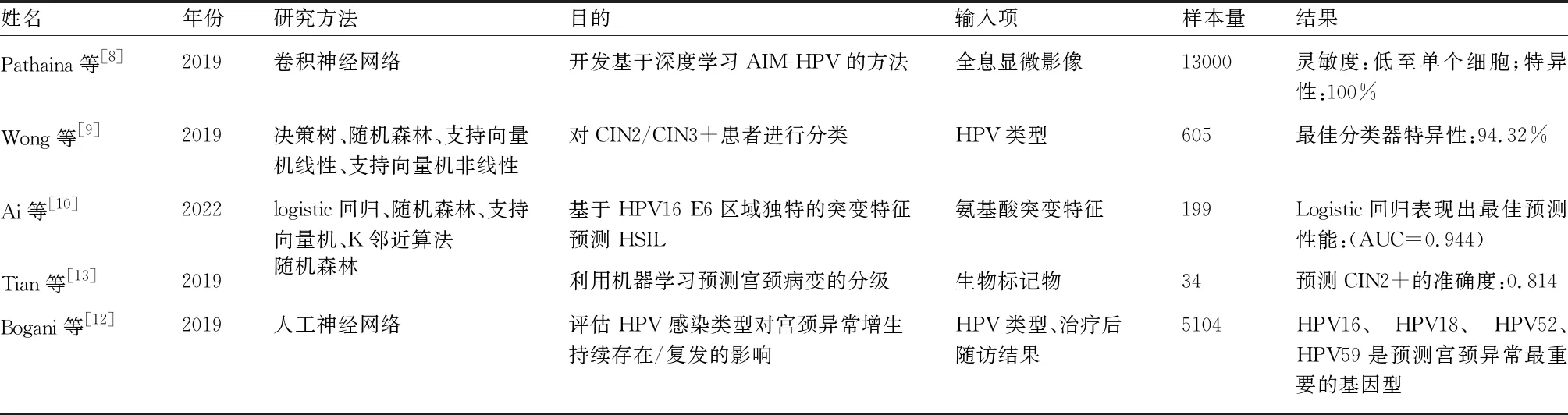
表1 AI辅助诊断系统在HPV检测中的应用
约70%的宫颈癌是由高危型HPV16和HPV18感染引起的,感染HPV16/18的患者比感染其他高危HPV类型更易发展成CIN3+。Pathani等[8]将深度学习与全息显微技术结合,研制了一种即时人工智能检测HPV的方法,在检测HPV16和HPV18时显示出很高的灵敏度(低至单个细胞)和特异性(100%),比传统方法快120倍,并获得FDA的批准。Wong等[9]将机器学习应用到BD Onclarity HPV检测中,构建了一个决策模型,该模型强调了具有发展为CIN2/3+高风险的患者,最佳分类器的特异性为94.32%。经大量数据训练,模型还发现HPV16和HPV33/58共同感染为风险最高的感染类型。Ai等[10]利用下一代测序分析了HPV16 E6区域的氨基酸突变特征,使用四种机器学习算法分别预测宫颈高度鳞状上皮内病变(high-grade Squamous Intraepithelial Lesion,HSIL)的风险,logistic表现出最佳预测性能(AUC=0.944)。基于上述研究,临床医生可根据不同患者感染的HPV类型,利用AI辅助系统对患者疾病做出预测,有助于确定阴道镜检查的优先顺序,以有效管理有需要的患者。
研究表明,在宫颈异常增生初次治疗后锥切切缘阳性和HPV持续感染是宫颈病变持续存在/复发的主要危险因素。据估计,切缘阴性时,术后HPV持续感染超过6个月的患者,宫颈病变持续存在/复发的可能是HPV阴性患者的20倍[11]。因此,筛选出与宫颈异常增生复发密切相关的HPV类型将指导医生制定患者在初次治疗后的随访计划。Bogani等[12]回顾分析5104例HPV-DNA检测患者的数据,将其与接受生殖器HPV相关感染随访或内外科治疗患者的数据相匹配,使用神经网络分析不同HPV基因型在预测宫颈异常增生持续存在/复发中的重要性。结果发现HPV16、HPV18、HPV52和HPV59是预测宫颈初次治疗后病变持续存在/复发的重要基因型,这些数据将有助于医生对患者初次治疗后的管理。
宫颈细胞学涂片作为宫颈癌筛查应用最广泛的方法,对CIN2/CIN3+的宫颈上皮内瘤变具有高度特异性,但敏感度较低。细胞学检查分为传统的巴氏细胞学和液基细胞学,前者将刮取的宫颈脱落细胞手动铺到载玻片上,固定细胞,巴氏染色后由细胞病理学家在显微镜下观察是否有异常细胞。这种人工制片方法,易发生细胞铺展和染色不均匀,造成漏诊。液基细胞学的引入纠正了传统巴氏细胞学玻片制备的缺点,其将宫颈脱落细胞转移到液体培养基中,滤过黏液等杂质后通过离心机将样本铺在玻片上,并采取巴氏染色。大量重复单调的工作可导致细胞病理学家视觉疲劳、注意力不集中和视觉习惯,当细胞病理学家未在玻片中识别出异常细胞或识别出异常细胞后分类错误,就会导致漏诊和误诊。近年来,AI在宫颈细胞学中的应用已经取得了一些进展。William等[14]总结了30篇有关机器学习应用于宫颈细胞学自动化诊断和分类的文章,指出使用CHAMP数字图像软件进行分割时,大多数现有算法的准确率接近93.78%;
在应用二分类(正常或异常)时,K-最近邻和支持向量机算法的准确率最高(分别为99.27%和98.5%)。
PapNet(美国Neruomedical Systems公司产品)、BD FocalPoint(前身是Auto Pap,美国TriPathI Imaging公司产品)、ThinPrep(美国Hologic公司产品)和CytoProcessor TM(法国DATEXIM公司产品)是目前已投入临床使用的人工智能自动检测设备。Rezende等[15]总结了2004年1月至2019年12月发表在SCIELO、PUBMED、MEDLINE数据库中有关应用自动化巴氏涂片筛查的34篇文章,包括三个自动检测系统:Thin Prep成像系统(20项研究)、FocalPoint成像系统(11项研究)、CytoProcessor TM(1项研究)和ThinPrep/FocalPoint组合(2项研究),共自动评估了1317148张宫颈细胞涂片,其中液体细胞学涂片1308028张(99.3%),常规细胞学涂片9120张(0.7%)。结果表明,已投入临床使用的AI辅助宫颈细胞学自动筛查系统在统计学上等于或优于手动方法,降低了诊断的假阴性率,平均样本拒收率≤3.5%。
关于最新筛查系统Cytoprocessor TM的研究中[16],将1352例具有代表性的病例分别用ThinPrep成像系统和CytoProcessor TM系统进行诊断,结果显示:与前者相比,CytoProcessor TM系统在不降低诊断特异性的前提下显著提高了诊断灵敏度,降低了漏诊率(CytoProcessor TM系统漏诊率:1.5%;
ThinPrep成像系统漏诊率:4%)。此外,CytoProcessor TM系统采用虚拟载玻片技术,允许使用web浏览器从任何地方访问结果,这些优势可使医疗资源匮乏的偏远地区获得及时的宫颈癌筛查,避免诊断延误。
AI辅助细胞学阅片系统的核心是利用计算机视觉技术实现对宫颈细胞的精准定位,并对具有诊断意义的细胞实现精准识别,避免了视觉疲劳和主观因素的影响,可弥补人工阅片的不足。阴性样本无需病理医师再次阅片,同时还能对阳性样本中的病变区域和类型自动定位并识别,可明显缩短阅片时间,提高临床工作效率。
作为诊断三阶梯中的第二步,阴道镜检查对指导病变部位活检有重要作用,由于目前缺乏经验丰富的阴道镜医师且诊断过程中主观性大,导致阴道镜成像和病理结果之间的一致性差,易造成漏诊。近年来,已有学者利用深度学习强大的图像分析能力将AI应用到阴道镜图片的诊断中,旨在辅助阴道镜医生,提高宫颈疾病诊断的准确率(表2)。2017年,Sato等[17]回顾性收集158例锥切术后患者的阴道镜图片对Keras神经网络模型进行训练,最终得到验证集的诊断准确率为50%。此项研究是较早期的深度学习在阴道镜方面应用的研究,虽准确率不高,但表明深度学习有潜力应用于阴道镜检查的图片分类。Xue等[18]收集了19435例患者的阴道镜图片,使用CAIADS模型对图片进行学习,旨在开发用于阴道镜图片分类和指导活检的人工智能系统。结果显示,该模型的诊断准确率(82.2%)远高于妇科医生(65.9%)。李燕云等[19]为检测深度学习在宫颈癌和癌前病变诊断中分类和定位的可行性,收集病理诊断为LSIL(5708例)、HSIL(2206例)和宫颈癌(514例)患者的阴道镜图片,采用Faster-RCNN检测宫颈病变区域,并用RestNet101作为提取目标特征的主干网络,结果该模型在HSIL和三类病变定位检测的识别精度均值分别为0.82和0.67。当前研究中,大多数学者的研究对象是醋酸染色后的阴道镜图片,Peng等[20]收集了醋酸染色前和染色后的宫颈图片,使用深度学习网络提取图像特征,开发出基于多模式变化特征的诊断方法(分类准确率:86.3%、灵敏度:84.1%、特异性:89.8%)。

表2 AI辅助诊断系统在阴道镜检查中的应用
上述研究表明,AI辅助阴道镜检查,不仅可提高阴道镜检查的准确率,减少漏诊,还可定位宫颈病变部位,指导阴道镜医师进行活检。有研究者将患者阴道镜图片联合相应HPV分型作为模型训练的输入项,研究CNN对CIN分类的准确性,结果仅用阴道镜图片进行训练的模型分类准确率为0.823,添加HPV分型后的准确率为0.941,表明AI在阴道镜结合HPV分型对宫颈上皮内瘤变诊断的的可行性[21]。
光学相干断层成像(OCT)是一种新兴的无创医学成像技术,利用近红外光干涉法获得生物组织的横截面图像,可实时成像组织分辨率达3~20μm,穿透深度约2mm[24],被誉为“光学活检”。目前,OCT已广泛应用于眼科、心血管科等临床医学领域。研究表明,这项技术可捕捉宫颈组织形态学特征,辅助病理医生和妇科医生临床诊断。有学者[25]采集92例患者离体宫颈组织的OCT图像,使用CNN模型提取图像特征,并用支持向量机分类器进行分类。结果显示五分类(正常、外翻、LSIL、HSIL和癌症)时准确率为88.3%,二分类(低风险与高风险)时AUC为0.959,敏感性、特异性分别为(86.7±11.4)%、(93.5±3.8)%。Ma在上述CNN模型的基础上,提出了自监督纹理对比学习方法,通过733例患者的OCT图像训练后,该方法二分类诊断的敏感性和特异性分别为91.53%、97.37%,达到了2名妇科主任和2位副主任医师判读的平均水平[26]。上述研究表明OCT图像与深度学习相结合的计算机辅助诊断系统,有潜力应用于宫颈疾病的诊断。
根据国际妇产科联合会(FIGO)修订后的肿瘤分期系统,允许使用任何成像模式对宫颈癌进行临床分期。磁共振成像(MRI)是对宫颈癌进行放射学评估的最佳方法,已广泛应用于手术前分期。Urushibara等[27]为比较T2加权图像诊断宫颈癌时,深度学习模型和放射科医生之间的差异,纳入997张患者的图像对CNN模型进行训练,并用分别来自癌症和非癌症患者60张图片进行测试,得出模型和放射科医生的诊断敏感度为0.883和0.783~0.867,特异度为0.933和0.917~0.950,准确度为0.908和0.867~0.892。该研究表明深度学习在T2加权图像上显示出很高的宫颈癌诊断性能,能协助放射科医生诊断宫颈癌。脉管浸润被视为宫颈癌转移的主要评估指标,早期检测出宫颈癌脉管浸润有助于医生选择合适的治疗策略。Wu等[28]基于894例Ib~IIb期宫颈癌行根治性子宫切除术的患者术前MRI,开发了一种术前无创识别淋巴结转移的模型,该模型对淋巴结转移预测的准确率为75%。Jiang等[29]利用多参数MRI数据,首次尝试构建基于CNN的放射组学模型来预测宫颈癌血管浸润和非血管浸润,该模型预测血管浸润的敏感性、特异性分别为0.881和0.752。此外还有研究将AI应用于CT、Pet-CT,探究宫颈癌对新辅助化疗的应答及同步放化疗后复发的预测。
综上所述,AI在宫颈癌筛查和诊断中的应用,可提高宫颈癌筛查和诊断中的特异性和敏感性。在第一阶段的筛查工作中,AI辅助HPV检测和宫颈脱落细胞学检查可提高诊断的准确性,减少不必要的阴道镜分诊。AI辅助细胞学诊断不受时间限制,可用于大量正常宫颈涂片的筛查,据统计,宫颈细胞学结果阴性的占比超过99.5%[30];
同时避免主观因素影响,减少漏诊误诊;
有望解决偏远地区医疗资源匮乏的问题,实现网络远程辅助诊断。AI辅助阴道镜检查同样可避免主观因素的限制,对阴道镜图片进行分类并标记宫颈病变部位,指导阴道镜医师进行活检,减少漏诊。在影像检查中,AI模型不仅有辅助筛查的功能,还能对脉管转移、治疗反应及复发做出预测,协助临床医生调整治疗方案。
虽然现已开展大量AI辅助宫颈癌诊断的研究,但其在医疗领域的应用还处于尝试阶段,仍面临诸多挑战:(1)缺乏用于AI模型训练的高质量数据集,AI辅助诊断系统是一种高度依赖数据的技术,建立多个、标准化的大型数据库是未来需要关注的热点。(2)兼容问题。如细胞学检测产品多、制片方式多样、玻片质量参差不齐,各家医院阴道镜仪器的差异导致图像分辨率、大小不同等势必会对AI辅助诊断系统产生噪音效应进而影响准确性。(3)目前深度学习专家的临床知识有限和临床专家的深度学习知识不足是AI辅助诊断系统研究过程中面临的严峻挑战。因此需临床医生、AI工程师、产品工程师等一起跨学科合作,且研究过程周期长、费用高。(4)AI辅助诊断的可解释性差,缺乏对患者及同行的说服力,需针对深度学习模型被诟病的“黑盒”问题,研究AI辅助诊断结果的可解释方法。(5)AI对疾病的诊断性能还不能完全保证,现有研究多是单中心回顾性数据集研究,缺乏外部验证集,数据质量和过度拟合可能导致AI漏诊、误诊,甚至夸大结果造成过度治疗,且AI辅助诊断系统不能综合考虑患者的临床症状和体征等。基于上述现存的挑战,现阶段更多依赖医生自身专业知识和临床经验做出判断。目前,AI辅助诊断系统的研究正在稳步推进,未来将更好地辅助临床医生进行诊断,为实现WHO提出的2030年全球消灭宫颈癌贡献力量。
猜你喜欢阴道镜细胞学宫颈癌阴道镜下宫颈组织活检术的护理配合及健康教育中国典型病例大全(2022年9期)2022-04-19中老年女性的宫颈癌预防中老年保健(2021年12期)2021-08-24预防宫颈癌,筛查怎么做中国生殖健康(2020年7期)2021-01-18不同类型转化区对阴道镜诊断的影响云南医药(2020年5期)2020-10-27什么情况下需要做阴道镜检查中国生殖健康(2019年3期)2019-02-01Hepsin及HMGB-1在宫颈癌组织中的表达与侵袭性相关性分析河北医学(2016年5期)2016-12-01质核互作型红麻雄性不育系细胞学形态观察中国麻业科学(2015年5期)2015-12-28E-cadherin、Ezrin在宫颈癌组织中的表达及临床意义食管疾病(2015年3期)2015-12-05肺小细胞癌乳腺转移细胞学诊断1例肿瘤预防与治疗(2015年1期)2015-09-26乳腺肿块针吸细胞学180例诊断分析中国卫生标准管理(2015年25期)2015-01-27









