生物制品国家标准物质生命周期管理的思考
时间:2023-06-27 21:50:01 来源:雅意学习网 本文已影响 人 
王一平,谭德讲,孙会敏,毛群颖,2,梁争论,2
1.中国食品药品检定研究院,北京 102629;
2.国家卫生健康委员会生物技术产品检定方法及其标准化重点实验室,北京 102629
标准物质具有复现、保存和传递量值的作用,对实现测量结果的溯源性,保证测量结果在时间与空间上的连续性与可比性,进而确保测量结果的可靠、有效与国际互认具有关键作用。生物制品国家标准物质指用于生物制品效价、活性或含量测定或其特性鉴别、检查的生物标准品、生物参考品[1]。与化学标准物质不同,生物制品国家标准物质基于其结构复杂性和应用特性,具有稳定性要求高、研制成本高、品种种类少、用户少以及所对应制品使用人群数量巨大等特点,对该类标准物质的研发和应用提出了挑战。
生命周期管理(life cycle management,LCM)自20 世纪60 年代提出后,已广泛应用于药品生产和质量控制等方面[2-4]。生物制品国家标准物质作为一种特殊的产品,包含立项(设计)、研制、应用和替换批等各个环节,同样适合采用生命周期理念进行管理。本文从生命周期视角,整体分析生物制品国家标准物质从立项(设计)、研制、应用、稳定性监测到替换批及停用的各个环节,提出生物制品国家标准物质LCM 的框架,即标准物质全周期包含立项(设计)和建立在知识收集和风险管理基础上动态循环的3 个阶段,并结合风险管理的理念,分析生物制品国家标准物质生命周期不同阶段存在的风险点,提出相应的风险控制措施(表1)。
生物制品标准物质分为一级[世界卫生组织(World Health Organization,WHO)国际标准物质]、二级(区域性或国家标准物质)和三级(企业内控品)。当溯源到一级标准物质时,二级和三级标准物质的生物学活性或效价标识均为IU;
当无法溯源到一级标准物质时,国家标准物质可标识为特定活性单位(AU)或单位(U)。一级标准物质主要为冻干剂型,二级标准物质可为冻干或液体剂型,三级标准物质一般为液体剂型。
1.1 生物制品国际标准物质 生物制品国际标准物质分为国际生物标准品(International biological measurement standard)和国际生物参考试剂(reference reagent)[5-6],包括生物治疗、诊断试剂和疫苗 3 大类,其中生物治疗类品种149 个,诊断试剂类品种157个,疫苗类品种97 个[5]。生物制品国际标准物质研制依据为WHO TRS932[6]。2015年,中国食品药品检定研究院(National Institutes for Food and Drug Control,NIFDC)联合英国国家生物制品检定所(National Institute for Biological Standards and Control,NIBSC)建立了WHO Enterovirus A71(EV71)中和抗体国际标准品[7],该品种为我国首次主导建立的国际生物标准物质,其后双方又联合建立了WHO EV71 疫苗国际标准品[8]。
1.2 生物制品国家标准物质 我国于1952年开始建立生物制品国家标准物质,包括细菌浊度标准品、破伤风标准品、白喉抗毒素、康氏抗原、青霉素参考品[9-10]。生物制品国家标准物质分为国家标准品和国家参考品,包括生物治疗类品种74 个,疫苗类品种64 个,诊断试剂类品种210 个[11],收录入《中国药典》三部(2020 版)附录的生物制品国家标准物质62个[12]。生物制品国家标准物质由NIFDC 负责制备、保存和分发,研制依据为《中国药典》三部(2020版)通则《生物制品国家标准物质制备和标定》[1]、WHO 国家(二级)标准品研制手册[6]和ISO 17034:2016《标准物质/标准样品生产者能力认可准则》,即 CNAS:CL04(2017)[13]等。
ICH Q12强调风险管理基础上,提出建立一个贯穿于产品整个生命周期的协调统一的质量体系[2]。《美国药典》通则<1220>将LCM 应用到分析方法,将方法设计、确认、转移和验证活动整合到分析方法生命周期过程中,并将其视为一个连续动态而非割裂的不同独立阶段的活动,以提升分析方法的质量水平[14-15]。风险管理作为LCM 的重要手段,贯穿于生命周期全过程。风险管理的步骤首先为风险识别,主要关注什么可能出错;
其次为风险分析,评估与风险相关的危险因素,是对发生出错事件可能性与严重性进行定量或定性的过程;
最后为风险控制,即采取控制风险的措施,做出降低和/或接受风险的决定,目的是将风险降低到一个可接受的水平。
将生物制品国家标准物质立项(设计)和动态循环的3 个阶段中各个独立环节作为一个生命周期整体进行风险管理:包括原料筛选、生产制备、协作标定、赋值、审批、应用、稳定性监测、替换批和停用等。生物制品国家标准物质全生命周期见图1,生命周期的风险识别和控制措施见表1。

表1 生物制品国家标准物质生命周期的风险识别和控制措施
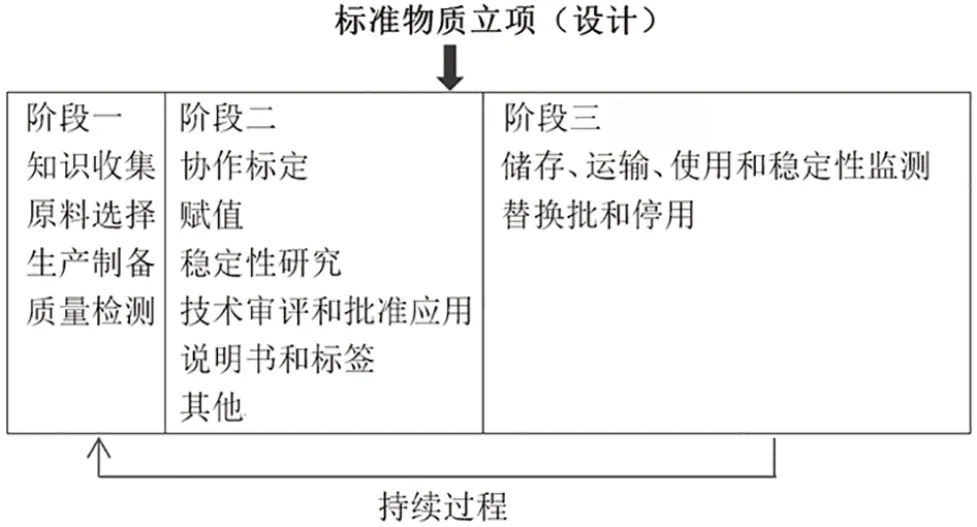
图1 生物制品国家标准物质全生命周期
3.1 生物制品国家标准物质立项(设计) 标准物质的研制应遵守质量源于设计的理念,依据标准物质预期用途,预设实际应用时需满足的均匀性、稳定性等指标。其中稳定性指在规定的时间间隔和环境条件下,标准物质的特性量值保持在规定范围的能力;
均匀性指标准物质最小独立包装单元间或最小独立包装单元内特性量值的差异。
3.2 第一阶段
3.2.1 知识收集 了解和掌握生物标准物质的相关知识是LCM 的基础,有助于明确标准物质研制和应用相关风险,采取相应的控制措施,保障标准物质研制和应用的科学性和有效性。收集的知识应包括但不限于以下几点:①标准物质背景信息:包括研制的必要性和使用目的、预期年供应数、预期使用效期及保存温度;
相关WHO 国际标准物质的研究报告数据,如原料来源及构成、生产制备、协作标定、赋值、均匀性和稳定性数据等。②标准物质原料信息:应了解标准物质原料的生物活性及理化性质,以及均匀性、稳定性、代表性和适用性等关键性能。以人源材料作为标准物质原料或辅料时,需考虑伦理和生物安全性[9]。③检测方法信息:生物活性检测方法应尽可能反映或模拟作用机制,并充分了解检测方法的原理和特性,确认检测指标与生物活性之间的相关性。应采用经验证的方法进行生物活性检测。充分了解检测方法的误差对于标准物质的赋值以及稳定性评价和质量监测具有重要意义。④参与协作标定的实验室信息:包括实验室的相关资质、经验、试剂及仪器等信息,及其用于检测同类样品或相似样品的任何已有方法。
3.2.2 原料选择 原料是标准物质研制的基础,应比对不同原料以获得候选标准物质。原料质量应符合预期要求,原则上应与相应的国际标准物质以及待测制品具有同质性,不含干扰性杂质或成分,具有足够稳定性和数量。
3.2.3 生产制备 应针对制品性质评估是否需冻干,如需制成冻干制品,应优化冻干工艺,保证冻干制品的生物活性不发生改变。冻干时,用于分装、在线监控、无菌/洁净室空气过滤、灭菌、洗涤和纯水、存储、冻干机等相关设备应经验证,需评估安瓿/西林瓶(中硼硅玻璃)的密封性,以及分装、冻干过程、熔封、容器材质和胶塞对候选标准物质生物活性和稳定性的影响。所使用的检测方法应基于药典或WHO 指南,使用其他检测方法时需进行验证或确认。
3.2.4 质量检测 应根据标准物质特性和预期用途开展外观、均匀性、水分、分装精度、无菌和生物活性/效价等项目的检测。冻干标准物质的外观应为一致、形状良好的疏松体。通常需评价最小独立包装间的均匀性,根据预期使用目的,如允许分次使用,则需评价最小独立包装内的均匀性,应优先选择标准物质标示的特性项目进行均匀性检测,并需关注抽样方式,采用适宜的统计学方法分析样本间的差异,要求均匀性检验合格后,方可开展稳定性等后续项目检测;
低水分含量对于冻干标准物质的长期储存至关重要,WHO 国际标准物质的水分含量要求<1%,国家标准物质水分含量应<3.0%,分装精度应在±1%以内,无菌应符合要求。
3.3 第二阶段
3.3.1 协作标定 协作标定参与实验室数量和检测次数与研究的目的有关。应至少满足《中国药典》三部(2020 版)的相关规定,即协作单位应至少3 家经认可的实验室,获得5 次独立的有效结果,在此基础上依据标准物质特性以及检测方法变异度确定实验室数目和检测次数,以满足统计学要求。
协作标定时为提高研制成功的概率以及考虑替换批的需要,可考虑同时制备和发放2 ~3 个候选标准物质样本。为评价实验室检测能力和检测方法以及候选标准物质对待测样本的适应性,可设置重复样本,高、中、低浓度样本以及不同基质(如血清、血浆、球蛋白)样本。
为考察标准物质的适用性,明确适用制品的类型,如标准物质是否同时适用于单价、多价及联合疫苗等。在协作标定时可根据实际需求设置不同类型待测样本。
协作标定时检测方法应经验证,可选用单个或多个检测方法。应使用适宜的分析统计模型处理协作标定数据,并对每一次试验拟合模型的有效性进行分析,证明拟合模型有效。两个或多个检测方法获得的数据可在概率分布一致的前提下合并计算均值。协作标定结果应证明候选标准物质能降低不同实验室间的检测误差。
3.3.2 赋值(定值) 当有国际标准物质时,应溯源到国际标准物质,即利用WHO 国际标准物质量值传递的方式赋值,在协作标定研究中直接对候选标准物质用现行国际标准物质进行赋值。赋值应遵循良好的统计原则,如采用线性模型时,应评估一级和二级标准物质之间的对数剂量-效应关系的平行性。应采用恰当的统计学方法剔除实验室检测结果的可疑值。当采用多种检测方法赋值时,应在通过统计分析证实不同方法数据分布具有一致性的前提下方可合并赋值。同时,应计算不确定度或95%可信限;
当无WHO 国际标准物质时,可人为赋予一个特定值,此时不考虑不确定度或95%可信限。如EV71 疫苗中和抗体国家标准品及抗原国家标准品,均为在协作标定证明候选标准物质具有降低不同实验室检测误差后,赋予一个特定值,均为1 000 U/mL[7-8,16]。标准物质的赋值应在均匀性、稳定性以及质量检测完成后进行。
3.3.3 稳定性研究 稳定性研究的目的为在设定的储存条件下,标准物质特性量值能符合预期使用的时间,确定标准物质分发到用户的运输条件以及冻干制品复溶后生物活性的维持时间。
加速稳定性试验应依据《中国药典》规定进行(一般设4个温度:4、25、37及-20 ℃)、不同时间点进行测定,按照时间间隔先密后疏的原则实施。
标准物质的预期有效时间可依据加速稳定性研究实验结果,应用阿仑尼乌斯(Arrhenius)公式等预测模型推算,也可参考同一或同类产品的历史资料或经验,以及使用者的反馈数据。目前生物制品国家标准物质不设有效期,按照规定条件保存的标准物质在NIFDC发布停用通知前有效。
3.3.4 技术审评和批准应用 国家生物制品标准物质分委会和国家标准物质管理部门分别负责组织生物制品国家标准物质的技术审评以及批准使用。
3.3.5 说明书和标签 标准物质说明书应包括以下内容:预期用途、原料来源、特性量值、储存条件、适用的检测方法(使用范围)、使用方法等。标准物质标签应使标准物质具有唯一识别性。
3.3.6 其他 应开展标准物质的结构及组分表征(冻干品种应在冻干前进行)和活性及免疫原性研究,为标准物质的应用和稳定性判定提供依据。
3.4 第三阶段
3.4.1 储存、运输、使用和稳定性监测 储存、运输应符合标准物质说明书要求。用户应按说明书规定范围使用,超出规定用途范围时用户应进行适用性研究。
建立监测标准物质长期储存稳定性的方案,在售期间应定期进行质量监测,确保标准物质量值可靠准确。分发供应研制品种的国家实验室负责标准物质的趋势分析、期间核查以及定期与国际标准物质或基线标准物质(一般指-80 ℃保存的标准物质)对标。进行标准物质趋势分析时需关注所使用检测方法的趋势变化,此项工作通常与质量监测工作合并进行。
3.4.2 替换批和停用 应按计划或根据监测结果及时进行标准物质的替换批。应依据WHO 国际标准物质而非前一批国家标准物质进行赋值标定,仅当WHO 国际标准物质不可及时,才可考虑根据前一批国家标准物质进行标定。如前一批国家标准物质未能与国际标准物质溯源,应说明换批标准物质与前一批国家标准物质的量值关系,保证前后两批国家标准物质的稳定衔接。
在稳定性研究、质量监测、客户反馈、内部或外部审核等环节识别出标准物质质量发生变化时,应按照相关质量体系文件中的规定及时采取停用处置措施,包括发布停用通知、启动换批,发布召回通知等。
近年来我国生物制品行业发展迅速,特别是新冠疫情加速了相关生物制品的研发,多个制品如新冠病毒相关疫苗、单抗、核酸和抗原诊断试剂快速批准紧急使用或上市,对生物制品国家标准物质提出了新的挑战和要求。生物制品标准物质其内在和使用的特点,凸显了进一步提升该类标准物质质量管理水平的重要性。本文提出生物制品国家标准物质全生命周期管理包含建立在知识收集和风险管理基础上动态循环的3 个阶段,进一步依据《中国药典》和WHO 二级生物制品标准物质研制等相关法规和指南文件,梳理生物制品国家标准物质研制和应用各个环节可能存在的主要风险,并提出了相应的风险控制措施,为提升我国生物制品国家标准物质研制及应用水平提供了思路。
猜你喜欢生物制品冻干国际标准吉林正业生物制品股份有限公司猪业科学(2022年10期)2022-11-03吉林正业生物制品股份有限公司吉林畜牧兽医(2022年7期)2022-07-20吉林正业生物制品股份有限公司猪业科学(2022年2期)2022-04-21国际标准ISO 22992-2:2020正式发布纺织科学研究(2021年1期)2021-03-19武汉佳成生物制品有限公司中国酿造(2019年9期)2019-10-08HPLC法测定注射用清开灵(冻干)中6种成分中成药(2018年4期)2018-04-26《猪瘟高免血清冻干粉的初步研究》图版中国兽医杂志(2016年7期)2016-08-30我国参与编制多项光伏逆变器国际标准中国质量与标准导报(2015年2期)2015-02-28我国专家制定首项缓释肥料国际标准中国质量与标准导报(2015年2期)2015-02-28嗜酸乳杆菌NX2-6冻干发酵剂的研究食品工业科技(2014年23期)2014-03-11









