双酚A通过氧化应激干扰小鼠卵母细胞体外成熟
时间:2023-06-26 16:15:04 来源:雅意学习网 本文已影响 人 
万辽,王爽,于金红,丁婧如,邹清,王喜艳*
1吉林医药学院公共卫生学院,吉林省 吉林市 132013;
2吉林医药学院形态学实验室,吉林省 吉林市 132013;
3吉林医药学院临床医学院,吉林省 吉林市 132013;
4吉林医药学院药学院,吉林省 吉林市 132013
双酚A(bisphenol A,BPA)是一种常见的工业化合物,广泛存在于食品包装材料等多种日常生活用品中[1],可随食物等进入人体。由于与人体的广泛接触,BPA对人体可能产生的不良影响日益受到关注。大量研究显示BPA对女性生殖功能有干扰和损伤作用,尤其是干扰卵泡发育和卵母细胞成熟。例如,BPA可干扰纺锤体的正常形态,进而严重干扰减数分裂进程,抑制卵母细胞的成熟[2-3];
BPA也可能通过其他途径如氧化应激损伤途径干扰卵母细胞的成熟[4-6]。但是,以小鼠为研究对象的关于BPA对于抗氧化酶表达的相关研究结果尚存在争议。本研究在小鼠卵母细胞体外成熟过程中添加BPA,统计卵母细胞成熟率并检测卵母细胞中活性氧(reactive oxygen species,ROS)的水平,同时检测抗氧化酶的表达水平,探究BPA可能引起的小鼠卵母细胞氧化应激损伤,旨在为BPA是否干扰卵母细胞抗氧化酶表达提供实验数据。
1.1 实验动物 雌性性成熟ICR小鼠40只,清洁级,购自吉林大学实验动物中心[实验动物生产许可证号:SCXK(吉)2021-0001]。实验过程符合国家和单位有关实验动物的管理和使用规定。
1.2 小鼠卵母细胞体外成熟 注射孕马血清促性腺激素(pregnant mare serum gonadotropin,PMSG)46 h后,采用颈椎脱臼法处死小鼠;
取双侧卵巢置于含10%胎牛血清(FBS)的操作液中,体视显微镜下用1 ml注射器去除卵巢周围的组织,然后用1 ml注射器刺破卵巢中的大卵泡,使卵丘复合体(cumulus-oocyte complexes,COCs)游离出来;
将完整的COCs随机分为对照组、二甲基亚砜(DMSO)组和BPA组,分别移入50 μl普通的α-MEM培养液[12571-063,美国Gibco公司,含5% FBS、0.1 U/ml促卵泡激素(follicle-stimulating hormone,FSH)、7.5 U/ml 人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)和0.2 mmol/L丙酮酸钠]、含有0.1% DMSO或45 μmol/L BPA的α-MEM培养液中进行培养;
培养16~18 h,用透明质酸酶消化掉颗粒细胞,获取卵母细胞;
统计卵母细胞成熟率[处于第二次减数分裂中期(metaphase of the second meiosis,MⅡ)细胞的占比]。
1.3 DCFH-DA探针试剂盒检测卵母细胞中ROS水平 取3组MⅡ期和BPA组生发泡期(germinal vesicle,GV)卵母细胞,移入1:1000稀释的DCFH-DA探针中;
另设阳性对照组,将活性氧阳性对照刺激液(Rosup)按1:1000的比例稀释于DCFH-DA探针稀释液(1:1000)中,取对照组MⅡ期卵母细胞移入稀释的Rosup液中。各组卵母细胞均在37 ℃细胞培养箱内孵育20 min;
每隔3~5 min混匀一下,使探针和细胞充分接触;
然后用D-PBS(pH 7.0~7.2)洗3次,5 min/次,移入5 μg/ml Hochest 33342染色液中室温孵育15 min。最后将卵母细胞移到载玻片上,在共聚焦显微镜下观察拍照。
1.4 免疫荧光法检测卵母细胞中抗氧化酶的表达水平 取3组MⅡ期和BPA组GV期卵母细胞,将卵母细胞在4%多聚甲醛溶液中室温固定30 min,用含0.1% PVP的D-PBS(pH 7.0~7.2)洗3次,5 min/次,然后将卵母细胞移入含0.5% TritonX-100的PBS中,室温孵育1 h,再移入封闭液(2% BSA)中室温封闭1 h。将卵母细胞移入兔源的过氧化氢酶(catalase,CAT)、超氧化物歧化酶1(superoxide dismutase 1,SOD1)、超氧化物歧化酶2(superoxide dismutase 2,S O D 2)和谷胱甘肽过氧化物酶4(g l u t a t h i o n e perox idase 4,GPX4)抗体(A11777、A0274、A1340、A1933,武汉ABclonal生物科技有限公司)中4 ℃过夜孵育。次日用PBST(pH 7.0~7.2)洗涤3次后,将卵母细胞移到FITC标记的羊抗兔二抗(AS011,武汉ABclonal生物科技有限公司)中37 ℃孵育1 h,5 μg/ml Hochest 33342染色液中室温孵育15 min。最后将卵母细胞移到载玻片上,在共聚焦显微镜下观察拍照。重复3次后用 Image pro-Plus 6.0软件对图像进行荧光强度值分析。
1.5 Western blotting检测卵母细胞中抗氧化酶的表达水平 取3组MⅡ期和BPA组GV期卵母细胞各60个,置于10 μl Laemmli 缓冲液中溶解并全部上样,100 V恒压电泳约90 min,300 mA湿转膜45 min,5%脱脂奶粉封闭1 h,然后将膜在兔源的CAT、SOD1、SOD2、GPX4抗体和β-actin抗体(A11777、A0274、A1340、A1933、AC026,武汉ABclonal生物科技有限公司)中4 ℃过夜孵育。次日,将膜在辣根过氧化物酶(HRP)标记的羊抗兔二抗(AS014,武汉ABclonal生物科技有限公司)中室温孵育1 h。然后,将转有蛋白的PVDF膜放入Tanon 4600成像系统中,覆上增强显影液,用Tanon Imaging System软件进行拍照。重复3次后用 ImageJ软件对图像进行灰度值分析。
1.6 统计学处理 采用SPSS 17.0软件进行统计分析。符合正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2.1 BPA处理对小鼠卵母细胞成熟率的影响 小鼠卵母细胞体外成熟16~18 h后获取卵母细胞,统计结果显示,与对照组和DMSO组比较,BPA组卵母细胞成熟率明显降低(P<0.05,表1)。
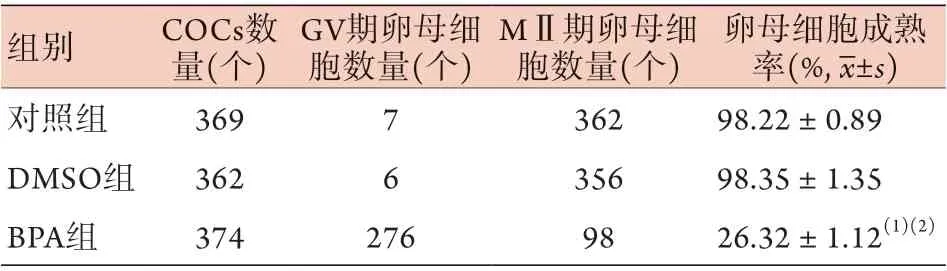
表1 BPA对小鼠卵母细胞体外成熟率的影响(n=9)Tab.1 Effect on maturation rate of mouse oocytes exposure to BPA in vitro (n=9)
2.2 BPA处理对小鼠卵母细胞中ROS水平的影响
DCFH-DA探针试剂盒检测结果显示,与对照组和DMSO组的MⅡ期卵母细胞比较,BPA组MⅡ期和GV期小鼠卵母细胞中ROS水平均明显增高(P<0.05,图1)。
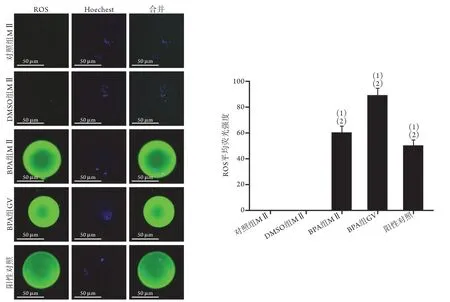
图1 DCFH-DA探针法检测小鼠卵母细胞中ROS水平(n=3)Fig.1 Levels of ROS in mouse oocytes measured with DCFH-DA probe (n=3)
2.3 BPA处理对小鼠卵母细胞中抗氧化酶CAT和SOD2表达水平的影响 采用免疫荧光染色和Western blotting同时检测CAT、SOD1、SOD2和GPX4的表达水平,结果显示,与对照组和DMSO组的MⅡ期卵母细胞比较,BPA组MⅡ期和GV期卵母细胞中CAT和SOD2表达水平均明显降低(P<0.05,图2);
免疫荧光法和Western blotting均未检测到3组卵母细胞中SOD1和GPX4蛋白的表达。
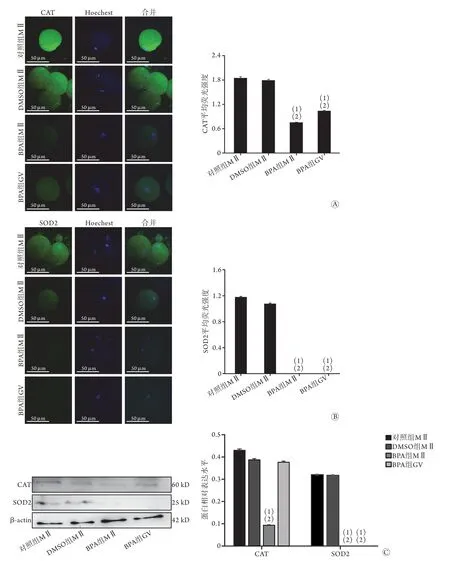
图2 BPA对小鼠卵母细胞中抗氧化酶CAT和SOD2表达的影响(n=3)Fig.2 Effects on the expressions of antioxidant enzyme CAT and SOD2 in mouse oocytes exposure to BPA in vitro (n=3)
BPA是一种广泛存在的内分泌干扰物,常用于食品包装袋、矿泉水瓶等塑料产品中,这些塑料产品中的少量BPA可逐渐释放到食物中并随食物进入人体。BPA的结构与己烯雌酚类似,作为一种外源性雌激素类似物进入体内后,与其他人工合成的雌激素类似,在肝内代谢较慢;
大部分BPA可在血液中与雌激素结合球蛋白结合,随血液循环进入雌激素的靶器官而发挥类雌激素作用。研究显示,BPA可严重影响生殖功能和发育过程[7-9],尤其是干扰女性生殖功能,包括干扰减数分裂[2]、胚胎发育[10]、激素生成[11]和后代的雌性比例。近年的研究显示,BPA可引起睾丸的氧化应激损伤而影响男性生殖功能[12-14],而BPA干扰女性生殖功能是否也与氧化应激损伤有关越来越受到关注。
在卵母细胞成熟过程中,ROS作为卵丘细胞和卵母细胞新陈代谢的中间产物和第二信使而自然产生[16-17]。但是,ROS生成增加可引起细胞氧化应激损伤,后者可降低DNA自我修复能力、扰乱细胞周期进程,甚至引发细胞凋亡。本研究结果显示,BPA可导致卵母细胞中ROS生成增多,过多的ROS可抑制卵母细胞成熟,与既往研究结果[18-19]一致。
关于BPA影响抗氧化酶表达的研究结果目前仍存在一定争议[5,18]。以猪卵母细胞为研究对象的结果较为一致,均显示在卵母细胞内ROS含量增高的同时,抗氧化酶的表达也增高[4,20]。以小鼠卵母细胞为对象的研究结果则不一致。Alireza等[21]的研究显示,连续21 d皮下注射50 μg/(kg.d)或100 μg/(kg.d)的BPA替代物双酚S(bisphenol S,BPS),可致卵巢组织内抗氧化酶CAT、SOD和GPX的表达明显下降;
但Ding等[5]的研究显示,在小鼠卵母细胞体外成熟过程中接触100 μmol/L的BPA替代物双酚AF(bisphenol AF,BPAF)可导致卵母细胞内SOD2水平显著升高。上述两项研究给予小鼠BPA替代物的途径不同,且前者检测的是整个卵巢组织而非卵母细胞中的抗氧化酶的表达水平,后者仅检测了卵母细胞内SOD2的表达水平,未报告其他过氧化酶的表达情况。鉴于BPA对小鼠卵母细胞氧化应激损伤尤其是对抗氧化酶的影响研究较少,且结果并不一致,本研究再次探讨了BPA在小鼠卵母细胞体外成熟中产生的氧化应激损伤,采用免疫荧光和Western blotting两种方法着重观察抗氧化酶的表达情况。结果显示,BPA导致小鼠卵母细胞中抗氧化酶CAT和SOD2的表达明显下降,而小鼠卵母细胞中均未检测到SOD1和GPX4的表达。因此推测45 μmol/L BPA对于小鼠卵母细胞中抗氧化酶CAT和SOD2的表达具有抑制作用,但抑制作用是发生在基因转录还是翻译阶段尚待进一步研究;
人正常卵母细胞中是否表达SOD1和GPX4也有待观察。
本研究还发现,45 μmol/L BPA可将小鼠卵母细胞阻滞在GV期,提示BPA能干扰卵母细胞第一次减数分裂的恢复,导致卵母细胞未发生生发泡破裂(GVBD);
另外,与对照组比较,接触45 μmol/L BPA后未被阻滞而进入MⅡ期的卵母细胞中ROS水平显著增高,且CAT和SOD2的表达显著降低,提示接触BPA未被阻滞而获得的MⅡ期卵母细胞存在氧化应激损伤,可能导致卵母细胞的早期凋亡或影响其受精和胚胎发育能力,但其受影响程度有待进一步观察与研究。
总之,本研究显示,BPA可通过氧化应激损伤途径抑制小鼠卵母细胞的体外成熟,为BPA抑制抗氧化酶表达的观点提供了实验依据。45 μmol/L BPA抑制抗氧化酶表达的机制及其是否会导致卵母细胞凋亡或受精和早期胚胎发育能力异常尚待进一步研究。
猜你喜欢卵母细胞孵育探针cAMP 调节剂对卵母细胞体外成熟效果的调节机制研究进展中国畜牧杂志(2021年5期)2021-12-05C 型钠钛对犬卵母细胞体外成熟效果的影响中国畜牧杂志(2020年6期)2020-07-11三物黄芩汤组分(群)配伍在大鼠肝微粒体孵育模型中的相互作用中成药(2017年9期)2017-12-19牛卵母细胞的体外成熟培养研究河南畜牧兽医(2017年8期)2017-11-24大鼠肝微粒体孵育体系中2种成分的测定及其代谢中成药(2017年5期)2017-06-13凋亡抑制剂Z-VAD-FMK在猪卵母细胞冷冻保存中的应用上海农业学报(2017年3期)2017-04-10多通道Taqman-探针荧光定量PCR鉴定MRSA方法的建立现代检验医学杂志(2016年3期)2016-11-15BOPIM-dma作为BSA Site Ⅰ特异性探针的研究及其应用三峡大学学报(自然科学版)(2016年6期)2016-04-16精子与慢病毒孵育制备转基因猪的分子检测及遗传分析华南农业大学学报(2015年5期)2015-12-04透射电子显微镜中的扫描探针装置物理实验(2015年9期)2015-02-28








