浙江舟山海域大型底栖动物群落组成及主要影响因子分析*
时间:2023-06-15 19:35:04 来源:雅意学习网 本文已影响 人 
宋 晨 许丽婷 王晓波 孟 周 韩庆喜①
(1. 宁波大学海洋学院 浙江宁波 315832; 2. 国家海洋局宁波海洋环境监测中心站 浙江宁波 315012; 3. 禹治环境科技(浙江)有限公司 浙江宁波 315199)
舟山海域地处浙江省东北部和长江口南侧, 西与杭州湾相接(《中国海岛志》编纂委员会, 2014), 受长江巨大径流量(年平均9.24×1011m3) (周进等, 2018)和入海泥沙(年平均泥沙输入量约0.5×108t) (胡敦欣等,2001)的影响。长江径流携大量泥沙入海后与海水混合形成盐度略低的长江冲淡水, 并与该海域的黑潮、台湾暖流和闽浙沿岸流等水系共同作用于舟山海域(Gonget al, 1996; Ichikawaet al, 2002; 刘清河等,2020), 共同塑造了该海域复杂的物理、化学、生物和地质进程以及多变的生态环境(Chenet al, 1999; Qiuet al, 2018)。舟山海域是东海海区著名的上升流区, 兼之受长江、钱塘江、甬江等河流丰富营养盐输入的影响(周伟华等, 2006), 使得舟山海域水质肥沃, 浮游植物大量繁殖, 浮游动物种类多且数量大(俞存根等, 2010),为岱衢族大黄鱼(Larimichthys crocea)、带鱼(Trichiurus japonicus)和三疣梭子蟹(Portunus trituberculatus)等多种重要渔业生物提供了重要的产卵、育幼以及索饵洄游的场所(李建生等, 2004), 形成了中国最为著名的舟山渔场。近年来, 舟山海域经历了污水排放、捕捞、航运、清淤等形式多样、强度不一的人为扰动和环境变化(刘录三等, 2012; 张洪亮等, 2012), 对该海域的生物化学进程、生物多样性以及渔业生产等带来了深远的影响(Fanet al, 2014; Hanet al, 2019)。
海洋底栖生物具有高度的生物多样性和复杂的生态学关系(李新正等, 2010; 沈国英等, 2010)。其中,大型底栖动物物种多样性较高、生活史较长、运动性较弱, 其群落组成等信息能够灵敏地反应环境变化和人为扰动对生态环境的综合影响(Pearsonet al,1978; 蔡立哲, 2003; Qiuet al, 2018), 并可准确反映有机质积累等长期生态学效应(Pearsonet al, 1978;于子山等, 2001; Hanet al, 2013; Kanayaet al, 2018)。根据2019~2020 年舟山海域2 个航次的大型底栖动物和环境因子的调查数据资料, 结合该海域已有的大型底栖动物群落组成等历史资料和研究报道, 分析舟山附近海域大型底栖动物群落组成特点及其与环境因子的内在关联, 旨在为东海近岸海域大型底栖动物群落的演变规律研究提供基础数据和科学依据。
1.1 调查区域和时间
于2019 年7~8 月(夏季)至2020 年7~8 月(夏季)对舟山及邻近海域进行了2 个航次的大型底栖动物调查取样, 调查区域为29°~31°N, 122°~124°E, 设置12 个相同站位, 站位点分别标记为Z1~Z12, 站1、3、5、6、7、9、11 分布在舟山, 站2、4、8、10、12 分布在舟山邻近海域。站位分布如图1 所示。

图1 2019~2020 年舟山及附近海域大型底栖动物采样站位分布图Fig.1 The sampling stations of macrobenthos in Zhoushan and adjacent areas during 2019~2020
1.2 采样方法
采用0.1 m2的箱式采泥器进行大型底栖动物样品采集, 每站采集两次, 采集的泥样在船上用1.0 mm 和0.5 mm 孔径的套筛冲洗, 所得大型底栖动物样品采用75%的酒精固定, 带回实验室进行鉴定分析。
在实验室用1%的虎红酒精溶液对固定样品进行染色分拣, 将拣出的大型底栖动物在体视解剖镜(SZ61, 日本奥林巴斯)下进行形态学的分类鉴定, 鉴定到尽可能低的分类阶元, 物种的分类学归属参照WoRMS (www.marinespecies.org)的最新分类系统,螠虫在本文中将被归于环节动物门多毛纲, 将不再单统计 螠门。鉴定完成之后, 对该站位的所有物种进行计数和称量, 计数时, 易断的纽形动物和多毛类按头部计数, 蛇尾类按体盘数计数; 称重时, 将标本置于卫生纸上将其表面浸润的酒精拭干, 采用电子天平(600772, 上海花潮电器有限公司, 精度0.01 g)称量并记录, 管栖多毛类动物剥去栖居的泥管, 软体动物带贝壳称重。计算每个物种的丰度(ind./m2)和生物量(g/m2)。调查规范依据《海洋调查规范》第6 部分:海洋生物调查(中华人民共和国国家质量监督检验检疫总局等, 2008)。
水深、水温和盐度采用YSI 水质检测仪测量(YSI,Ohio, USA)进行测量; pH 采用pH 计法; 溶解氧采用碘量法; 化学需氧量采用碱性高锰酸钾法; 活性磷酸盐采用磷钼蓝分光光度法/流动注射法; 亚硝酸盐采用奈乙二胺分光光度法/流动注射法; 硝酸盐采用锌-镉还原法/流动注射法; 铵盐采用次溴酸盐氧化法/流动注射法; 活性硅酸盐采用硅钼蓝法/流动注射法;悬浮物采用过滤物重量法; 叶绿素a采用荧光分光光度法。
1.3 优势种分析
大型底栖动物群落的优势种有着多种形式的计算方法和判定标准, 相对重要性指数(index of relative importance, IRI)全面考虑了大型底栖动物群落的个体数量、大小和分布频率密度等情况, 能够定量地反应出优势种在目标海域的地位、重要性和数量分布的变化情况(韩洁等, 2004), 更能反映优势种在群落生产力的重要性(Smithet al, 2003), 因此采用相对重要性指数(对大型底栖动物优势种进行排序和分析。优势度IRI 计算公式(Pinkaset al, 1971)如下:
IRI = (N+W) ×F, (1)
式中,N为某一物种在该站位中的个体数百分比(单位:%),W为该种在该站位中的生物量百分比(单位: %),F为该种出现的站位数与总站位数的比率(单位: %)。
1.4 数据处理
使用软件ArcGIS Desktop 10.6 绘制采样站位分布图和环境因子及群落相关参数的分布图; 使用Microsoft Excel 2010 计算优势度; 使用多元统计软件PRIMER (Plymouth Routines in Multivariate Ecological Research) version 6.0 计算群落中各个站位的Shannon-Wiener 多样性指数和Margalef 物种丰富度指数、物种等级聚类(Cluster)和主坐标分析(principal coordinates analysis, PcoA); 使用R studio 1.1.447 计算大型底栖动物的群落参数和环境因子的斯皮尔曼等级相关矩阵;使用PASW Statistics 18.0 计算群落参数之间的显著性差异和环境因子间的Pearson 相关性分析。
在计算物种等级聚类(Cluster)之前, 先对大型底栖动物的数据进行整理, 经二次方根转化为 Bray-Curtis 矩阵, 再进行计算。在相关性系数和多重双变量相关的P值的计算过程中使用了Bonferroni-Holm较正。
2.1 舟山及邻近海域大型底栖动物群落的优势种
根据2019~2020 年在舟山及邻近海域采集到的标本, 共鉴定出大型底栖动物56 种, 其中多毛类动物28 种, 甲壳动物8 种, 软体动物7 种, 棘皮动物6种, 刺胞动物3 种、纽形动物2 种, 星虫动物和脊索动物各1 种。其中2019 年有大型底栖动物30 种, 2020年有37 种, 两年共有物种有9 种。多毛类动物是出现最多的动物类群, 占总种数的50.00%, 甲壳动物和软体动物次之, 分别占总物种数量的 14.29%和12.50%。在使用箱式采泥器采泥时, 所采获的大型底栖动物以底内动物为主, 但是也采集到了一些底上动物, 如脊索动物中的鱼类孔 鰕虎鱼(Trypauchen vagina), 甲壳动物中的日本鼓虾(Alpheus japonicus)、无刺口虾蛄(Oratosquillina inornata)、拉氏爱琴虾(Aegaeon lacazei)、 直额 蟳[Charybdis(Goniohellenus)truncate]等, 均具备一定的游泳能力和垂直移动能力。
2019~2020 年间舟山及其邻近海域的大型底栖动物的优势度最大的10 种优势种(表1)如下: 分别为刺胞动物门的星虫爱氏海葵(Edwardsia sipunculoides),多毛类动物的不倒翁虫(Sternaspis chinensis)、异足科索沙蚕(Kuwaita heteropoda, 即以前文献中出现的异足索沙蚕)、智利巢沙蚕(Diopatra chiliensis)、埃刺梳鳞虫(Ehlersileanira incisa)、竹节虫(Maldanesp.)和双唇索沙蚕(Lumbrineris cruzensis), 甲壳动物中的沟纹拟盲蟹(Typhlocarcinops canaliculatus), 棘皮动物的棘刺锚参(Protankyra bidentata)以及纽形动物门的纽虫(Nemertea)。在此10 种优势种中, 除竹节虫和智利巢沙蚕外, 其余8 种在2019 和2020 年两年间, 其相对重要性指数至少在某一年在前10 位, 其中不倒翁虫在这两年的相对重要性指数均在前10 位。在2019年, 相对重要性指数最高的是异足科索沙蚕(IRI=588.37)和星虫爱氏海葵(IRI=451.80); 在2020 年相对重要性指数最高的则为纽虫(IRI=2752.89)和沟纹拟盲蟹(IRI=393.08)。

表1 2019~2020 年舟山及邻近海域大型底栖动物群落优势度最大的10 个优势种Tab.1 The top 10 dominant species with highest IRI value of the macrobenthic assemblages in Zhoushan and adjacent waters during 2019~2020
2.2 舟山及邻近海域大型底栖动物群落的丰度和生物量
在2019~2020 整个研究时间范围内, 舟山及其邻近海域大型底栖动物群落的总丰度组成如表2 所示:多毛类(57.36%), 纽形动物门(15.49%), 节肢动物门(10.32%), 软体动物门(8.41%), 棘皮动物门(3.82),刺胞动物门(3.63%), 脊索动物门(0.57%)和星虫动物(0.38%)。除纽虫外, 丰度最高的4 个物种均为多毛纲动物, 即双唇索沙蚕、奇异稚齿虫(Paraprionospio pinnata)、持真节虫(Euclymene annandalei)、异足科索沙蚕, 此5 种占据了整个采样周期丰度的33.08%。在采样周期内, 丰度最高的10 种动物为日本刺沙蚕(Hediste japonica)、智利巢沙蚕、不倒翁虫、竹节虫、双唇索沙蚕、麦杆虫(Caprellasp.)、持真节虫、奇异稚齿虫、异足科索沙蚕和纽虫, 它们的丰度占据了总丰度的49.72%, 此10 种动物除日本刺沙蚕和麦秆虫外,在一个或两个采样季度的相对重要性指数在前十位。
在2019~2020 整个研究时间范围内, 舟山及其邻近海域大型底栖动物群落的生物量组成如表2 所示:多毛类(12.76%), 纽形动物门(2.68%), 节肢动物门(15.95%), 软体动物门(11.57%), 棘皮动物门(16.62),刺胞动物门(31.54%), 脊索动物门(7.87%)和星虫动物(1.02%)。在整个采样周期, 刺胞动物门的星虫爱氏海葵、棘皮动物的棘刺锚参、脊索动物门的孔 鰕虎鱼以及甲壳动物门的沟纹拟盲蟹是生物量的最大贡献者, 分别贡献了总生物量的29.30%、9.22%、7.86%和6.83%。对生物量来说, 较大个体的偶见种占据了较高的比例, 在生物量最高的前10 物种中, 其中有6个物种, 包括江户明樱蛤(Moerella jedoensis)、无刺口虾蛄(Oratosquillina inornata)、节织纹螺(Nassarius hepaticus)、海棒槌(Paracaudina chilensis)、日本鼓虾(Alpheus japonicus)、红带织纹螺(Nassarius succinctus)仅出现一次, 但这6 个物种的合计生物量占据了群落总生物量的23.14%。

表2 2019~2020 年舟山及邻近海域大型底栖动物各类群的丰度与生物量Tab.2 The macrobenthic abundance and biomass from Zhoushan and adjacent waters during 2019~2020
2.3 舟山及邻近海域大型底栖动物丰富度指数和多样性指数
在2019~2020 整个研究时间范围内, 舟山及其邻近海域大型底栖动物群落的丰富度指数和多样性指数如表3 所示: 2019 年, 舟山及其邻近海域各站位出现的底栖动物种类数为1~10 种, 平均为4.67 种; 丰富度指数(d)为0~1.85, 平均值为0.96; 多样性指数(H′)为0~2.23, 平均值为1.24; 舟山海域各站位出现的底栖动物种类数平均为3.34 种, 丰富度指数(d)平均为0.74, 多样性指数(H′)平均为1.00; 舟山邻近海域各站位出现的底栖动物种类数平均为6.40 种, 丰富度指数(d)平均为 1.26, 多样性指数(H′)平均为1.58。2020 年, 舟山及其邻近海域各站位出现的底栖动物种类数为1~11 种, 平均为6.17 种; 丰富度指数(d)为0~2.24, 平均值为1.45; 多样性指数(H′)为0~2.17,平均值为1.56; 舟山海域各站位出现的底栖动物种类数平均为5.00 种, 丰富度指数(d)平均为1.21, 多样性指数(H′)平均为1.35; 舟山邻近海域各站位出现的底栖动物种类数平均为7.80 种, 丰富度指数(d)平均为1.80, 多样性指数(H′)平均为1.85。总体来看, 2020 年舟山及邻近海域大型底栖动物的总物种数、丰富度指数和多样性指数高于2019 年, 且两年舟山海域大型底栖动物的总物种数、丰富度指数和多样性指数均高于舟山邻近海域。

表3 2019~2020 年舟山及邻近海域大型底栖动物的丰富度指数和多样性指数Tab.3 The richness index and diversity index of macrobenthos in Zhoushan and adjacent waters during 2019~2020
2.4 舟山及邻近海域大型底栖动物群落年际差异分析
等级Cluster 聚类(图2)结果表明, 舟山及邻近海域的大型底栖动物群落的相似性较低, 大型底栖动物群落仅可在17%左右的相似性水平上分成5 组, 显示出明显的年际差异, 2020 年站位除Z9 和Z11 站外,均聚到同一个组内; 不同站位的群落结构相似性不高, 聚类未能获得较好的结果。随后, 通过对各采样站位和各年份的底栖群落进行了SIMPER 分析, 结果也与以上结果相符, 群落的平均相似性只有9.80%。对两年大型底栖动物群落的SIMPER 单因子分析显示, 舟山及其邻近海域大型底栖动物不同年份的群落平均相似性维持在较低的水平, 2020 年平均相似性略高, 也仅19.97%, 2019 年平均相似性仅有11.23%。异足科索沙蚕和双唇索沙蚕是2019 年群落相似性的主要贡献者, 仅异足科索沙蚕的相似性贡献率即达37.79%, 两个物种的累积贡献率达55.14%; 而纽虫则为2020 年群落相似性的最重要贡献者, 其单种的群落相似性贡献率即达64.39%。两年间的群落不相似性高达95.52%。大型底栖动物群落间的显著的年际变化也有PcoA 分析(图3)中得到进一步直观展示,后续的ANOSIM 验证结果显示statisticR=0.459,Significance=0.001<0.01, 处于差异极显著水平。同时对两年的物种数、丰度、生物量、丰富度指数和多样性指数做Kruskal-Wallis 检验, 结果显示: 仅丰富度指数存在显著性差异(P<0.05), 物种数、丰度、生物量和多样性指数不存在显著性差异(P>0.05)。

图2 2019~2020 年舟山及其邻近海域大型底栖动物群落的聚类分析Fig.2 Cluster analysis of macrobenthic community in Zhoushan Islands and adjacent waters during 2019~2020

图3 舟山海域大型底栖动物群落PCoA 主坐标分析图Fig.3 PCoA results of macrobenthic community in Zhoushan Island and the adjacent
2.5 舟山及邻近海域大型底栖动物群落与环境因子的关系
2019~2020 年舟山海域大型底栖动物群落与环境因子的斯皮尔曼等级相关矩阵(图4)显示, 大型底栖动物群落受水深、温度、盐度、溶解氧和硝酸氮等环境因子的影响较大, 包括物种数、丰度、丰富度(Margalef 物种丰富度指数)和多样性(Shannon-Wiener多样性指数), 但生物量受环境因子的影响较小。在显著影响舟山海域大型底栖动物群落的4 个因子中, 群落参数与水深、盐度呈现较高的正相关性, 而与温度和硝酸氮呈现较高的负相关性。经过进一步的显著性验证, 群落丰度与水深存在显著的正相关性(P<0.05);物种数和丰度均与盐度存在显著的正相关性(P<0.05);而物种数和物种丰富度均与硝酸氮存在显著的负相关性(P<0.05)。
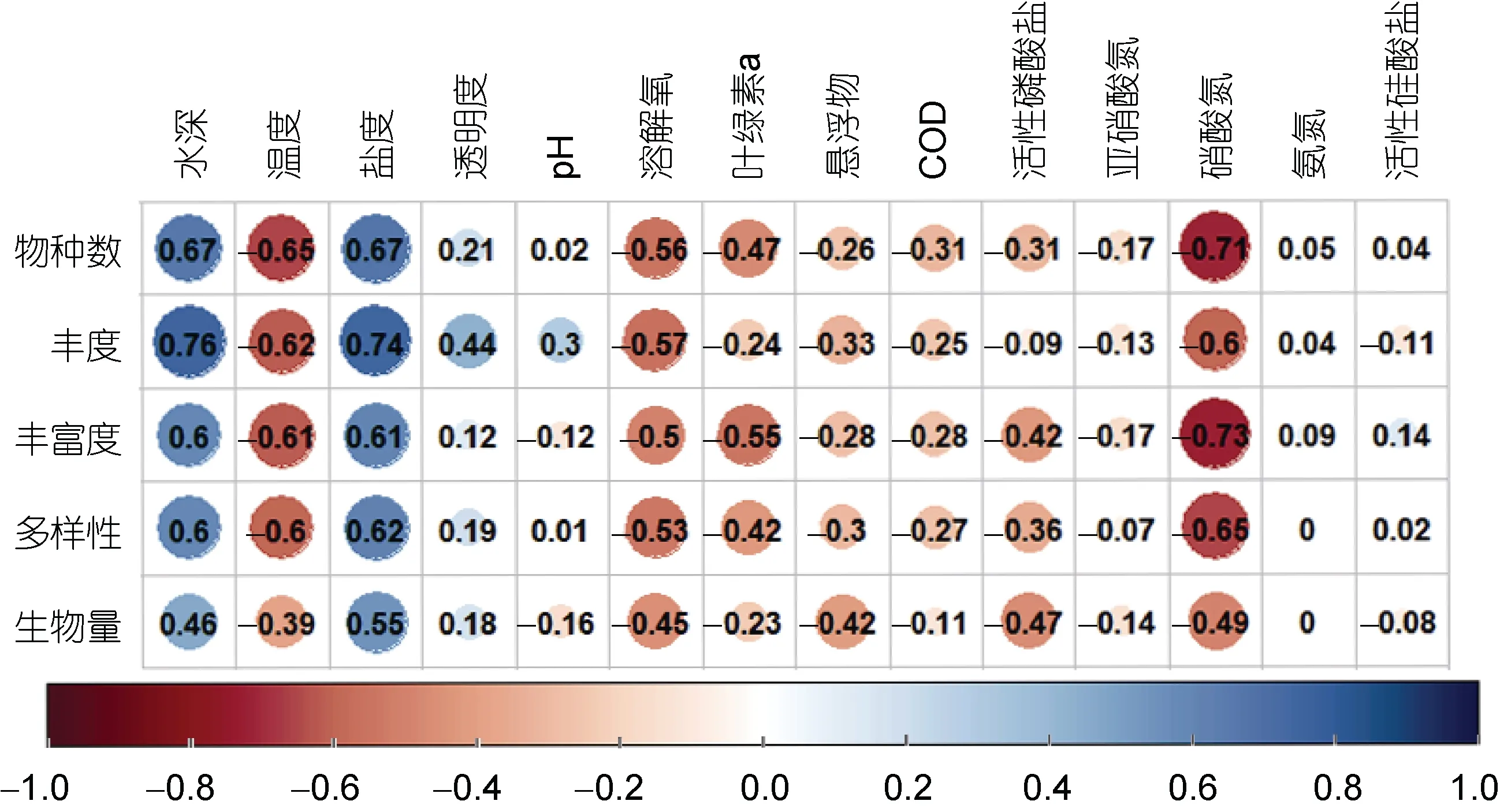
图4 2019~2020 年舟山海域大型底栖动物群落与环境因子的斯皮尔曼等级相关矩阵Fig.4 The Spearman rank correlation matrix between macrobenthic community parameters and environmental factors during 2019~2020 in Zhoushan and adjacent waters
同时, 使用SPSS 软件对水深、温度、盐度和硝酸氮做皮尔逊双变量相关分析, 结果(表4)显示, 盐度与水深呈显著正相关, 盐度和硝酸氮呈显著负相关, 硝酸氮和水深呈显著负相关。

表4 重要环境因子之间的皮尔逊双变量相关性分析Tab.4 The Pearson bivariate correlation coefficient between pairs of important environmental factors
3.1 舟山海域大型底栖动物的群落组成和优势种
经过两年的调查, 本研究在舟山及邻近海域的12 个站位共发现大型底栖动物56 种, 多毛类动物、甲壳动物和软体动物是主要成分, 这种群落组成结构与前人研究结果相似(王晓波等, 2016)。其中多毛类动物共28 种, 占总种数的50.00%, 甲壳动物共8种, 占总种数的14.29%, 软体动物共7 种, 占总种数的 12.50%, 这说明舟山及附近海域营养物质丰富,有利于多毛类动物的生存(徐兆东等, 2015)。
在2019~2020 年的研究中, 通过采泥器进行样品采样, 捕获了部分大型底上动物, 如脊索动物中的孔虎鱼, 甲壳动物中的日本鼓虾、无刺口虾蛄、拉氏爱琴虾、直额 蟳等, 它们均具备一定的游泳能力和垂直移动能力。这些物种在舟山海域广泛分布, 例如拉氏爱琴虾在底栖生物拖网时常可采到, 有很大的经济价值(韩庆喜, 2009; 张洪亮等, 2012); 日本鼓虾生活于浅海沙底, 分布极广, 常捕获于定置张网和拖虾网中(刘瑞玉, 1955; 宋海棠等, 2006); 无刺口虾蛄也是舟山海域的优势虾蛄种类, 资源量大, 数量分散分布(俞存根等, 2011)。
直额 蟳(宋海棠等, 2006)和孔虎鱼(胡颢琰等, 2009)亦是该海域的常见种, 具有一定的经济价值。
大型底栖动物优势种在群落结构中占据重要地位, 对群落结构和群落环境的形成具有明显的控制作用(Santoset al, 1983; Ruiz-Navarroet al, 2019), 是底栖生态系统物质循环和能量流动中主要的消费者和转移者, 其变化能够准确地反映所处环境长期、宏观变化(Fukumoriet al, 2008), 其长期演变研究可为海洋生物多样性及生态动力学研究提供重要的科学依据(彭松耀等, 2017)。
与舟山海域以往的历史研究相类似, 多毛类动物仍然占据着大型底栖动物群落的绝对优势, 相对重要性指数排名前10 的优势种中有多毛类动物6 种,不倒翁虫为绝对的优势种; 与此同时, 生物量占比较高的物种也被列入优势种, 如星虫爱氏海葵、沟纹拟盲蟹以及棘刺锚参等大个体生物。底质对多毛类的分布有重要作用(王金宝等, 2006)。不倒翁虫也被称为泥 鸮(mud owls) (Joseet al, 2014), 是一种很常见的广温广盐性种类, 从浅滩到深海均有分布, 为底泥有机物摄食者(严润玄等, 2020), 对较细的底质环境具有一定的偏好(Jumarset al, 2015), 对生活海域中盐度和混浊度有很强的忍耐能力, 当然这与其生活于底质当中, 而底质中盐度和浑浊度的改变程度比水体中盐度和浑浊度的改变要小得多有关(Townsendet al,2006)。不倒翁虫对环境的很强的适应能力使得它成为舟山附近海域的优势种, 如舟山西南金塘岛附近海域(杨磊等, 2017)以及舟山北部岱山海域(章飞军等,2017), 说明舟山附近海域底泥富含有机物质。除此之外, 在渤海湾近岸(王瑜等, 2010)、莱州湾(周红等,2010)、烟台四十里湾(杨陆飞等, 2019)、胶州湾(王金宝等, 2006)、北黄海(曲方圆等, 2009)、苏北浅滩(范士亮等, 2010)、长江口(李宝泉等, 2007; 刘录三等,2008)、杭州湾(寿鹿等, 2012)、象山港(王金辉等, 2006;廖一波等, 2014)、乐清湾(王航俊等, 2020)、闽北(程宏等, 2018)、洞头(贾胜华等, 2016)等海域也为优势种。
3.2 舟山海域大型底栖动物群落丰度、生物量、丰富度指数和多样性指数
在122°30′~123°30′E 的舟山海域, 为长江冲淡水与外海海水的交汇区, 此处已经基本远离长江入海泥沙沉降区, 底质稳定, 海水盐度较近岸水域高, 兼之台湾暖流入侵带来的大量磷盐(Fanet al, 2014), 底栖生物种类呈现复杂化, 生物量、栖息密度以及生物多样性指数较高(刘录三等, 2008), 并且总体上呈现一种自长江入海口向舟山东部外海逐渐递增的趋势(刘勇等, 2008), 并在124°E 附近物种多样性达到最高(李宝泉等, 2007), 舟山海域大型底栖生物的生物量、丰度和多样性指数也呈现由近岸向外海递增的趋势(贾海波等, 2011)。
参考近舟山海域近三十年来大型底栖动物的研究报道(表5), 在2019~2020 年的研究中舟山海域大型底栖动物群落的物种数量(56 种)和群落丰度(36.32 ind./m2)与过去的研究报道差别不大。2019~2020 年采集到的56 种大型底栖动物, 仅少于1988 年的102 种、2009 年4 月的84 种以及1996~2005 年的69 种, 但是,1988 年、2009 年和1996~2005 年三次调查研究均使用了阿氏拖网和采泥器两种采样方式, 包含了大量的大型底上动物(胡颢琰等, 2009; 贾海波等, 2011),物种数量在1988~1989 年达到最高, 但该研究为3 个季节的采样数据。贾海波等(2011)年在舟山外海采集到的大量多毛类(190.8 ind./m2), 使其丰度远高于其他数据。在舟山海域的大型底栖动物群落研究中, 多毛类动物通常会占据群落的绝对优势, 主要优势种为不倒翁虫等, 且群落的斑块或镶嵌状分布格局相当明显, 这与大型底栖动物分布深受底质状况影响, 与底质微生境中的不规则斑块分布密不可分(Snelgroveet al, 1994)。舟山海域的群落生物量在1996~2009 年间基本稳定在12 g/m2左右, 而在2019~2020 年间仅5.59 g/m2, 处于近三十年的较低水平, 其原因首先可能是优势种多为多毛类动物, 个体较小, 其次本研究采集的泥样用1.0 mm 和0.5 mm 孔径的套筛冲洗, 从而导致生物量低, 最后可能与近年来频繁的人为扰动有关。舟山海域水产养殖和轮渡运输等活动频繁,可能会对底栖动物造成影响。1988~1989 年以及2015年5~10 月在舟山港以及金塘岛的生态调查, 其获得的大型底栖动物群落生物量处于更低的水平, 最低生物量仅0.142 g/m2(杨磊等, 2017)。该海域地处杭州湾与南部象山港的通道位置, 是著名的镇海—舟山水道, 是太平洋潮波进入杭州湾的四条水道之一, 具有最大的落潮流, 受杭州湾高悬浮沙含量以及反复沉积再悬浮(大冲大淤)的影响(中国海湾志编纂委员会,1992), 并受海水表底层盐度明显分层等影响, 大型底栖动物在此生存困难(Menget al, 2021), 因而物种数量少、丰度和生物量较之2019~2020 年的研究更低。

表5 近三十年舟山海域大型底栖动物物种数量、丰度、生物量和优势种的变迁Tab.5 The shifts of species number, abundance, biomass, and dominant species reported from Zhoushan area in the past three decades
2019~2020 年的研究区域为122°00′~123°30′E,未到124°E。2020 年舟山及邻近海域大型底栖动物的总物种数、丰富度指数和多样性指数高于2019 年, 且两年舟山海域大型底栖动物的总物种数、丰富度指数和多样性指数均高于舟山邻近海域。从丰富度指数和多样性指数来看, 本研究也呈现一种自长江入海口向舟山东部外海逐渐递增的趋势。蔡立哲等(2002)在研究海洋底栖动物种类多样性指数污染程度评价标准时指出, 一般来说,H′值小于1, 重污染;H′值在1~2 之间, 中等污染;H′值在2~3 之间, 轻度污染;H′值大于3, 清洁。依此标准, 2020 年的舟山及邻近海域的污染程度低于2019 年, 且两年的舟山邻近海域的污染程度低于舟山海域, 但该海域仍处于中等污染状态。与历史调查结果相比较, 2016 年舟山近海海域底栖动物多样性指数平均值为 1.05 (蔡丽萍等,2018), 2019 年多样性指数平均值为1.24, 2020 年多样性指数平均值为1.56, 可以看出, 多样性指数逐步上升, 绿水青山就是金山银山的呼吁已在舟山海域初具成效, 但仍需长期坚持保护环境的政策。
3.3 舟山海域大型底栖动物群落的主要影响因子
大型底栖动物对海洋环境变化比较敏感, 水质和生态环境等的变化会导致底栖动物群落结构及其习性发生变化(其木乐等, 2020)。根据舟山及邻近海域大型底栖动物群落年际差异分析可以得知, 两年的大型底栖动物群落相似性较低存在显著的年际变化且两年丰富度指数存在显著性差异, 这种年际变化差异极有可能是环境因子变化造成的。在舟山海域,影响大型底栖动物群落组成和结构的最重要的环境因子包括水深、底层水盐度和硝态氮(NO3), 但这3个参数并非孤立的环境参数, 三者之间的联系异常紧密, SPSS 的皮尔逊双变量相关分析(表 4)结果显示,盐度与水深的相关性高达0.78, 盐度与硝酸氮的相关性高达-0.60, 而水深与硝酸氮的相关性高达–0.81。
尽管舟山海域远离长江口达上百公里, 但长江和钱塘江等河流带来的大量冲淡水对舟山海域的影响仍十分深远, 长江冲淡水与外海海水在此交汇, 如较靠近杭州湾的Z5 站, 水深18 m, 表层盐度只有15.27, 而底层盐度为21.53; 邻近的Z3, 水深28 m,表层盐度和底层盐度分别为23.89 和34.23, 表层和底层的盐度差异非常显著。部分大型底栖动物可容忍大幅度的盐度变化(盐度5~55) (De Villierset al, 1999),因此大型底栖动物的丰度、物种丰富度等不随盐度的改变而改变(Teskeet al, 2001)。但在2019~2020 年的研究中发现, 舟山海域大型底栖动物的物种数量、丰度、丰富度和多样性等与盐度具有显著的正相关关系(P<0.05), 即随着盐度的上升, 大型底栖动物的群落物种数量、丰度和丰富度随之上升。在河口海域, 盐度往往是决定底栖生物群落分布的重要因子(Ysebaertet al, 2002), 其对河口底栖动物分布(Hollandet al, 1987; Gastonet al, 1998; Ysebaertet al,2002; Teskeet al, 2003; Chainhoet al, 2006)和群落结构具有决定性作用(Rakocinskiet al, 1997)。盐度梯度作为生物的生理屏障, 对狭盐性物种的分布进行胁迫限制, 包括底栖动物、鱼类和浮游动物(Teskeet al,2003)。盐度可通过扰动底质的稳定性, 进而对大型底栖动物群落产生扰动(Van Diggelenet al, 2016)。通常,大型底栖动物的物种丰富度、丰度和多样性会随盐度的升高而增加, 但底内食碎屑动物的比例会随盐度增高而降低(Gastonet al, 1998; Weslawski, 1999;Udalovet al, 2004)。
20 世纪以来的富营养化均与过量的氮磷营养盐输入有关(Rabalaiset al, 2009)。2019~2020 年的研究中发现舟山海域大型底栖动物物种数和物种丰富度与硝酸氮呈显著的负相关关系, 即随着硝酸氮含量的上升, 大型底栖动物的群落物种数量和物种丰富度随之下降。舟山海域受邻近杭州湾和象山港的影响,无机氮和活性磷酸盐超标严重, 氮磷含量的升高将直接导致水体富营养化, 湾内海水为劣四类水质, 呈重度富营养化状态(中华人民共和国生态环境部,2021)。在富营养化水环境中, 大型底栖动物受到NH4+和NO2–等无机氮化合物的直接毒性效应(Camargoet al, 2006), 对海洋大型底栖动物的生长速率、生殖和代谢产生影响(Jessenet al, 2015)。持续的富营养化扰动的存在, 减弱了大型底栖动物的运动能力、摄食效率和生物扰动活性(Briggset al, 2015), 降低了底栖动物的物种丰富度、丰度和现存生物量(Kodamaet al, 2011), 触发大型底栖动物群落组成由多样性和异质性较高、营养级较复杂的双壳类、多毛类和甲壳动物转向大量耐受性较强、生命寿限较短的食底泥者机会种(Tomašovýchet al, 2018), 其现存生物量也将大幅降低(Kempet al, 2005); 而以小型多毛类为主的群体, 由于粒径大小或消化功能问题不易被游泳动物摄食(Jumarset al, 2015), 从而引发游泳动物群落组成和结构的改变(Petersonet al, 2000)。长此以往, 碳传递限制导致的生物量降低将会引发整个底栖食物网的巨大破坏和经济渔业的变迁(Norkkoet al, 2010)。
此外, 本文研究得出大型底栖动物生物量受环境因子的影响较小, 此研究结果与纪莹璐等(2021)在青岛董家口研究结果相似, 即大型底栖动物生物量与各环境因子均无显著相关, 但也有的研究得出的结论差异较大, 即大型底栖动物生物量与有机质质量分数、粉砂和黏土质量分数等显著相关(田胜艳等,2020)。影响大型底栖动物的环境因子众多, 除本文采集到的环境因子外, 沉积物的粒径、泥砂黏土含量、有机质含量等因素也能对底栖动物群落产生影响,应在今后对舟山海域的研究中增加这些因素的测定及研究, 探究舟山海域底栖环境的变化, 更加合理地利用该海域。
(1) 2019~2020 年在舟山及邻近海域共采集到大型底栖动物56 种, 其中包含部分大型底上动物, 如舟山海域的优势或常见底上动物无刺口虾蛄、直额蟳和孔 鰕虎鱼等。依相对重要性指数来看, 2019 年最高的是异足科索沙蚕和星虫爱氏海葵, 而在2020 年则为纽虫和沟纹拟盲蟹。
(2) 舟山海域大型底栖动物群落的物种数量和群落丰度与过去30 年差别不大, 且多毛类动物占据群落的绝对优势, 主要优势种为不倒翁虫等; 但群落生物量处于近三十年的较低水平。2020 年舟山及邻近海域大型底栖动物的总物种数、丰富度指数和多样性指数高于2019 年, 且两年舟山海域大型底栖动物的总物种数、丰富度指数和多样性指数均高于舟山邻近海域。
(3) 在舟山附近海域, 水深、底层水盐度和硝态氮(NO3)是形成并构建大型底栖动物群落组成和结构的最重要的环境因子。其中, 盐度和水深与大型底栖动物的物种数量、丰度、丰富度和多样性等均具有显著的正相关关系, 而硝态氮(NO3)与物种数和物种丰富度呈显著的负相关关系。
猜你喜欢 盐度站位生物量 提高政治站位 对标国内一流今日农业(2021年8期)2021-11-28建党百年说“站位”水上消防(2021年3期)2021-08-21轮牧能有效促进高寒草地生物量和稳定性今日农业(2020年19期)2020-12-14提升站位讲政治 创新担当争出彩人大建设(2019年5期)2019-10-08提高政治站位 勇于担当作为 以从严要求开创人大工作新局面人大建设(2019年3期)2019-07-13生物量高的富锌酵母的开发应用中国科技信息(2015年2期)2015-11-16千里岩附近海域盐度变化趋势性研究中国新技术新产品(2015年3期)2015-07-19适用于高盐度和致密岩层驱油的表面活性剂中国洗涤用品工业(2015年5期)2015-02-28盐度调节的简易计算方法河北渔业(2014年3期)2014-07-08基于SPOT-5遥感影像估算玉米成熟期地上生物量及其碳氮累积量植物营养与肥料学报(2014年1期)2014-03-11








