维药黑桑中1个新的桑根酮型二氢黄酮化合物及其胰岛素增敏活性
时间:2023-06-15 15:00:19 来源:雅意学习网 本文已影响 人 
贾 安,王玲玲,靳建杰,黄春跃,胡 晓, *
维药黑桑中1个新的桑根酮型二氢黄酮化合物及其胰岛素增敏活性
贾 安1,王玲玲2,靳建杰2,黄春跃2,胡 晓1, 2*
1. 黄河科技学院医学院,河南 郑州 450063 2. 中国医药工业研究总院上海医药工业研究院有限公司,创新药物与制药工艺国家重点实验室,上海 201203
研究黑桑茎枝中桑根酮型二氢黄酮化合物及其胰岛素增敏活性。应用多种色谱技术并结合桑根酮型化合物的紫外吸收特征,对桑根酮型化合物进行分离纯化,结合波谱技术及理化性质进行结构鉴定;
采用地塞米松诱导胰岛素抵抗3T3-L1脂肪细胞模型,采用GOD-POD法和ELISA法来检测细胞上清液中葡萄糖和脂联素的含量,考察化合物的体外胰岛素增敏活性;
通过LanthaScreen™ TR-FRET 过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)竞争性结合检测试剂盒检测分离得到的化合物与PPARγ的结合能力。从黑桑茎枝90%乙醇提取部位中分离得到1个新的桑根酮型化合物,并鉴定其结构为(5a,10a)-1,3,8,10a-四羟基-4-(2-羟基-3-甲基- 3-丁烯-1-基)-5a-(3-甲基-2-丁烯-1-基)-5a,10a-二氢-11-苯并呋喃[3,2-b]色原酮-11-酮,命名为黑桑根酮O(nigragenon O),该化合物在10、30 μmol/L能促进胰岛素抵抗模型细胞对葡萄糖的摄取和对脂联素的分泌;
对PPARγ受体具有较强的结合活性,半数抑制浓度(half maximal inhibitory concentration,IC50)为5.1 μmol/L。黑桑根酮O为新化合物,具有明显的体外胰岛素增敏活性,是PPARγ潜在配体。
桑科;
黑桑;
桑根酮型二氢黄酮;
黑桑根酮O;
胰岛素增敏;
过氧化物酶体增殖物激活受体γ
黑桑Linn.为桑科(Moraceae)桑属Linn.落叶乔木植物。桑属为桑科中重要的属,该属植物有16种,我国主产11种,资源丰富,在全国各地均有分布。常见的桑属植物有桑Linn.、黑桑、鸡桑Poir.和蒙桑(Bur.) Schneid等。具有重要的药用价值,如桑的根皮、枝、叶和果实均作为传统中药用于临床[1]。黑桑俗称药桑,为维吾尔族传统民间用药,具有生干生寒、燥湿清热的作用[2]。现代研究表明,黑桑中化学成分丰富多样,富含黄酮类、二苯乙烯、生物碱类和多酚类成分[2-3];
具有调血脂、降血糖、抗衰老、美白和抗炎镇痛等多种药理作用[4-6]]。
桑根酮型黄酮(sanggenon-type flavanones,STFs)是桑属植物特有的二氢黄酮醇类化合物,具2-异戊烯基-3-羟基取代、C环3位和B环2′位通过醚键形成呋喃环,3位的羟基和醚键构成一个独特的半缩酮结构[7]。本课题组前期从黑桑中得到多个结构新颖的STFs,该类化合物具有明显的α-葡萄糖苷酶抑制活性[8-9]和过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)激动活性[10],具有潜在的降糖功效。本研究旨在对黑桑中的STFs进行定向分离富集和结构鉴定,并进行体外胰岛素增敏活性研究。得到1个新的桑根酮型二氢黄酮醇,命名为黑桑根酮O(nigragenon O),见图1。体外胰岛素增敏活性考察结果显示,该化合物10、30 μmol/L能促进胰岛素抵抗模型细胞对葡萄糖的摄取,增加模型细胞对脂联素的分泌,表现出明显的体外胰岛素增敏活性;
对PPARγ受体显示出较好的亲和力,半数抑制浓度(half maximal inhibitory concentration,IC50)为5.10 μmol/L,结合常数(i)为2.46 μmol/L。
1.1 仪器设备
Rudolph AUTOPOL VI型旋光仪(美国鲁道夫公司);
UV-2500PC型紫外-可见分光光度计(日本岛津);
JASCO J-810型圆二色光谱仪、JASCO-810旋光分光计(日本JASCO公司);
Nicolet iS5型FT-IR红外光谱仪、Waters Xevo G2-XS Q-TOF质谱仪、3111型CO2培养箱(美国赛默飞公司);
Bruker AV III 400 MHz型核磁共振仪(德国Bruker公司);
LC3050N型制备液相(北京创新通恒公司);
BioTek Epoch酶标仪(美国伯腾公司);
Envision酶标仪(美国PerkinElmer公司);
CX23型显微镜(日本奥林巴斯公司);
YJ-840/YJ-1340型超净工作台(苏州苏信环境科技有限公司);
Echo 555液体处理系统(。

图1 黑桑根酮O的化学结构
1.2 试剂与材料
柱色谱正相硅胶(200~300目,青岛海洋化工有限公司);
柱色谱正相硅胶(100~200目,上海上邦实业有限公司);
柱色谱反相硅胶ODS-C18(s-50 μm,日本YMC公司);
大孔树脂AB-8(上海摩速科学器材有限公司);
Sephadex LH-20(50~80 μm,瑞典GE Healthcare Bio-Science AB);
小鼠前脂肪3T3-L1细胞,来源于中科院细胞库;
DMEM(批号C11995500CP)、胎牛血清(批号2110875CP)、PBS(pH 7.4,批号10010-500BT)、Trypsin-EDTA(0.25%,批号25200-056)购自Gibco公司;
10% FBS(批号10099)、胰岛素(批号12585-014)、1X 抗生素-抗真菌素(批号15240-112)购自Lifetechnologies公司;
IBMX(批号I7018)、地塞米松(批号D4902)购自美国Sigma公司;
Cell Titer Glo试剂(CTG,批号G7572)购自美国Promega公司;
葡萄糖测试盒(批号F006-1-1)购自南京建成生物工程研究所;
小鼠脂联素测定试剂盒(批号PA002)、BCA检测试剂盒(批号P0012S)购自上海碧云天生物技术有限公司;
LanthaScreen™ TR-FRET PPARγ竞争性结合检测试剂盒(批号PV4894)、DTT(批号P2325)购自美国Invitrogen公司;
罗格列酮(批号100673-201902,质量分数≥98%)购自中国食品药品检定研究院。
黑桑茎枝于2019年8月采自新疆维吾尔自治区和田县,经中国医药工业研究总院中药研究部吴彤研究员鉴定为桑科桑属植物黑桑Linn.的茎枝,标本(HS190930001)存放于中国医药工业研究总院中药研究部标本室。
2 提取与分离
取干燥黑桑茎枝22 kg,粉碎后采用90%乙醇加热回流提取2次,每次1 h,合并提取液浓缩得到浸膏1.7 kg。量取AB-8大孔吸附树脂约1.2 kg装柱,将部分提取物浸膏(1.2 kg)用水混悬上柱,依次用2倍柱体积的水、5倍柱体积40%乙醇和5倍柱体积95%乙醇洗脱,减压浓缩干燥分别得到水部位(113.0 g)、40%乙醇部位(560.7 g)和95%乙醇部位(378.0 g)。取95%乙醇部位(250.0 g)经正相硅胶(100~200目)柱色谱,石油醚-醋酸乙酯(10∶1→7∶1→5∶1→2∶1→1∶1)梯度洗脱,得到6个组分Fr. A~F。根据桑根酮黄酮的紫外特征吸收(约300 nm处有最大吸收),对各部位进行HPLC-DAD跟踪分析,其中Fr. B~E富含桑根酮类成分。进一步与课题组已分离得到的桑根酮型化合物进行比对,发现Fr. D部位有未知的桑根酮型化合物。
组分Fr. D(3.3 g)经Sephadex LH-20凝胶柱色谱,二氯甲烷-甲醇(1∶1)洗脱分离后得到组分Fr. D-1~D-7。Fr. D-6(2.6 g)进一步经ODS柱色谱,甲醇-水(40∶60→90∶10)洗脱分离后得到Fr. D-6-1~D-6-15。Fr. D-6-9(101.6 mg)经过半制备HPLC(体积流量3 mL/min,乙腈-水63∶37)分离纯化得到化合物1(R=21.2 min,23.7 mg)。

1H-NMR谱给出以下的信号:黄酮类成分特征的C-5位成氢键羟基信号H11.70 (1H, brs, 5-OH);
1组ABX体系芳香质子信号H7.35 (1H, d,= 8.0 Hz, H-6), 6.50 (1H, dd,= 8.0, 2.0 Hz, H-5), 6.37 (1H, d,= 2.0 Hz, H-3);
1个单峰芳香质子信号H5.92 (1H, s, H-6);
1组3-甲基-2-丁烯基信号H5.35 (1H, brt,= 6.4 Hz, H-10), 3.10 (1H, dd,= 14.4, 8.0 Hz, H-9a), 2.76 (1H, dd,= 14.4, 7.6 Hz, H-9b), 1.60 (3H, brs, H-13), 1.59 (3H, brs, H-12);
1组2-羟基-3-甲基-3-丁烯基信号H4.84 (1H, brs, H-17a), 4.64 (1H, brs, H-17b), 4.30 (1H, dd,= 7.6, 3.6 Hz, H-15), 2.90 (1H, dd,= 14.4, 3.6 Hz, H-14a), 2.80 (1H, dd,= 14.4, 7.6 Hz, H-14b), 1.64 (3H, brs, H-18)。

表1 化合物1的氢谱和碳谱数据
13C-NMR谱显示25个碳信号,包括15个二氢黄酮骨架碳信号,其中C91.5 (C-2) 和C102.8 (C-3) 进一步证实化合物为桑根酮二氢黄酮类成分;
3-甲基-2-丁烯基的5个碳信号C136.5 (C-11), 118.6 (C-10), 32.1 (C-9), 25.9 (C-12), 18.1 (C-13);
以及2-羟基-3-甲基-3-丁烯基的5个碳信号C148.3 (C-16), 110.3 (C-17), 76.1 (C-15), 29.3 (C-14), 18.2 (C-18)。
利用HSQC谱确定连接氢的碳信号,H2-17(H4.84,H4.64)与C-17 (C110.3) 相关,进一步表明具有末端双键基团;
H2-9 (H3.10, 2.76) 与C-9 (C32.1) 相关,H2-14 (H2.90, 2.80) 与C-14 (C29.3)相关,确定了2个不同异戊烯基上亚甲基的碳氢信号。在HMBC谱中(图2),H2-9与C-2、C-10和C-11相关,H-9a与C-3有相关,确定3-甲基-2-丁烯基连接在C-2位;
H2-17与C-15、C-16和C-18相关,H2-14与C-15和C-16相关,证实了2-羟基- 3-甲基-3-丁烯基基团的连接方式,H2-14与C-8、C-8a和C-7相关,确定该基团连接在C-8位。进一步通过HMBC谱中H-6与C-7,C-5和C-4a相关,H-6与C-2和C-4相关,H-3与C-1相关,确定所有碳、氢原子的化学位移归属。该化合物的平面结构被确定。

图2 化合物1的关键HMBC相关
化合物的圆二色谱图谱中,在217、250、292、333 nm附近呈现正Cotton效应,在238和274 nm附近呈现负Cotton效应,见图3。根据桑根酮型二氢黄酮的圆二色谱规律[12],并通过文献对比[11],确定该化合物C-2位和C-3位的绝对构型分别是2,3。C-15位的绝对构型尝试用Mosher法确定未果,绝对构型待定。因此,化合物1确定为 (5a,10a)-1,3,8,10a-四羟基-4-(2-羟基-3-甲基-3-丁烯-1-基)-5a-(3-甲基-2-丁烯-1-基)-5a,10a-二氢-11-苯并呋喃[3,2-b]色原酮-11-酮,经文献及数据库检索确定为新化合物,命名为黑桑根酮O。

图3 化合物1的圆二色谱图
以地塞米松诱导分化成熟的3T3-L1脂肪细胞,建立胰岛素抵抗模型;
采用试剂盒检测培养细胞上清液中葡萄糖和脂联素含量,具体方法参考文献报道[13],并做了微调。
4.1 细胞培养
3T3-L1细胞常规培养于含10% FBS的DMEM培养液(含1X抗生素)。
4.2 诱导分化
取3T3-L1细胞,加入诱导培养液(含DEME、0.5 mmol/L IBMX、1 µmol/L地塞米松、2 µg/mL胰岛素和10% FBS),诱导48 h后,换成含胰岛素的培养液(含10 µg/mL的胰岛素和10% FBS的DMEM),继续培养48 h;
随后换含10% FBS的DMEM培养液,每48小时换液1次。超过90%的细胞可在8~10 d内分化成熟。
4.3 化合物1的细胞毒性初步考察
诱导分化成熟的3T3-L1细胞,经计数后以1×104个细胞/100 μL的规格接种于96孔培养板,每孔加入90 μL培养液(含血清)培养过夜,再加入10 μL化合物1溶液。培养48 h后,每孔加入CTG 100 μL,室温静置10 min,在酶标仪上测定各孔吸光度()值,从而计算化合物1不同浓度下的细胞活力。
4.4 胰岛素抵抗3T3-L1细胞的构建与实验分组
将诱导分化成熟的3T3-L1细胞随机分为对照组、胰岛素抵抗组、罗格列酮组(阳性对照)和给药组,对照组培养于含10% FBS的高糖DMEM培养液(含1%抗生素);
胰岛素抵抗组、罗格列酮组和给药组培养于含1 μmol/L地塞米松的高糖DMEM培养液(含10% FBS及1%抗生素),培养96 h;
然后,胰岛素抵抗组加入不同浓度药物,继续培养48 h,得到给药组;
以上所有组别在给药的同时再分为不加胰岛素和加胰岛素(1 nmol/L)处理。48 h后检测葡萄糖和脂联素含量。按照试剂盒说明书,采用葡萄糖氧化酶-过氧化物酶法检测上清液中葡萄糖含量;
ELISA法测定细胞中脂联素含量。
4.5 统计学分析

4.6 活性结果
前期研究表明,化合物1在30 μmol/L以下对细胞无明显毒性,细胞活力约为85%,因此本研究选择10、30 μmol/L对其细胞活力进行考察。如表2所示,当3T3-L1细胞发生胰岛素抵抗,无论基础状态还是胰岛素刺激状态,胰岛素抵抗组细胞液中葡萄糖含量均显著增加(<0.01),脂联素含量显著降低(<0.01)。阳性药罗格列酮各浓度均能显著促进胰岛素抵抗模型细胞对葡萄糖的摄取(<0.01),并促进脂联素的分泌(<0.05、0.01)。化合物1能显著降低细胞液中葡萄糖含量(<0.05、0.01);
且30 μmol/L可显著提高细胞液中脂联素含量(<0.05、0.01)。
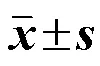
表2 化合物1对胰岛素抵抗3T3-L1细胞中葡萄糖吸收和脂联素含量的影响(, n = 3)
与对照组比较:##<0.01;
与模型组比较:*<0.05**<0.01
##< 0.001control group;*< 0.05**< 0.01model group
5.1 实验方法
根据LanthaScreen™ TR-FRET PPARγ竞争性结合检测试剂盒说明书进行实验。0.6 nmol/L PPARγ配体结合区(PPARγ-LBD)、0.21 nmol/L 铽标记的抗GST抗体(Tb-anti-GST Ab)、4 nmol/L 荧光小分子Pan-PPAR配体(Fluormone™ Pan-PPAR Green)与200 nL不同浓度的检测化合物溶液(1和罗格列酮)充分混合后,加入384孔荧光酶标板,总反应体系40 μL,孵育1 h。设相同体积DMSO作为高对照;
含1000 nmol/L GW1929作为低对照。
使用EnVision平板阅读器检测TR-FRET信号,检测各孔值(供体荧光495 nm,受体荧光520 nm),计算TR-FRET比值(Value,520/495)。按公式计算不同浓度化合物1的抑制率,并利用Graphpad Prism 5.0软件绘制剂量反应曲线计算IC50值。
抑制率=1-(Value化合物-Value低对照)/(Value高对照-Value低对照)
按以下公式计算结合常数(i)值。
i=IC50/(1+[tracer]/D)
[tracer] 为检测反应中最大TR-FRET值对应的供体浓度,本实验中设定为3 nmol/L,D为供体荧光的结合常数,本实验的D值为(2.8±0.8)nmol/L
5.2 实验结果
由图4所示,化合物1对PPARγ受体显示出较好的亲和力,IC50值为5.10 μmol/L,i为2.46 μmol/L;
阳性对照罗格列酮的IC50值和i分别为104.8 nmol/L和50.6 nmol/L。

图4 化合物1 (100 nmol·L−1~100 μmol·L−1) 和罗格列酮(12 nmol·L−1~10 μmol·L−1) 剂量反应曲线(n=3)
桑属植物具有重要药用价值,中医很早就用桑来治疗糖尿病,日本古书《吃茶养生记》也记载桑有改善“饮水病”(糖尿病)的作用。桑属植物富含生物碱糖类和酚类化合物,以1-脱氧野尻霉素为代表的生物碱糖类,作为强效α-葡萄糖苷酶抑制剂已被开发为抗糖尿病新药。酚性成分因其异戊烯基的取代和衍生化而具有结构新颖性和多样性,生物活性也活泼多样,近年来备受关注。黑桑是桑属药用植物的特色种,是国内唯一的22倍体品种,在维医用药中具有较长的历史。大量研究表明[14-16],黑桑提取物具有明确的降血糖活性和胰岛素增敏作用,但其活性物质基础相关研究不够充分。
PPARγ作为是一种配体激活的核受体转录因子,主要在脂肪组织表达,在脂肪细胞分化和糖脂代谢平衡环节发挥关键作用[17]。PPARγ与配体结合,激活PPARγ受体基因转录,进一步提高脂肪合成相关因子(C/EBPa、aP2、FAS等)的表达,从而促进脂肪细胞分化;
通过上调胰岛素增敏因子脂联素的表达,增加外周组织对葡萄糖的转运,从而改善胰岛素抵抗,进而发挥降糖作用。PPARγ是当前发现胰岛素增敏剂的重要靶标。
在课题组前期研究基础上,本研究从黑桑茎枝中分离鉴定了1个新的桑根酮型二氢黄酮醇,并通过地塞米松诱导胰岛素抵抗3T3-L1细胞模型,考察化合物1的胰岛素增敏活性。结果提示,该化合物表现出明显的体外胰岛素增敏活性,可促进胰岛素抵抗模型细胞对葡萄糖的摄取和对脂联素的分泌。同时,化合物1对PPARγ受体具有较强的结合活性,是PPARγ的潜在配体,其胰岛素增敏作用可能与其PPARγ结合活性有关。
利益冲突 所有作者均声明不存在利益冲突
[1] 宿树兰, 段金廒, 欧阳臻, 等. 我国桑属 (L.) 药用植物资源化学研究进展 [J]. 中国现代中药, 2012, 14(7): 1-6.
[2] 王磊. 黑桑化学成分及生物活性研究 [D]. 北京: 中国协和医科大学, 2008.
[3] 徐良金. 两种民族药用植物的化学成分和生物活性研究 [D]. 上海: 中国医药工业研究总院, 2018.
[4] 卢红, 丁天龙, 吴曙光, 等. 新疆药桑的药用价值及在维吾尔医药中的应用 [J]. 蚕业科学, 2011, 37(6): 1098-1101.
[5] 王贺, 刘健健, 杨俊玲, 等. 新疆药桑不同部位降血糖活性研究 [J]. 广州化工, 2014, 42(14): 76-78.
[6] Dalmagro A P, Camargo A, Zeni A L B.and its major phenolic, syringic acid, have antidepressant-like and neuroprotective effects in mice [J]., 2017, 32(6): 1963-1973.
[7] Fukai T, Pei Y H, Nomura T, Xu C Q,. Constituents of the moraceae plants. Part 29. Components of the root bark of. Part 2. Isoprenylated flavanones from[J]., 1997, 47(2): 273-280.
[8] Xu L J, Yu M H, Niu L X,. Phenolic compounds isolated fromand their α-glucosidase inhibitory activities [J]., 2020, 34(5): 605-612.
[9] Wang L L, Xu L J, Ma M J,. Phenolic constituents from the stems ofand their α-glucosidase inhibitory activities [J]., 2021, 3(1): e8-e12.
[10] Xu L J. Isoprenylated flavonoids fromand their PPAR γ agonistic activities [J]., 2018, 127: 109-114.
[11] Hu X, Wu J W, Zhang X D,. Isoprenylated flavonoids and adipogenesis-promoting constituents from[J]., 2011, 74(4): 816-824.
[12] Nomura T, Shi Y Q, Fukai T,. Absolute structures of 3-hydroxy-2-prenylflavanones with an ether linkage between the 2′- and 3-positions from moraceous plants [J]., 2001, 55(1): 13.
[13] 王小康, 刘清霞, 叶开和, 等. 3"-羟基葛根素对脂肪细胞3T3-L1胰岛素抵抗的影响及其机制研究 [J]. 中草药, 2014, 45(16): 2352-2357.
[14] 庞宗然, 裴凌鹏. 药桑不同提取物对2型糖尿病大鼠的治疗作用 [J]. 中国老年学杂志, 2009, 29(21): 2733-2735.
[15] Araujo C M, Lúcio K D, Silva M E,.leaf extract improves glycemic response and redox profile in the liver of diabetic rats [J]., 2015, 6(11): 3490-3499.
[16] Song H Z, Lai J, Tang Q,. Mulberry ethanol extract attenuates hepatic steatosis and insulin resistance in high-fat diet-fed mice [J]., 2016, 36(7): 710-718.
[17] Berger J, Moller D E. The mechanisms of action of PPARs [J]., 2002, 53: 409-435.
A new sanggenon-type flavanone fromand its insulin-sensitizing activity
JIA An1, WANG Ling-ling2, JIN Jian-jie2, HUANG Chun-yue2, HU Xiao1, 2
1. Medical School, Huanghe Science & Technology College, Zhengzhou 450063, China 2. State Key Laboratory of New Drug and Pharmaceutical Process, Shanghai Institute of Pharmaceutical Industry, China State Institute of Pharmaceutical Industry, Shanghai 201203, China
To investigate sanggenon-type flavanones (STFs) from the stems ofand the insulin sensitizing activity.Guided by the UV absorbtion characteristics of STFs, the compound was isolated and purified by a combination of various column chromatographic methods. The structure was elucidated through extensive analysis of HRMS, NMR, UV, IR, CD data and so on. The insulin-sensitizing activities of the compounds were investigated using insulin-resistant 3T3-L1 adipocytes model induced by dexamethasone. The concentration of glucose and adiponectin in the culture supernatant was determined by GOD-POD assay and ELSA method, respectively. The competitive binding affinity toward PPARγ was evaluated using the LanthaScreenTMTR-FRET assay.A new STF (1) was obtained and identified, named as nigragenon O. Compound 1 decreased the glucose level and promoted adiponectin secretion in the model cells at the concentrations of 30 μmol/L and 10 μmol/L. It also exhibited potent binding affinity for PPARγ with an IC50value of 5.1 μmol/L.Compound 1 showed obviousinsulin-sensitizing effect and displayed potent binding affinity for PPARγ, indicating its potential as a natural insulin-sensitizing agent.
Moraceae;L.; sanggenon-type flavanones; nigragenon O; insulin-sensitizing activity; peroxisome proliferator-activated receptor γ
R284.1
A
0253 - 2670(2023)01 - 0045 - 06
10.7501/j.issn.0253-2670.2023.01.007
2022-08-02
国家自然科学基金资助项目(32270421);
国家自然科学基金资助项目(81402824);
上海市自然科学基金资助项目(19ZR1454400);
上海市自然科学基金资助项目(21ZR1461800)
贾 安,副教授,从事中药药效物质基础及其作用机制研究。E-mail: 869955076@qq.com
通信作者:胡 晓,研究员,博士生导师,从事天然先导化合物发现与中药药效物质基础研究。E-mail: xjtuyxhx@126.com
[责任编辑 王文倩]
猜你喜欢 脂联素抵抗批号 一种JTIDS 信号批号的离线合批方法航天电子对抗(2022年4期)2022-10-24锻炼肌肉或有助于抵抗慢性炎症中老年保健(2021年5期)2021-08-24做好防护 抵抗新冠病毒小雪花·成长指南(2021年2期)2021-05-20iNOS调节Rab8参与肥胖诱导的胰岛素抵抗天津医科大学学报(2019年3期)2019-08-13水初中生世界·九年级(2019年4期)2019-05-05医学科技期刊中药品生产批号标注探析中国科技纵横(2018年2期)2018-11-29中药材批号划分与质量管理中成药(2018年7期)2018-08-04自噬与脂联素诱导的人乳腺癌MCF-7细胞凋亡的关系安徽医科大学学报(2015年9期)2015-12-16脂联素及高敏C反应蛋白与急性脑梗死预后的相关性研究医学研究杂志(2015年6期)2015-07-01脂联素、瘦素与2型糖尿病患者轻度认知功能障碍的关系郑州大学学报(医学版)(2015年2期)2015-02-27







