4种三唑类杀菌剂对香蕉枯萎病菌的抑制效果及其差异性
时间:2023-06-13 11:40:10 来源:雅意学习网 本文已影响 人 
项丹丹,杨晓芳,易干军,陶海青,初元琦,李春雨
(广东省农业科学院果树研究所,农业农村部南亚热带果树生物学与遗传资源利用重点实验室/广东省热带亚热带果树研究重点实验室,广州 510640)
香蕉作为世界贸易量最大的水果,也是世界十大主食之一。香蕉产业是我国热带亚热带地区农业支柱产业之一,该产业为我国国民经济的增长作出了重要贡献。然而,香蕉枯萎病(Fusarium wilt of banana)在我国广东、广西等香蕉主产区的蔓延,严重制约着我国香蕉产业的健康持续发展。香蕉枯萎病是一种由尖孢镰刀菌古巴专化型(Fusarium oxysporumf.sp.cubense,Foc)侵染引起维管束坏死的毁灭性土传真菌病害。Foc遗传多样性丰富,根据致病香蕉品种的类型,可分为4个生理小种,其中危害性最大的是香蕉枯萎病菌热带4 号生理小种(Foctropical race 4,FocTR4),能侵染几乎所有香蕉栽培品种[1]。近年来,由于FocTR4引起的枯萎病发展态势严峻,我国香蕉产业收获面积逐年下降[2]。2019 年,FocTR4 在哥伦比亚以及加勒比海地区的首次检出预示着这种病害已成为全球香蕉产业的最大威胁[3]。
香蕉枯萎病的防治是世界性难题,目前主要采用培育抗性品种、生物防治、化学防治等手段进行综合防控[3]。抗(耐)病品种的推广正在香蕉枯萎病的防治中发挥关键作用,但近年来病原菌生理小种的多样化加速了品种抗病性的丧失。生物防治发挥作用需要的时间较长、过程较为复杂,在病害防控中仍处于研发阶段。化学杀菌剂具有高效、速效、使用方便、经济效益高等优点,在病虫害综合防治中占有重要地位。国内外学者开展了多种杀菌剂对Foc作用的试验,如NEL等[4]表明1 μg/mL咪鲜胺可显著抑制Foc菌丝生长;
许文耀等[5]发现霉灵·溴菌腈对Foc孢子萌发有良好的抑制效果;
除此之外,许多报道表明咪鲜胺及其混配剂对Foc有良好的抑菌活性[6-8]。但在田间环境下,室内试验筛选的药剂往往不能表现出相同的抑菌效果,难以在生产中得到应用与推广[9]。因此,到目前为止还没找到一种防治香蕉枯萎病的理想杀菌剂[10]。原因也在于香蕉枯萎病是一种维管束类型的病害,病菌以不同形式存在于土壤中,农药施用于土壤后难以接触到病菌。深入开展防治香蕉枯萎病化学药剂的研究,筛选开发有效的药剂,是香蕉枯萎病综合防治体系中必须攻克的瓶颈。
三唑类杀菌剂具有优良的保护、治疗作用,其内吸性强,作用的病原菌产生抗药性的风险低,持效期长,对环境与使用者安全,因此在杀菌剂领域占有重要地位。目前三唑类杀菌剂品种已有四十几种,占市场上杀菌剂的1/3[11]。且丙环唑、戊唑醇、腈菌唑、丙硫菌唑等三唑类杀菌剂被陆续研发出来。三唑类杀菌剂属于甾醇脱甲基抑制剂(sterol demethylation inhibitor,DMI)类杀菌剂,主要通过抑制甾醇生物合成中细胞色素P450 甾醇14α-脱甲基酶(cytochrome P450 sterol 14α-demethylase,CYP51)的活性来破坏病原菌细胞膜功能,最终导致细胞死亡[12]。该类杀菌剂属于N-1-取代-1,2,4-三唑环的有机氮杂环类化合物,主要通过发挥内吸功能,随蒸腾作用运输至植物各部位。由于其独特的作用方式及优异的生物活性,三唑类杀菌剂已被广泛应用于小麦、玉米、水稻、高粱等作物以及水果和蔬菜等的多种真菌病害防治中。但目前尚未见系统比较不同三唑类杀菌剂防治香蕉枯萎病效果的报道。因此,本研究基于常用的三唑类杀菌剂,开展杀菌剂对FocTR4 的抑菌效果研究,通过对三唑类杀菌剂与其靶标CYP51 的相互作用来探究它们对FocTR4 的抑制效果。本研究结果不但可为我国香蕉枯萎病的化学防治提供新策略,而且也为杀菌剂的科学合理应用提供了指导。
1.1 供试材料
供试菌株FocTR4(菌株Ⅱ5,VCG01213),保存于广东省农业科学院果树研究所香蕉遗传改良中心,使用前将菌株于马铃薯葡萄糖琼脂(potato dextrose agar,PDA)平板上进行活化培养(28 ℃,3 d)。丙硫菌唑、腈菌唑、丙环唑、戊唑醇标准品均购自德国默克公司。分别称取对应量的不同三唑类杀菌剂原药溶于二甲基亚砜(dimethyl sulfoxide,DMSO)中配制成10 mg/mL的母液,置于4 ℃冰箱中保存,备用。使用时将母液用DMSO稀释到所需浓度,母液和稀释后的药剂每隔2 周重新配制。RNA提取试剂盒、cDNA 第一链合成试剂盒(HiScript Ⅱ1st Strand cDNA Synthesis Kit)和 以RNA 为 模 板的染料法实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction, qRT-PCR)试 剂 盒(HiScript®ⅡOne Step qRT-PCR SYBR Green Kit),均购自南京诺唯赞生物科技股份有限公司;
二喹啉甲酸蛋白浓度测定试剂盒(Bicinchoninic Acid Protein Assay Kit),购自广州市红烁林生物科技有限公司。
1.2 抑菌活性的测定
采用菌丝生长速率法测定不同三唑类杀菌剂对FocTR4 的抑菌活性。将PDA 加热至完全融化,待其冷却至40~50 ℃时加入相应浓度的丙硫菌唑、丙环唑、戊唑醇和腈菌唑,使得4 种三唑类杀菌剂在PDA 培养基中的终质量浓度分别为0.312 5、0.625、1.25、2.5、5、10、15、20 μg/mL,用已灭菌的打孔器在菌落边缘打取直径为5 mm的菌饼,菌饼倒置接种在冷却至室温的PDA平板上。用封口膜将平板密封,倒置放入28 ℃恒温培养箱中培养。每个处理重复3次,同时以加入等体积的DMSO 为对照。培养7 d后利用十字交叉法测定各平板菌落的生长直径并计算各浓度三唑类杀菌剂的抑制率,通过概率值分析法计算半最大效应浓度(concentration for 50%of maximal effect,EC50)值。菌丝生长抑制率计算公式如下:

1.3 菌丝形态观察
菌株培养和处理同1.2节。于28 ℃的培养箱中倒置培养7 d 后,用牙签挑取菌落边缘少量菌丝于磷酸盐缓冲液(phosphate buffer saline, PBS)(pH 7.4)中,用移液枪轻轻吹打菌丝至分散,并吸取少量菌液滴加于载玻片上,盖上盖玻片,在光学显微镜下观察菌丝形态并拍照。
在平板边缘打取直径为8~10 mm的菌饼,将菌饼置于2.5%戊二醛-4.0%多聚甲醛固定液(pH 6.8)中,于4 ℃条件下进行前固定。3 h后用PBS(pH 6.8)冲洗样品3 次,继续用1%锇酸固定并过夜,再次用PBS(pH 6.8)冲洗样品3 次。用30%、50%、70%、90%、95%、100%、100%、100%乙醇梯度脱水,每个浓度梯度处理15~20 min。临界点干燥、粘样、喷金镀膜后,于S-3400N-Ⅱ扫描电子显微镜(日本日立公司)下观察、拍照。以上每个处理重复3次。
1.4 菌丝电导率的测定
菌株培养和处理同1.2 节。参考张俊[13]的方法测定菌丝细胞膜的通透性以确定菌丝电导率。用灭菌的打孔器在菌落边缘打取菌饼并放入配制好的马铃薯葡萄糖液体(potato dextrose broth,PDB)培养基中,于28 ℃、180 r/min 振荡培养箱中培养7 d后,用5 层擦镜纸过滤。将称取的0.15 g 菌丝放入已提前装好等量双蒸水的小烧杯中,加入不同质量浓度(0.25、1.25 μg/mL)的丙硫菌唑、丙环唑、戊唑醇、腈菌唑,以加入等体积的DMSO 为对照。分别在5、15、30、60、90、120、150、180、240、300、360 min时用电导仪测定电导率,最后将菌丝煮沸15 min,冷却至室温后测定最终电导率,每个处理设置3 个重复。菌丝相对电导率计算公式如下:

1.5 丙二醛(malondialdehyde,MDA)含量测定
在超净工作台中,将相应浓度的三唑类杀菌剂加入冷却至40~50 ℃的PDA 培养基中,使不同杀菌剂的终质量浓度分别为0.25、1.25 μg/mL,同时分别以加入等体积的DMSO 为对照。待平板冷却凝固,将已提前灭菌的玻璃纸平铺于PDA 表面,待玻璃纸表面水分吹干后接种菌饼,随后密封置于28 ℃恒温培养箱中培养7 d 后收集菌丝。采用MDA 含量检测试剂盒(微量法)(南京建成生物工程研究所)进行MDA 含量的测定:分别称取对照组和处理组菌丝样品0.10 g,加入1 mL提取液进行冰浴匀浆,于8 000 r/min 下离心10 min,收集上清液,根据试剂盒说明书进行操作,反应结束后,在450 nm 波长下测定各孔的吸光度值,计算样品中MDA含量。
1.6 CYP51 酶活性的测定
菌株培养和处理同1.2节。根据细胞色素P450芳香化酶检测试剂盒(上海江莱生物科技有限公司)说明书要求进行CYP51酶活性的测定。准确称取0.10 g 菌丝样品,加入1 mL 提取液,利用超声波破碎菌丝细胞(冰浴,功率200 W,超声3 s 停10 s,重复30 次),于4 ℃、12 000 r/min 下离心10 min,收集上清液,置于冰上待测。加入50 μL 终止液终止反应,在450 nm 波长下依次测定各孔的吸光度值。用标准品浓度与吸光度值计算出标准曲线的直线回归方程。在标准曲线上计算出样品经过稀释后的蛋白质浓度,再乘以稀释倍数,即为样品的实际浓度。
1.7 基因表达量的测定
参照RNA 提取试剂盒说明书提取菌丝的总RNA,以RNase-free 水为对照,检测RNA 的浓度与纯度;
采用1%琼脂糖凝胶电泳检测RNA的完整性;
采用cDNA第一链合成试剂盒对RNA进行反转录,具体试剂添加和反应条件按照说明书要求进行,反应终止后得到的cDNA 于-80 ℃冰箱中保存,备用。
所用引物(表1)由生工生物工程(上海)股份有限公司合成,20 μL qRT-PCR体系:0.4 μL 10 μmol/L正、反向引物,10 μL 2×通用型高灵敏度染料法定量PCR 预混液(Cham Q Universal SYBR qPCR Master Mix),2 μL cDNA(提前用ddH2O 稀释4 倍),7.2 μL ddH2O。反应扩增程序:95 ℃预变性30 s;
95 ℃变性10 s,60 ℃延伸10 s,40 个循环。溶解曲线制作:95 ℃变性15 s,60 ℃复性60 s,升温至95 ℃保持15 s,结束整个过程。目的基因的相对表达量采用2-ΔΔCT法进行计算。

表1 实时荧光定量PCR引物序列Table 1 Primer sequences for qRT-PCR
1.8 同源建模和分子对接
选择与FocTR4 的CYP51(TR4-CYP51)蛋白质序列一致性大于50% 的蛋白质序列pdb ID 6CR2[14]、5V5Z[15]、5ESI[16]和5JLC[16]进 行 多 模 板 建模[17]。使用Modeller 9.20 软件[18]多模板建模工具预测CYP51 的三维结构,获得1 000 个结构,通过DOPE 软件打分选择最佳模型;
用AutoDock Tools制备受体pdbqt 文件,加氢和分配电荷。采用AutoDock Vina工具进行分子对接,选择血红素铁原子为对接中心,设置对接盒子为15 Å×15 Å×15 Å。根据模板晶体结构中配体的结合构象,主要按照如下2 个标准选择最优的结合构象:第一是配体结合在4 个芳香氨基酸残基Tyr137、Phe131、Phe230 和Phe511 组成的结合口袋中;
第二是三氮唑环上的N原子与血红素铁接近,N-FE 接近垂直于血红素平面。使用PyMOL软件和Ligplot软件对结果进行分析和对接构象的可视化。
1.9 亲和动力学分析
前期的研究中,我们已通过原核表达系统获得了纯度较高的CYP51 蛋白(纯度≥90%)[17]。采用表面等离子共振(surface plasmon resonance,SPR)技术,通过Biacore T200软件(瑞士GE公司)进行多循环动力学测定,分析不同三唑类杀菌剂与CYP51之间的相互作用。采用氨基偶联反应将CYP51蛋白共价连接于CM5传感芯片表面。将三唑类杀菌剂稀释成浓度梯度125.000、62.500、31.250、15.625 nmol/L,缓冲液为含5%DMSO的HBS-EP[0.01 mol/LN-(2-羟乙基)哌嗪-N′-(2-乙磺酸)(HEPES),0.15 mol/L NaCl,0.003 mol/L 乙二胺四乙酸(EDTA),0.05%(体积比)表面活性剂P20,pH 7.4]。依次进行亲合力与动力学测试,每个浓度设置1 个循环,结合120 s,解离300 s,设置温度25 ℃,流速30 μL/min。Biacore T200 Evaluation 软件用于数据分析,同时使用1∶1稳态亲和力模型进行动力学/亲和力拟合分析。
1.10 数据处理与分析
采用GraphPad Prism 7.00和Statistics 19软件对数据进行处理,对照组和不同三唑类杀菌剂处理组采用单因素方差分析方法,并选择Tukey’s 多重比较法进行检验分析。
2.1 不同三唑类杀菌剂对Foc TR4生物活性的影响
采用菌丝生长速率法测定了4种三唑类杀菌剂对香蕉枯萎病菌FocTR4 的抑制作用。结果表明:对照组菌丝生长迅速,各药剂处理组菌丝生长缓慢;
对FocTR4的抑制效果存在浓度依赖效应,随着三唑类杀菌剂浓度的升高,菌落直径逐渐减小(图1A)。在相同浓度下,不同杀菌剂对FocTR4 抑制效果存在显著差异,其中丙硫菌唑的抑菌活性最高,EC50为0.79 μg/mL(R2=0.95);
戊唑醇和丙环唑对FocTR4 的抑制作用低于丙硫菌唑,EC50分别为1.33 μg/mL(R2=0.95)和5.32 μg/mL(R2=0.95);
腈菌唑的抑菌活性远低于其他3 种杀菌剂,其EC50为10.13 μg/mL(R2=0.95)(图1A~B)。
利用光学显微镜观察杀菌剂处理对FocTR4菌丝形态的影响发现,对照组菌丝表面光滑,生长粗细均匀,分枝正常;
而处理组菌丝呈现不规则分枝增多、生长粗细不均等畸形现象(图1C)。进一步通过扫描电子显微镜观察发现,三唑类杀菌剂处理可引起FocTR4 菌丝出现表面干瘪、凹陷和扁平化现象,其中丙硫菌唑对FocTR4 菌丝的形态影响最为明显。光学显微镜下观察到腈菌唑引起FocTR4菌丝分枝增多,但扫描电子显微镜观察到其对菌丝的显微结构无明显影响(图1D)。以上结果表明,这4种杀菌剂均可影响FocTR4 菌丝的正常生长发育,且不同杀菌剂引起的菌丝畸形程度存在差异。

图1 不同三唑类杀菌剂对Foc TR4的抑制效果及菌丝形态Fig.1 Inhibitory effects of different triazole fungicides against Foc TR4 and hyphae morphology
2.2 不同三唑类杀菌剂对Foc TR4 细胞膜通透性的影响
电导率可作为病原菌菌丝细胞膜损伤程度的评价指标,电导率越大,表明细胞内电解质渗漏越严重,细胞膜的损伤越厉害。因此,本研究通过测定不同时间点FocTR4菌丝在双蒸水中的相对电导率来表征三唑类杀菌剂对菌丝细胞膜通透性的影响,相对电导率越大,表示菌丝细胞膜通透性越高。如图2所示,随着时间的延长,对照组和处理组菌丝的相对电导率均逐渐升高,且不同时间点各处理组菌丝电导率均显著高于对照组,在处理时间点为360 min 时,对照组的电导率为20.69%,经0.25、1.25 μg/mL丙硫菌唑处理的菌丝相对电导率分别达到59.16%和61.42%(图2A),相同条件下戊唑醇处理的菌丝相对电导率分别为32.03%和51.37%(图2B),丙环唑处理组相对电导率分别为30.55%和47.65%(图2C),腈菌唑处理组的相对电导率分别为30.70%和41.55%(图2D)。以上结果表明,4种三唑类杀菌剂均可引起FocTR4菌丝细胞内的电解质外渗,提高相对电导率,且浓度越高,对菌丝细胞膜通透性的影响越大。除此之外,不同杀菌剂对菌丝细胞膜通透性的影响也存在差异,表现为丙硫菌唑>戊唑醇>丙环唑>腈菌唑。
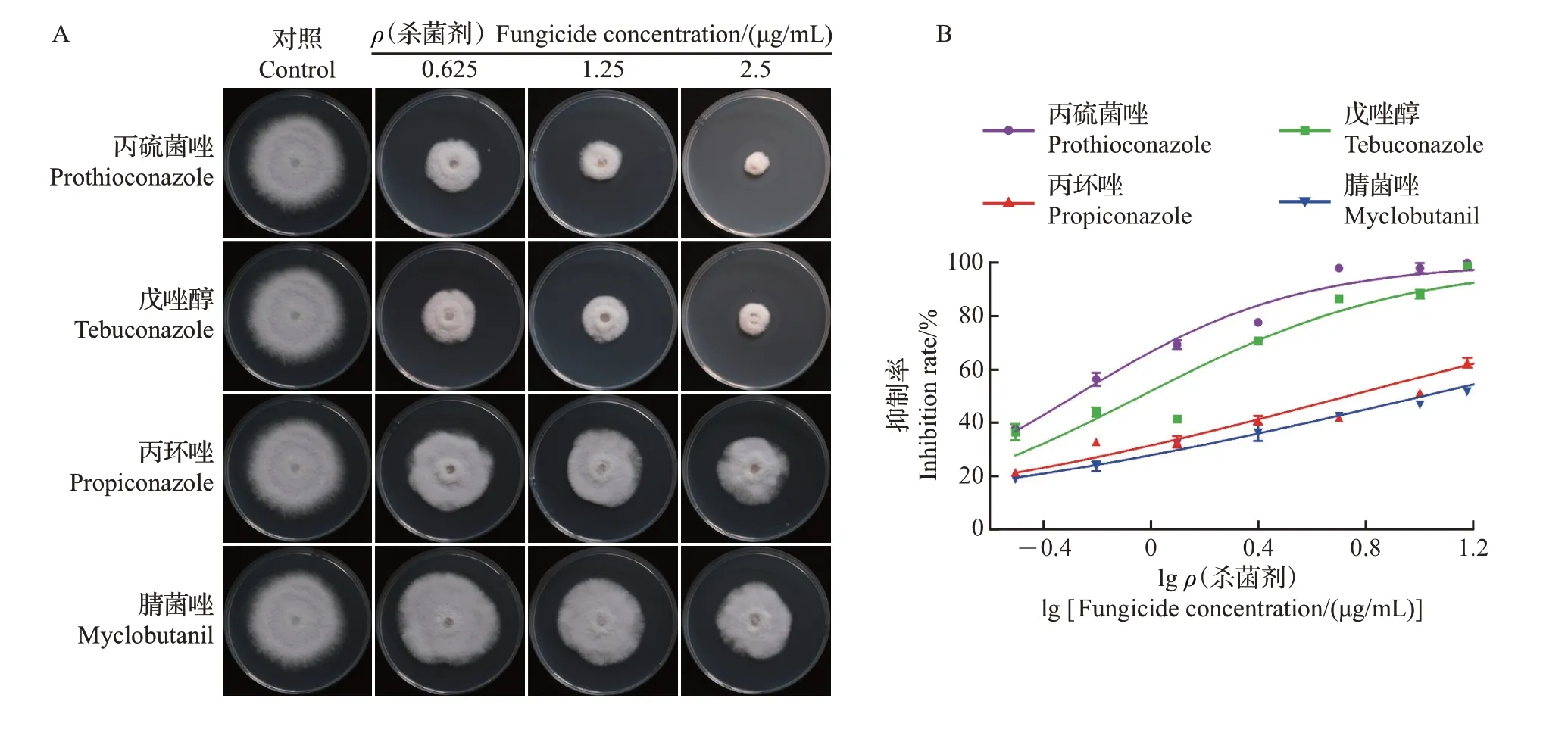
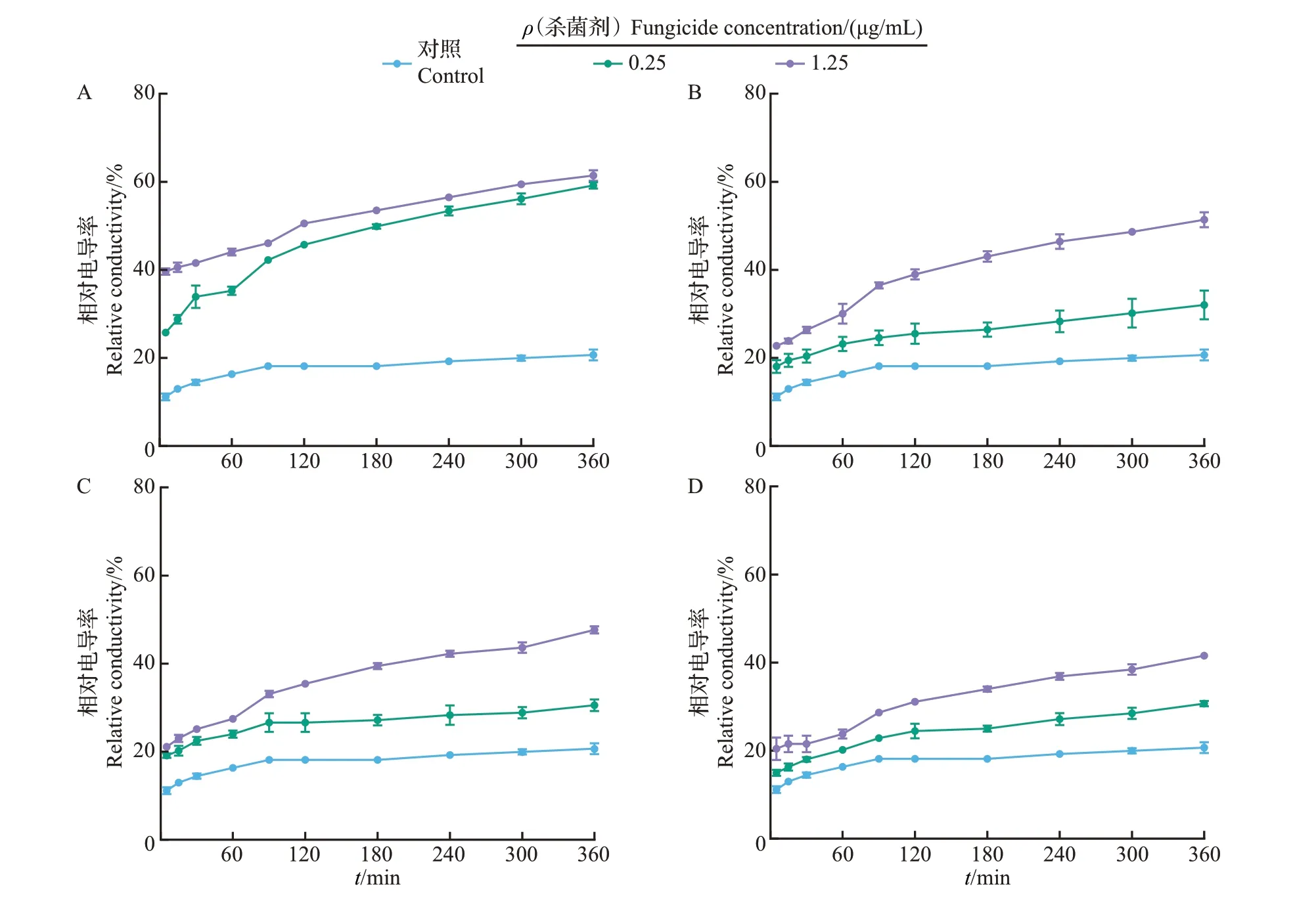
图2 不同三唑类杀菌剂对Foc TR4菌丝细胞相对电导率的影响Fig.2 Effects of different triazole fungicides on the relative conductivity of Foc TR4 hypha cells
MDA 是细胞内部生物大分子过氧化的产物之一,也是衡量细胞膜损伤程度的一个重要指标,MDA 含量越高,表示细胞损伤越严重。与相对电导率结果一致,不同三唑类杀菌剂处理可导致FocTR4 菌丝细胞内MDA 含量显著上升(图3),0.25、1.25 μg/mL 丙硫菌唑处理组菌丝的MDA 含量分别为对照组(5.43 nmol/mL)的1.72 倍(9.33 nmol/mL,P<0.001)和2.50 倍(13.57 nmol/mL,P<0.001);
0.25、1.25 μg/mL戊唑醇处理组菌丝的MDA含量分别为对照组的1.53 倍(8.33 nmol/mL,P<0.001)和2.24倍(12.18 nmol/mL,P<0.001);
0.25、1.25 μg/mL丙环唑处理组菌丝的MDA 含量分别为对照组MDA 的1.40 倍(7.62 nmol/mL,P<0.001)和1.96 倍(10.65 nmol/mL,P<0.001);
0.25、1.25 μg/mL腈菌唑处理组菌丝的MDA 含量分别为对照组的1.40 倍(7.58 nmol/mL,P<0.001)和1.93 倍(10.48 nmol/mL,P<0.001)。以上结果表明,三唑类杀菌剂可促进MDA在FocTR4菌丝细胞中的积累,从而造成菌丝不同程度的膜脂过氧化损伤。

图3 不同三唑类杀菌剂对Foc TR4 菌丝细胞内丙二醛含量的影响Fig.3 Effects of different triazole fungicides on concentrations of MDA in Foc TR4 hypha cells
2.3 三唑类杀菌剂与靶标CYP51 的相互作用
三唑类杀菌剂通过与靶标CYP51 作用抑制真菌生长,其与靶标酶的结合能力能够在一定程度上反映他们的抑菌能力,因此,本研究通过明确不同三唑类杀菌剂处理对细胞色素P450酶活性、CYP51基因表达量的影响以及不同三唑类杀菌剂与CYP51的结合作用模式,探究不同三唑类杀菌剂对CYP51的影响。
如图4A 所示,不同浓度的4 种杀菌剂对FocTR4 的细胞色素P450 酶活性均具有一定的诱导作用,且存在浓度依赖效应。其中,与对照组相比,0.25 μg/mL丙硫菌唑和0.25 μg/mL戊唑醇可诱导细胞色素P450 酶活性显著上升(P<0.05),细胞色素P450酶活性分别为对照组的1.70倍和1.45倍;
当处理组的质量浓度为1.25 μg/mL 时,4 种杀菌剂均可显著诱导细胞色素P450 酶活性上升(P<0.05)。FocTR4 含 有3 个CYP51基 因,分 别 为CYP51-1(FOIG_04112)、CYP51-2(FOIG_10483)和CYP51-3(FOIG_00890)。采用实时荧光定量PCR 测定不同三唑类杀菌剂对基因表达量的影响,结果(图4)表明:4 种杀菌剂均可显著上调CYP51-1(图4B)和CYP51-3(图4D)基因的表达量(P<0.05),而对CYP51-2基因的表达量均无显著影响(图4C)。CYP51-1基因表达量的上调范围在0.25 μg/mL处理下为1.29~5.66 倍,在1.25 μg/mL 处理下为3.04~16.08 倍。CYP51-3基因表达量上调范围在0.25 μg/mL 处理下为1.26~6.30 倍,在1.25 μg/mL 处理下为3.50~13.93 倍。与对细胞色素P450 酶活性的诱导作用不同,在相同处理浓度下,丙硫菌唑对CYP51-1和CYP51-3基因表达水平的影响显著小于戊唑醇和丙环唑。
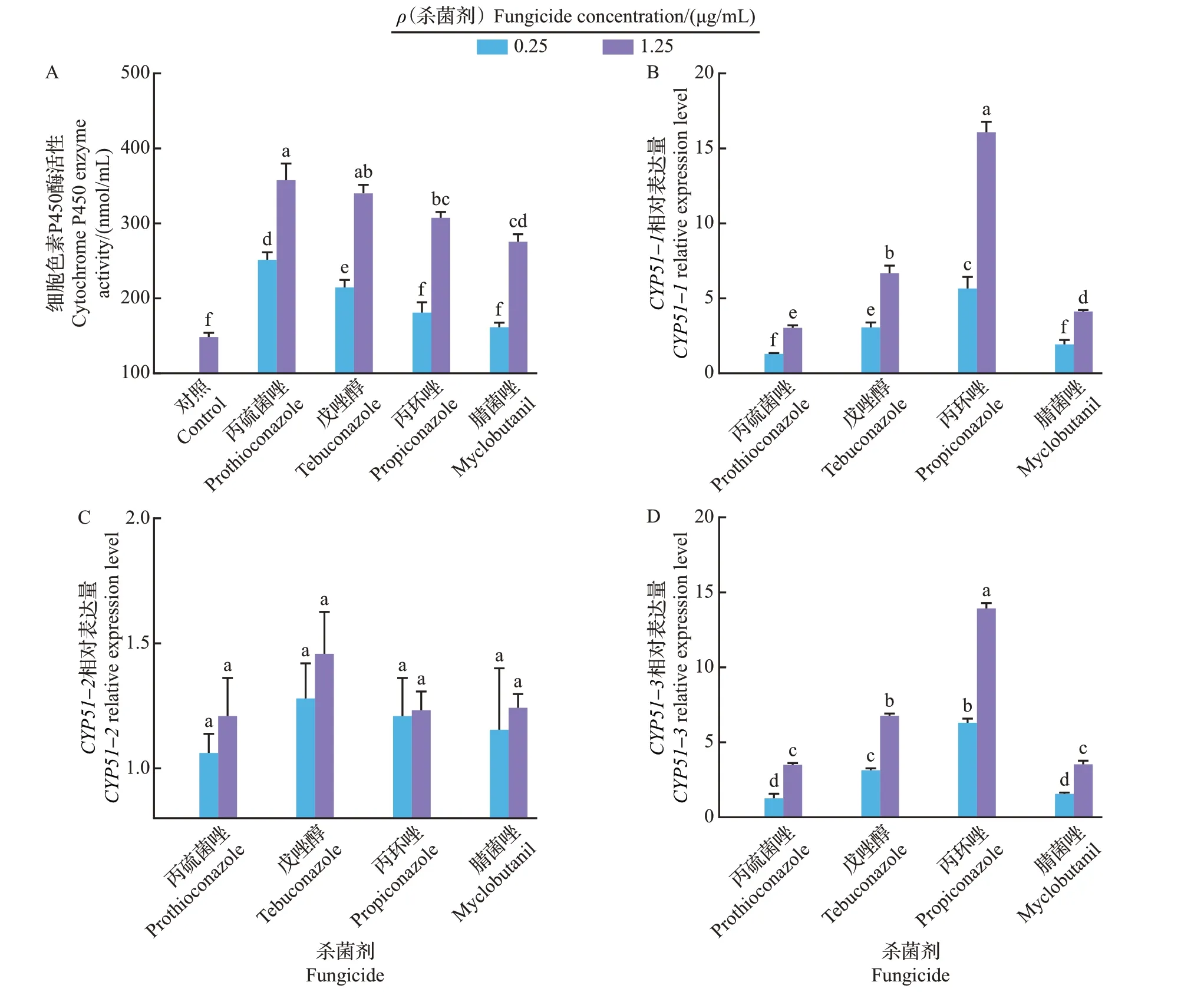
图4 不同三唑类杀菌剂对细胞色素P450酶活性和靶标基因CYP51相对表达量的影响Fig.4 Effects of different triazole fungicides on cytochrome P450 enzyme activity and relative expression levels of target gene CYP51
为进一步研究不同三唑类杀菌剂与CYP51的作用模式,本研究采用Modeller 9.20 软件对CYP51-3蛋白质序列进行同源建模(图5A),利用AutoDock Vina 工具分析不同三唑类杀菌剂与CYP51 蛋白质的作用模式(图5B)。采用盲对接将每个配体进行5次对接,每次产生20个构象,穷尽性为100。通过分析它们与CYP51的结合构象发现,这4种杀菌剂均位于同样的结合口袋,共同作用的疏水残基有Ala308、Phe511、Tyr123、Phe131、Ile374 和Tyr137(图6)。结合自由能反映了配体和受体间的结合程度,结合自由能越小,分子间结合就越紧密。通过分子对接得到丙硫菌唑、戊唑醇、腈菌唑和丙环唑同源建模结构的结合自由能分别为-33.79、-34.92、-34.08、-36.59 kJ/mol,上述4 种杀菌剂三氮唑环上的N 原子与CYP51 的血红素铁之间的距离分别为2.66、2.81、2.67、2.96 Å(表2)。

图5 Foc TR4中CYP51蛋白质的同源建模Fig.5 Homology modeling of CYP51 protein from Foc TR4
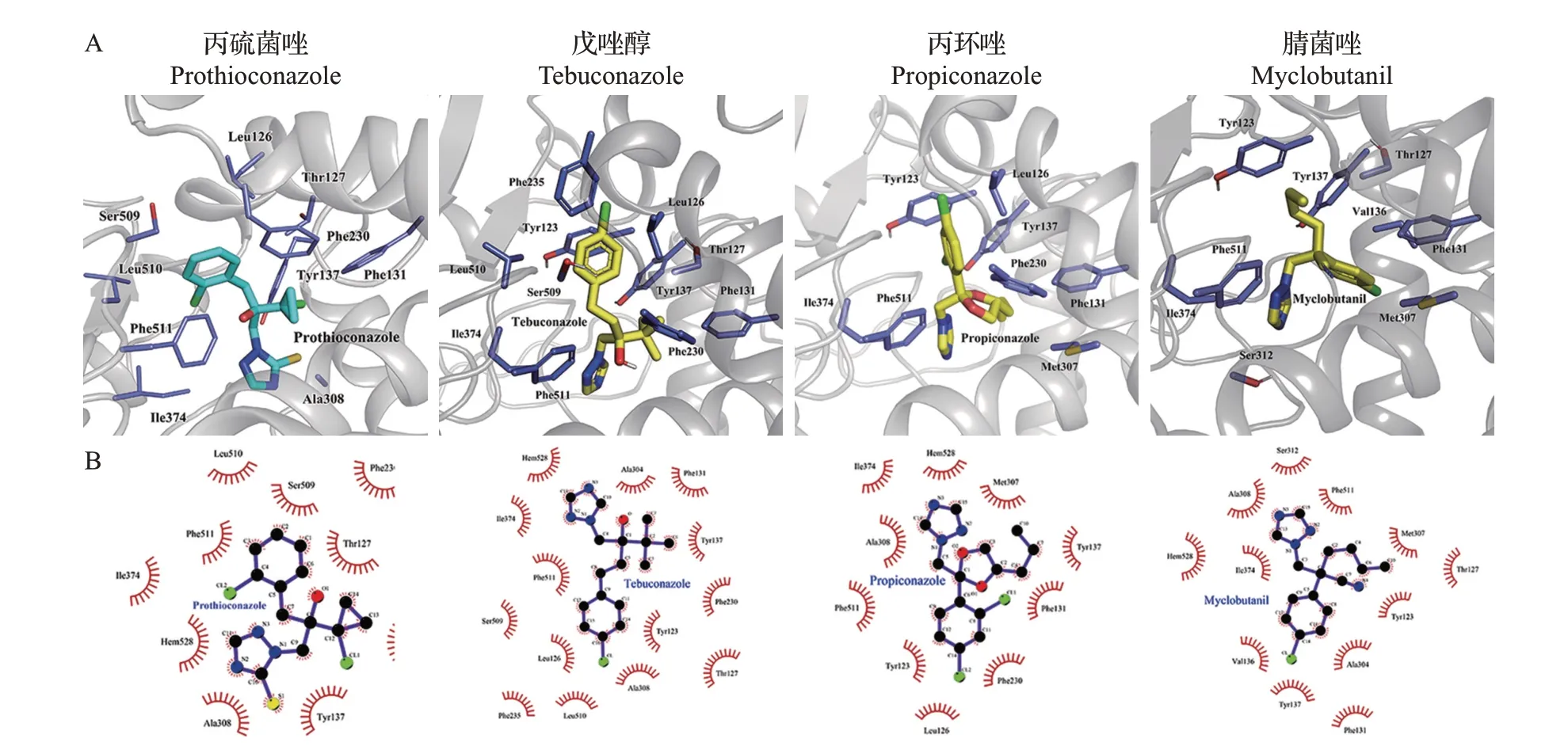
图6 分子对接预测4种三唑类杀菌剂与CYP51的结合模式Fig.6 Binding modes of four triazole fungicides with CYP51 predicted by molecular docking
为验证不同三唑类杀菌剂与CYP51 的互作模式,分别对4 种杀菌剂与CYP51 蛋白质进行SPR 亲和力测试。如图7 所示,CYP51 蛋白质的响应值(response unit,RU)随杀菌剂浓度的升高而上升,表现出很好的浓度依赖效应。4种杀菌剂与CYP51的结合呈现出2 种模式:丙硫菌唑和腈菌唑在进样几秒钟内即可以取得稳态反应,进样完毕药物解离迅速,响应信号值立即回归基线,呈现出“快上快下”的结合模式;
而戊唑醇和丙环唑与CYP51的结合呈现出“慢上快下”结合模式。这些结果证实了CYP51 蛋白偶联芯片具有良好的活性和特异性。利用1∶1稳态亲和力模型对4种杀菌剂与CYP51的结合情况进行拟合,得到了4 种杀菌剂与CYP51 蛋白质的亲和动力常数(KD)(表2),分别为2.87×10-7mol/L(丙硫菌唑)、2.42×10-9mol/L(戊唑醇)、7.86×10-8mol/L(丙环唑)和2.15×10-6mol/L(腈菌唑)。

图7 不同三唑类杀菌剂与CYP51的结合动力学曲线Fig.7 Binding kinetic curves of different triazole fungicides with CYP51

表2 不同三唑类杀菌剂与CYP51的分子对接和亲和动力学参数Table 2 Molecular docking and affinity-kinetic parameters of different triazole fungicides with CYP51
三唑类杀菌剂因其优良的保护、治疗作用及内吸性功能已被广泛用于多种植物病原菌的防治。但目前尚无关于不同三唑类杀菌剂防治香蕉枯萎病效果差异比较的系统性报道。本研究测定了4种常用三唑类杀菌剂对香蕉枯萎病菌FocTR4 的抑菌活性,结果表明:不同三唑类杀菌剂对FocTR4菌丝生长抑制效果差异明显,其中丙硫菌唑的抑菌活性最高,EC50为0.79 μg/mL,而相同条件下腈菌唑EC50为10.13 μg/mL,二者抑菌活性相差近12倍。由此可见三唑类杀菌剂对FocTR4 的作用具有一定的选择性。细胞膜具有多种生物功能,可为细胞的生命活动提供相对稳定的内部环境,是真菌自我保护的屏障。病原菌细胞膜受损可导致细胞膜屏障作用被破坏,细胞内物质外泄,外源物质也可以随意进入细胞,最终导致病原菌形态发生改变。三唑类杀菌剂通过抑制真菌甾醇生物合成中CYP51活性,引起麦角甾醇合成受阻以及甾醇前体物质的积累,从而破坏细胞膜的正常功能,在不同程度上对细胞膜的通透性、完整性以及细胞的形态等各方面产生影响[19],最终导致细胞死亡。本研究发现,使用三唑类杀菌剂尤其是丙硫菌唑处理可导致FocTR4菌丝出现表面干瘪、凹陷和扁平化现象。电导率和MDA含量是衡量细胞膜通透性和细胞膜损伤程度的重要指标。与丙环唑对核盘菌[20],戊唑醇、三唑醇对小麦纹枯病菌(Rhizoctonia cerealis)菌丝细胞膜的影响结果[21]一致,丙硫菌唑、戊唑醇、丙环唑和腈菌唑均可以引起FocTR4 菌丝细胞内电解质外渗,使细胞膜通透性提高,表明三唑类杀菌剂对FocTR4 的生长影响不仅表现在对菌丝微观形态的改变上,也体现在对菌丝细胞膜通透性的改变上,从而引起细胞内一系列生理生化反应,对菌丝生长产生不利影响。同时,相较于其他3种三唑类杀菌剂,丙硫菌唑对FocTR4的作用效果是最优的。
目前,有关不同三唑类杀菌剂抑菌活性差异作用机制,尤其是不同分子结构与其靶标的互作模式仍缺乏进一步研究。本研究中,三唑类杀菌剂处理可引起FocTR4菌丝中细胞色素P450酶活性上升,表明4 种三唑类杀菌剂对细胞色素P450 酶具有诱导作用。动植物或真菌中都不只含有1个CYP51基因[22]。如烟曲霉(Aspergillus fumigatus)[23]以及稻瘟病菌(Magnaporthe oryzae)[24]中均含有2 个同源CYP51基因,尖孢镰刀菌(Fusarium oxysporum)[19]、禾谷镰刀菌(Fusarium graminearum)[25]以及黄曲霉(Aspergillus flavus)[26]中则均含有3 个CYP51基因。对细胞色素P450 基因的异源表达和调控的研究结果证明,P450 有广泛的底物诱导特性[27],如戊唑醇可诱导禾谷镰刀菌[25]和亚洲镰刀菌(Fusarium asiaticum)[28]的CYP51A和CYP51B基因的过量表达;
三唑类杀菌剂可诱导稻瘟病菌[24]和指状青霉菌(Penicillium digitatum)[29]中CYP51A基因表达量上调。同样地,本研究中,与对照组相比,4种三唑类杀菌 剂 可诱 导FocTR4 中CYP51-1和CYP51-3的 表达量显著性上调,表明靶标基因CYP51的较高表达是4 种三唑类杀菌剂诱导的结果。许多研究指出,CYP51 在病原菌对三唑类杀菌剂的敏感性中发挥着重要作用。如与野生型菌株相比,ΔCYP51A的稻瘟病菌和禾谷镰刀菌菌株对三唑类杀菌剂的敏感性显著增加;
稻瘟病菌的CYP51A基因被敲除后,其对多种三唑类杀菌剂敏感性提高[24-25]。以病原菌靶标CYP51的三维结构为基础,解析其与三唑类杀菌剂互作的分子机制,有助于进一步阐明FocTR4 对三唑类杀菌剂敏感性差异的机制。FocTR4 的3 个CYP51 中,CYP51-3 和 镰 刀 菌Fusarium musae的CYP51B 氨基酸序列一致性高达98.67%[30],在已报道的丝状真菌中,CYP51B被认为主要负责编码甾醇14α-脱甲基酶[31]。基于此,本研究选取了CYP51-3氨基酸序列进行同源建模,并进一步对4 种杀菌剂与靶标CYP51-3的分子对接模式进行分析。结果表明,4 种杀菌剂与CYP51 的结合自由能分别为-33.79 kJ/mol(丙硫菌唑)、-34.92 kJ/mol(戊唑醇)、-34.08 kJ/mol(腈菌唑)和-36.59 kJ/mol(丙环唑),其中CYP51与丙环唑的亲和力最强,与丙硫菌唑的亲和力最弱,但不同杀菌剂之间的结合自由能无显著性差异。因此本研究进一步采用SPR手段对4种杀菌剂与CYP51蛋白进行亲和力检测。结果发现,4种杀菌剂均显示出较好的结合力。与分子对接结果相一致,与戊唑醇和丙环唑相比,丙硫菌唑与CYP51的结合模式不同,表现为“快上快下”模式,且结合能力较弱,其亲和动力常数为2.87×10-7mol/L。该结果与对CYP51基因表达量的研究结论一致,丙硫菌唑对CYP51-1和CYP51-3基因表达的诱导水平显著小于戊唑醇和丙环唑。4种杀菌剂中,丙硫菌唑的作用效果优于其他3种杀菌剂。推测原因可能是与其他三唑类杀菌剂相比,丙硫菌唑与CYP51的作用方式存在特异性,戊唑醇和丙环唑是非竞争性抑制剂,而丙硫菌唑是竞争性抑制剂。PARKER等[32]的研究结果表明,当戊唑醇、三唑醇、丙环唑与禾生球腔菌(Mycosphaerella graminicola)的CYP51(MgCYP51)紧密结合时,产生强的Ⅱ型差异光谱(峰值在423~429 nm 波长处,波谷在406~409 nm波长处),表明形成了典型的低自旋六配位体复合物。而丙硫菌唑和MgCYP51蛋白质的结合具有不同的吸收峰,且结合能力比戊唑醇等其他杀菌剂低800多倍[32],该研究结果也很好地证实了上述推测。
与其他三唑类杀菌剂相比,丙硫菌唑具有更广谱的杀菌活性。硫酮结构的引入赋予了丙硫菌唑独特的性能以及良好的内吸活性。因此,丙硫菌唑对于香蕉枯萎病的防治效果值得进一步的探究,这对于扩大丙硫菌唑的应用范围和高效防治香蕉枯萎病具有重要意义。在此基础上,本课题组下一步的研究工作将对FocTR4 的CYP51基因进行突变,探究其与三唑类杀菌剂互作中发挥作用的关键氨基酸位点,以期为香蕉枯萎病的田间防治提供理论支持。
猜你喜欢 丙环唑三唑细胞膜 19%啶氧.丙环唑微乳剂分析方法研究农药科学与管理(2021年9期)2021-11-1536%丙环唑·咪鲜胺悬浮剂的高效液相色谱分析农业与技术(2021年13期)2021-07-16外周血红细胞膜脂肪酸C20:1n9水平与冠状动脉病变严重程度的关系研究心肺血管病杂志(2020年5期)2021-01-14新的药根碱三唑的合成与抗菌以及乙酰胆酯酶抑制活性评价天然产物研究与开发(2018年4期)2018-05-07几种丙环唑及其复配剂对水稻纹枯病的试验效果初报农家科技下旬刊(2017年10期)2017-12-06不同浓度三唑锡悬浮剂防治效果研究中国果菜(2016年9期)2016-03-01皮肤磨削术联合表皮细胞膜片治疗稳定期白癜风疗效观察中国医疗美容(2015年4期)2015-04-27宫永宽:给生物医用材料穿上仿细胞膜外衣科学中国人(2015年13期)2015-02-281,1′-二(硝氧甲基)-3,3′-二硝基-5,5′-联-1,2,4-三唑的合成及性能火炸药学报(2014年5期)2014-03-20香芹酚对大肠杆菌和金黄色葡萄球菌细胞膜的影响食品工业科技(2014年23期)2014-03-11








