落叶松-杨栅锈菌MlpNHA1-like基因的克隆及序列分析
时间:2023-01-17 21:20:04 来源:雅意学习网 本文已影响 人 
刘亦菲,杨 冰,周显臻,李嘉雯,于 丹
(西北农林科技大学 林学院,陕西 杨陵 712100)
酿酒酵母(Saccharomycescerevisiae)NHA1蛋白是酵母质膜反转运蛋白亚家族成员之一,这类反转运蛋白属于Na+/H+交换蛋白大家族[1]。NHA1至少对4种碱金属阳离子具有广泛的底物特异性,在细胞内具备多种功能,包括对渗透胁迫的即时响应[2-3]。酿酒酵母NHA1蛋白由985个氨基酸组成,包含高度疏水的N端跨膜结构域和亲水的C端结构域。响应外界高渗透压途径关键调控因子丝裂原活化蛋白激酶HOG1能够与NHA1的C端区域(431~985)互作,并且这种互作不受到是否被外源NaCl处理影响,同时HOG1能够在体外有效地磷酸化NHA1 C端区域。更重要的是,NHA1在T765和T876 2个位点被HOG1磷酸化对外源渗透压胁迫的即时响应至关重要,可以帮助分离的蛋白与染色体上靶标位点再次快速结合[3]。
除酿酒酵母NHA1基因外,在其他真菌中也克隆到4个同源基因,分别为裂殖酵母(Schizosaccharomycespombe)SOD2基因、鲁氏酵母(Zygosaccharomycesrouxii)ZSOD2和ZSOD22基因及白色念珠菌(Candidaalbicans)CNH1基因[4-7]。然而在植物病原真菌中NHA1基因功能的研究报道甚少。专性寄生真菌落叶松-杨栅锈菌侵染杨树叶片引起杨树叶锈病,该病害影响杨树生长,造成重大经济损失[8-10]。前期研究已成功克隆落叶松-杨栅锈菌中国菌株MlpHOG1基因,并借助小麦赤霉菌体系异源互补试验推断MlpHOG1基因在该锈菌侵染菌丝生长和响应环境胁迫方面具有一定的作用[11]。本研究通过系统发育分析和序列相似性比对确定落叶松-杨栅锈菌标准菌株NHA1候选基因,进而同源克隆获得中国菌株MlpNHA1-like基因的ORF片段,并对目的蛋白的基本理化性质、保守结构域、跨膜结构、二级结构、亚细胞定位等方面进行预测分析,为后续明确目的蛋白功能及其与MlpHOG1蛋白的互作关系提供帮助。
1.1 试验材料和试剂
1.1.1 试验材料 落叶松-杨栅锈菌中国菌株wh03为单孢菌系,由西北农林科技大学林学院森林病理学实验室提供。使用太白杨(Populuspurdomii)在温室进行菌株人工扩繁,根据曹支敏等[12]的方法进行菌株的活化及保存。
1.1.2 主要试剂 引物序列合成和大肠杆菌阳性转化子测序由北京奥科鼎盛生物科技有限公司(杨凌分部)完成。总RNA提取试剂盒购自QIAGEN公司,反转录试剂盒和Taq酶购自Thermo Scientific公司,TransStartFastPfu酶购自全式金公司,pMD19-T载体购自TAKARA公司。
1.2 试验方法
1.2.1 候选基因系统发育分析 以酿酒酵母NHA1(YLR138W)的蛋白序列为查询序列,在供试真菌的全基因组数据库中以1e-5为阈值进行比对分析,获得每个供试物种与酿酒酵母NHA1相关的候选基因的蛋白序列(表1)。将所有蛋白序列用软件MEGA7.0对齐,用gblocks移除序列中gaps较多的区域。最后,用iqtree构建最大似然法(Maximum likelihood)树,设置“-m”参数调用ModelFinder预测出待分析的氨基酸序列的最佳替代模型,设置“-b 1000”采用1 000次重复计算的常规自展检验法(Bootstrap)对分支可靠性进行评估。生成的树文件使用MEGA7.0软件查看。

表1 参与NHA1系统进化分析的物种及比对结果
1.2.2 总RNA的提取及cDNA的合成 参照QIAGEN公司Rneasy Plant Mini Kit试剂盒说明书,提取落叶松-杨栅锈菌夏孢子总RNA,用1.2%琼脂糖凝胶电泳和NanoDrop 2000检测RNA的完整性、浓度及纯度。参照Thermo Scientific Revert Aid First Strand cDNA Synthesis Kit试剂盒说明书合成cDNA第一链。
1.2.3 引物设计及目的基因克隆 根据落叶松-杨栅锈菌标准菌株98AG31全基因组数据库(v1.0,https://mycocosm.jgi.doe.gov/Mellp1/Mellp1.home.html)[13]中Protein ID 116278基因序列,利用软件Primer Premier 5设计特异性扩增引物。上游引物为116278-uF1(5′CGAAGAACCAAGAGCCACAAG3′),下游引物为116278-uR1(5′ GTGAGCCATTGAGATTGTATG 3′)。
PCR反应总体系为 50 μL:5×TransStarFastPfuBuffer 10 μL,2.5 mM dNTPs 4 μL,10 μM上下游引物各1 μL,cDNA模板1 μL,TransStarFastPfuDNA聚合酶1 μL,无菌水32 μL。扩增程序:95 ℃预变性 1 min;
95 ℃变性 20 s,58 ℃退火 20 s,72 ℃延伸50 s,35个循环;
72 ℃延伸 5 min,16 ℃保存。扩增完成后,在PCR产物中加入0.6 μLTaqDNA聚合酶,72 ℃延伸30 min,16 ℃保存。PCR扩增产物用1.0%琼脂糖凝胶电泳检测,按照琼脂糖凝胶回收试剂盒说明书,回收目的条带。回收产物连接pMD19-T载体骨架,利用热激法将重组子转化大肠杆菌DH5α感受态细胞,最后将筛选出的阳性转化子送至公司进行测序。
1.2.4 目的基因编码蛋白生物信息学分析 利用ExPASy在线工具ProtParam分析目的基因编码蛋白的相对分子质量、残基数目与组成、等电点和稳定性等基本理化性质。利用NCBI的保守结构域数据库(conserved domain database,CDD)和在线工具SMART分析目的基因编码蛋白的保守结构域,并使用TBtools[14]进行绘制。利用TMHMM Server 2.0工具和ExPASy在线工具Protscale在线分析目的基因编码蛋白跨膜结构域和氨基酸序列亲水/疏水性。利用SOPMA在线工具预测目的基因编码蛋白的二级结构。利用4种在线软件EuK-mPLoc 2.0、WOLF PSORT、CELLO和PROTCOMP预测分析目的蛋白的亚细胞定位区域。
2.1 候选基因的确定
以酿酒酵母NHA1蛋白序列为诱饵,在落叶松-杨栅锈菌标准菌株98AG31全基因组数据库(v1.0)中进行比对,得到2个蛋白序列,Protein ID分别为45128和116278。进而选取担子菌柄锈菌亚门松栎柱锈菌和小麦秆锈菌、担子菌黑粉菌亚门玉米黑粉菌、子囊菌盘菌亚门稻瘟菌和禾谷镰孢菌、子囊菌外囊菌亚门裂殖酵母、子囊菌酵母亚门白色念珠菌及接合菌卷枝毛霉等多种代表真菌,将比对后获得的所有与NHA1相关的蛋白序列进行系统进化树构建,结果显示,ID 45128(v1.0)为NHA1在落叶松-杨栅锈菌标准菌株98AG31中的直系同源基因(图1),命名MlpNHA1。ID 116278(v1.0)虽然不是直系同源基因(图1),但其在酿酒酵母全基因组数据库中序列相似性比对得到唯一蛋白序列即NHA1(e-value为2e-59),并且其编码蛋白具有与NHA1相同的保守结构域(c_cpa1,e-value为5.92e-97),命名为MlpNHA1-like。

注:1)供试物种中与NHA1相关的所有蛋白序列一同构建系统进化树;
2)物种后的数字代表在JGI相应物种数据库中的蛋白序号(Protein ID);
3)自展支持率标注于节点。
2.2 目的基因的克隆
提取落叶松-杨栅锈菌中国菌株wh03夏孢子总RNA并反转录为cDNA作为扩增模板。由于标准菌株98AG31中注释的基因ID 45128序列不完整,尚未克隆到该基因的ORF片段。根据基因ID 116278的序列设计特异引物进行同源克隆,PCR扩增后得到一个特异且浓度较高的条带,大小约为1.7 kb。切胶回收及TA克隆检测后进行测序分析,结果表明成功获得wh03菌株基因ID 116278的ORF片段,长度为1 545 bp,将该基因命名为MlpNHA1-like (wh03)(GenBank accession number MZ826137)。
2.3 目的基因编码蛋白结构预测分析
利用在线软件ProtParam进行蛋白理化性质分析,结果表明MlpNHA1-like (wh03) 基因编码514个氨基酸,相对分子量57.787 ku。在极性氨基酸分析中,负电荷氨基酸残基(Asp+Glu)总数为46个,正电荷氨基酸残基(Arg+Lys)总数为40个,带负电荷的数目略多于正电荷。MlpNHA1-like (wh03)理论等电点(pI)为5.81,说明偏酸性。预测的不稳定指数为36.56,未超过40,推测属于稳定蛋白。
酿酒酵母NHA1蛋白具有高度疏水的N端跨膜结构域和亲水的C端结构域[3]。利用NCBI保守结构域数据库(CDD)分析,发现MlpNHA1-like (wh03)蛋白具有和NHA1一致的保守结构域c_cpa1(图2A)。在线软件SMART分析结构域显示MlpNHA1-like (wh03)蛋白具有10个跨膜结构,与NHA1特征一致(图2B)。进一步借助TMHMM Server 2.0 工具对目的蛋白进行跨膜结构预测,结果同样表明MlpNHA1-like (wh03)蛋白包含10个跨膜结构,分别位于第15~32、37~59、74~93、106~128、212~234、254~273、308~330、342~364、374~396、409~431位氨基酸(图3A)。使用在线软件Protscale分析氨基酸序列亲疏水性,图形的高峰值(正值)的区域表示疏水的区域,而负值的“低谷”区域是亲水区域,分析结果显示预测的疏水区域与跨膜区域基本一致(图3B)。
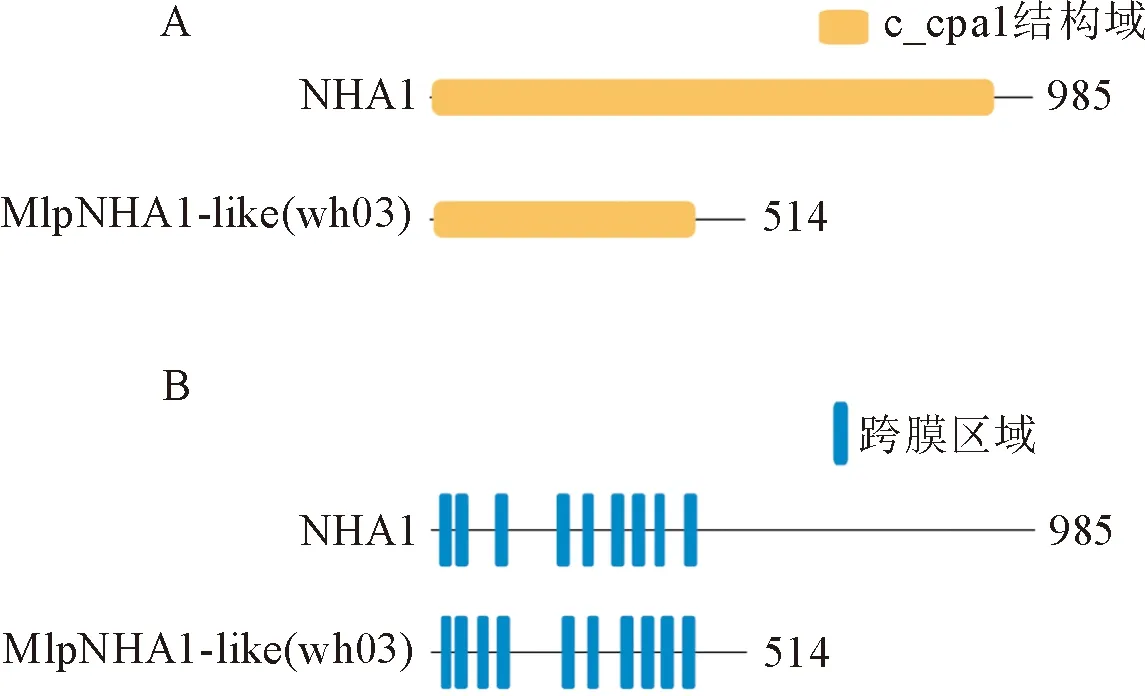
图2 MlpNHA1-like (wh03)蛋白保守结构域

图3 MlpNHA1-like (wh03)蛋白跨膜结构和亲/疏水性区域
运用SOPMA在线预测目的蛋白二级结构,显示MlpNHA1-like (wh03)蛋白二级结构主要由4种形式组成(图4),分别为45.33%的α-螺旋(Alpha helix)、3.89%的β-转角(β-turn)、13.42%的延伸链(Extended strand)和37.35%的无规则卷曲(Random coil),其中α-螺旋和无规则卷曲为主要二级结构。
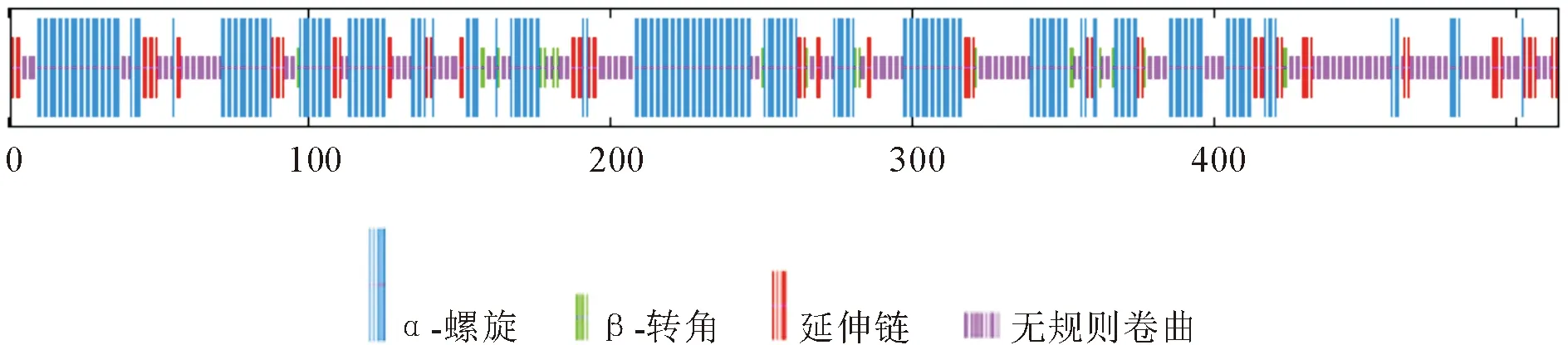
图4 MlpNHA1-like (wh03)蛋白二级结构组成
2.4 目的基因编码蛋白亚细胞定位预测分析
蛋白亚细胞定位的预测可为后续功能研究提供参考。采用4种在线软件EuK-mPLoc、WOLF PSORT、CELLO和PROTCOMP对MlpNHA1-like (wh03)蛋白进行亚细胞定位预测分析。EuK-mPLoc预测结果显示目的蛋白定位在细胞膜(cell membrane)区域。其余3种软件预测结果由计算的数值来反映,数值越高则预测的准确性越大。WOLF PSORT软件预测显示数值明显高的2个区域为质膜(plas:13)和线粒体(mito:9)。CELLO预测结果显示质膜区域数值明显高于其他区域(Plasma Membrane:4.943)。同样,PROTCOMP整体预测结果显示质膜区域数值明显高于其他区域(Plasma Membrane:9.85)。因此,4种软件综合预测显示MlpNHA1-like (wh03)蛋白定位在质膜区域。
结合系统发育分析、序列相似性比对及同源克隆,获得落叶松-杨栅锈菌中国菌株MlpNHA1-like (wh03)基因ORF片段,并对目的基因编码蛋白进行结构和亚细胞定位预测分析。
通过构建系统进化树发现,落叶松-杨栅锈菌ID 45128与酵母菌NHA1所在的同一进化枝被外群卷枝毛霉隔开,并且在该进化枝中供试物种候选基因的进化趋势与供试物种进化趋势一致,该枝内所有候选基因包括ID 45128均与酵母菌NHA1基因互为直系同源基因,将ID 45128命名为MlpNHA1。ID 116278基因为旁系同源基因,由于可能与酿酒酵母NHA1基因有功能保守性,将其命名为MlpNHA1-like。这类NHA1-like基因仅存在于落叶松-杨栅锈菌、松栎柱锈菌和玉米黑粉菌这3种供试担子菌中,在供试的小麦秆锈菌及子囊菌中均发生了缺失。根据系统发育分析结果可知,在担子菌和子囊菌发生分歧前,NHA1基因与NHA1-like基因的分歧就已发生,长时间的分歧下两类基因的功能保守程度有待于进一步的研究。
考虑到酿酒酵母HOG1与NHA1互作并将其磷酸化从而应对外界渗透压胁迫[3],因此将MlpNHA1和MlpNHA1-like都确定为候选基因。根据标准菌株98AG31中目的基因的序列在中国菌株中进行同源克隆,但MlpNHA1的序列不完整,目前MlpNHA1基因还未成功克隆,后续将尝试多种克隆方法以期获得MlpNHA1基因的ORF片段。通过NCBI中GEO DataSets数据库查找标准菌株98AG31中MlpNHA1-like基因(ID 116278)的表达情况[15],显示夏孢子及其萌发阶段的表达量均相对较高(结果未展示)。本研究以中国菌株夏孢子cDNA为模板扩增获得较亮条带,与之较为吻合。比较中国菌株wh03和来自法国的标准菌株98AG31中MlpNHA1-like基因的核苷酸序列,显示二者长度相同,30个核苷酸位点存在差异,相似性为98%,整体较为保守。和之前克隆的MlpMKK1/1基因相比[16],在不同地域菌株中核苷酸差异位点略有增加。
预测分析显示,目的蛋白MlpNHA1-like(wh03)具有与酿酒酵母NHA1蛋白一致的保守结构域c_cpa1。并且,目的蛋白具有系列跨膜结构且与疏水区域位置基本一致,结合酿酒酵母NHA1蛋白特征[17],推断较长的跨膜区域为目的蛋白N端部分;
预测表明其余下游较短部分为亲水区域,推断为目的蛋白C端部分。亚细胞定位预测目的蛋白MlpNHA1-like(wh03)分布在质膜区域,与Western blot检测酿酒酵母NHA1蛋白定位在质膜区域[18]结果一致,同时与预测具有跨膜结构存在也较为吻合。虽然MlpNHA1-like(wh03)基因不是NHA1在落叶松-杨栅锈菌中的直系同源基因,但结合序列比对分析和生物信息学预测分析推断二者具有一定共性存在。酿酒酵母HOG1与NHA1的C端区域互作并将其磷酸化从而即时响应外界渗透压胁迫[3]。在落叶松-杨栅锈菌中,MlpNHA1-like(wh03)能否与MlpHOG1相互作用参与致病过程及包含渗透胁迫在内的各种环境胁迫应答过程,有待后续进一步分析。










