空间导航的脑网络基础和调控机制*
时间:2023-06-29 17:30:03 来源:雅意学习网 本文已影响 人 
孔祥祯 张凤翔 蒲 艺
·研究构想(Conceptual Framework)·
空间导航的脑网络基础和调控机制*
孔祥祯1,2张凤翔1蒲 艺3
(1浙江大学心理与行为科学系, 杭州 310028) (2浙江大学医学院附属邵逸夫医院, 杭州 310058) (3马克斯·普朗克经验美学研究所神经科学系, 法兰克福 60322, 德国)
空间导航在生活中时刻发生, 空间能力衰退是阿尔兹海默症的重要早期表现。早期关于空间导航神经机制的研究主要关注单个脑区的特异性功能, 但这些脑区如何交互以整合不同模态的信息支持复杂导航行为尚不清楚。脑成像技术、脑网络建模方法和神经调控手段的发展, 为在脑网络水平理解人类空间导航的认知神经机制提供了重要研究手段。本研究试图融合空间导航认知神经机制研究的最新进展, 借助脑网络建模、大数据分析、微电流刺激等前沿研究手段, 研究空间导航脑网络的关键拓扑属性特征(如模块化、核心节点等), 探寻该功能特异性神经网络的重要影响因素和调控机制, 并构建空间导航的脑网络理论模型。研究成果将有利于理解人类复杂导航行为的脑网络基础, 为阿尔兹海默症等相关认知障碍脑疾病的筛查和诊断提供重要参考。
空间导航, 脑网络, 神经调控, 神经机制, 认知地图
在熟悉的环境中穿行, 在陌生的环境中寻路, 空间导航活动时刻在我们的生活中发生。对空间的认知被认为是人类认知和智能的“核心知识” (Core Knowledge) (Spelke & Kinzler, 2007)。因此, 研究空间导航的发展、认知神经基础和遗传因素, 对我们理解智能的本质和起源, 有着重要的科学意义。英国伦敦大学学院教授John O"Keefe、挪威科技大学教授May-Britt Moser、Edvard Moser通过对老鼠的电生理实验研究(Fyhn et al., 2004; O"Keefe & Nadel, 1978), 首次发现了构成大脑空间定位系统的功能特异神经元细胞, 开启了理解人类空间导航神经基础的大门。凭借这一发现, 他们获得了2014年诺贝尔生理学或医学奖。此外, 青少年时期的空间能力与其将来能否在科学、技术、工程和数学等理工科领域(STEM)取得更好的学业及职业成就, 有着直接关联(Wai et al., 2009); 而且, 空间导航能力的退化, 又是阿尔兹海默症(Alzheimer"s disease, AD)等与记忆有关的神经退行性疾病的核心临床表现(张家鑫等, 2019; Coughlan et al., 2018)。因此, 对人类空间导航的认知神经和遗传基础的研究具有重要的教育意义和临床价值。
近几十年来, 空间导航研究领域取得了重要进展, 其研究对象涵盖不同动物模型、儿童和成年人, 研究方法涉及行为、电生理记录、功能和结构脑成像等。这些研究成果, 主要集中在对单个脑区特异性功能的刻画, 比如海马(hippocampus)中的位置细胞(place cell)和内嗅皮层(entorhinal cortex)的网格细胞(grid cell)等(Fyhn et al., 2004; O"Keefe & Nadel, 1978); 此外就是利用脑影像的方法, 找到不同脑区的特异性功能, 分别对应空间导航的不同认知成分, 比如位于内嗅皮层的类网格细胞功能和位于旁海马的场景加工脑区(Horner et al., 2016; Zhen et al., 2017)。这些研究, 极大地推进了我们对人类空间导航的认知加工和神经机制的理解(图1) (王欣等, 2018; 许琴等, 2010; Coughlan et al., 2018; Epstein et al., 2017)。
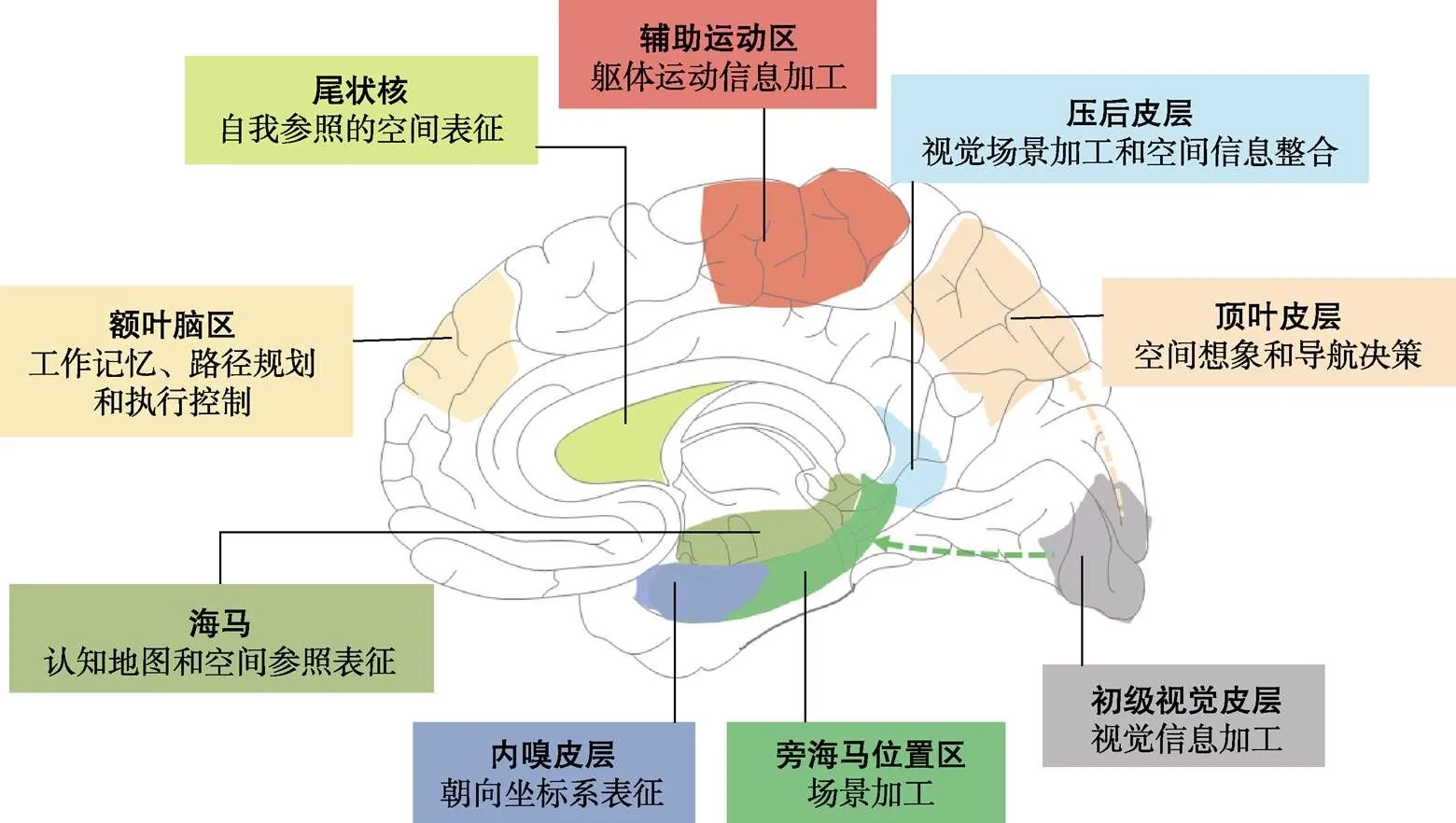
图1 参与空间导航过程的主要脑结构及相关功能
然而, 空间导航是一个复杂的认知过程, 灵活的导航需要多感知模态整合、视空间编码、记忆和决策等多个认知成分的共同参与(Wolbers & Hegarty, 2010; Baumann & Mattingley, 2021)。而且,研究者认为, 这些认知过程并非不同表征模块独立运作(modular processing), 而是一个高度动态、需要整合不同模态信息的加工过程(heuristic processing) (Ekstrom et al., 2017; Kong et al., 2017)。此外, 研究表明, 对导航至关重要的海马, 其功能不仅仅是对位置的表征, 它似乎更像是普遍的粘合剂(“the hippocampus as a binding device”) (Pu et al., 2020; Cornwell et al., 2008; Kessels et al., 2001; Mitchell et al., 2000), 联结了来自其他脑区的不同模态信息, 以支持人类的行为和决策。因此, 研究者指出, 研究空间导航的神经机制不应局限于某个特定脑区(如海马), 而应该从神经环路或网络的角度, 研究不同脑区如何交互以支撑复杂导航行为(Ekstrom et al., 2017; Baumann & Mattingley, 2021; Kong et al., 2017)。目前, 我们对人类大脑空间导航脑网络的架构和运作机制还处于起步阶段, 很多关键问题尚不清楚。例如, 导航脑网络的复杂网络属性(核心节点和模块化)是怎样的?通常被认为对空间导航至关重要的海马结构, 是导航脑网络的核心节点吗?一些与导航和记忆有关的神经退行性疾病, 如阿尔兹海默症, 是否表现出导航脑网络异常?如何实现对导航脑网络的精准调控, 从而改善导航行为表现?
鉴于此, 本项目拟采用跨学科研究手段, 对空间导航的脑网络基础和调控机制进行研究。本项目有望为我们理解空间导航在脑网络水平的神经机制提供新的科学证据, 同时对空间导航脑网络和调控机制的研究, 为研究AD等认知障碍脑疾病提供了新的重要视角, 为早期诊断和精准治疗新方案的提出提供参考。
2.1 脑网络研究方法
随着神经成像技术的不断成熟和普及, 弥散加权成像(diffusion weighted imaging, DWI)、功能磁共振成像(functional magnetic resonance imaging, fMRI)和T1加权成像(T1-weighted MRI)等多种脑影像方法, 在考察多个脑区之间的内在交互研究中得到广泛应用。采用这些成像技术和不同的图像处理算法, 我们可以从白质纤维连接、功能连接、形态学协变关联等不同角度, 考察感兴趣脑区之间的连接特征和脑网络拓扑属性。
白质纤维连接主要采用DWI数据和纤维追踪方法, 可以量化不同脑区之间的白质纤维连接的路径和强度信息(Maier-Hein et al., 2017; Tournier et al., 2019)。功能连接主要采用静息态或任务态fMRI数据, 通过量化不同脑区功能活动相关的时间序列的同步性, 可以用于研究不同脑区之间的功能交互的方向性和强度信息(Kelly et al., 2012; Smith et al., 2013)。结构形态学的协变关联也是一种常用的结构连接建模方法, 其计算过程往往基于大脑结构形态学测量, 比如通过计算两个脑区的形态学测量跨个体或跨时间点的相关性来量化脑区间的共变性(He et al., 2007; Evans, 2013); 也有研究者提出, 通过计算不同脑区形态学测量分布的相似性来量化单被试水平的脑区间结构关联(Kong et al., 2015; Kong et al., 2014)。
基于不同脑连接分析方法可以构建包含多个脑区的连接网络。基于此, 图论和脑连接组学方法提供了一系列针对复杂脑网络整体属性的量化手段, 包括小世界网络、核心节点脑区和模块化等(Zuo et al., 2012; He & Evans, 2010)。结合脑影像技术和脑连接组学方法, 已发表的研究为我们了解人脑全脑水平的网络架构特征提供了重要数据。相关脑成像技术和脑网络分析方法的发展, 也为在脑连接和脑网络水平理解人类空间导航的脑网络基础提供了重要研究手段。
2.2 空间导航的脑网络研究
目前, 仅有较少数研究探索不同脑区如何交互以支持空间导航和记忆, 我们对导航脑网络的组织架构和拓扑属性尚不清楚(Ekstrom et al., 2017; Baumann & Mattingley, 2021; Epstein et al., 2017)。
利用皮层脑电图(electrocortigography, ECoG), Watrous等人研究了颞叶内侧、前额叶和部分顶叶脑区如何实现交互以支持空间和时间记忆(Watrous et al., 2015)。他们发现, 相比较不正确记忆的试次,正确记忆的试次所展现出的脑区之间的功能连接更强。虽然, 由于ECoG的电极覆盖有限, 他们没能记录到其他一些与导航和记忆有关的重要脑区,但他们的研究结果极大地表明脑区之间的协同对导航和记忆至关重要。
为了克服上述ECoG电极覆盖有限的缺点,作者采用大尺度脑影像元分析(meta-analysis) (Yarkoni et al., 2011)对导航相关的脑区进行了全面定位, 并基于此导航脑功能区图谱, 采用功能连接方法考察了空间导航脑网络在无任务状态(静息态)时的网络拓扑属性(如核心节点和模块化等)及其行为学相关(Kong et al., 2017)。与以往脑网络研究中所采用的全脑网络方法不同, 该研究首先利用几十年关于空间导航的神经影像学研究成果(截止到2014年11月), 基于大尺度元分析定位导航相关的功能脑区, 并以此为节点, 结合静息态fMRI对空间导航脑网络进行建模和分析。研究结果显示, 基于静息态fMRI的空间导航脑网络, 表现出小世界和模块化的组织特征。此外, 近年来, 研究者不断认识到压后皮层(retrosplenial cortex, RSC)在空间导航中的关键作用, 提出了RSC作为导航网络核心节点(而非海马)的理论预测(Ekstrom et al., 2017; Weisberg & Ekstrom 2021)。该理论对于理解人类空间导航脑网络的认知和计算机制具有重要的意义, 但还尚待进一步验证。在前期的初步研究中, 我们发现, RSC在基于静息态fMRI构建的导航脑网络中表现出最高的中介度(betweenness), 并且RSC的核心程度在个体间的差异与自我报告的导航能力显著正相关(Kong et al., 2017)。这些研究结果为以RSC作为导航网络核心节点的理论预测提供了重要实证数据。该研究为我们理解空间导航的脑网络基础迈出了关键一步。
近十年来, 有更多关于空间导航的脑影像研究发表, 这些最新的研究为我们定位导航相关脑功能区提供了新的重要数据。在本项目中, 将最新的脑影像研究成果整合到元分析中, 从而对导航相关脑功能区进行更新。这些更新后的脑区定位可以帮助我们对导航脑网络进行更精准地建模和分析。
2.3 直接电刺激调控大脑活动
直接电刺激通过植入的电极将电流施加在大脑的特定区域, 是调控神经活动的新的有效方法(Hescham et al., 2020)。直接电刺激是治疗帕金森患者运动失能(Benabid et al., 1991; Bronstein et al., 2011)和确定癫痫发作部位(Fisher et al., 2010; McIntyre & Hahn, 2010)的标准方法, 也被用于探索强迫症等一些精神障碍疾病的诊疗方案(Greenberg et al., 2006)。直接电刺激作用效果的底层机制可能与其通过电流刺激打破了脑网络的失能状态有关(Ezzyat et al., 2018)。在关于脑功能的基础研究方面, 研究者利用癫痫病人术前植入的深度电极,采用iEEG和直接电刺激方法调控海马和内嗅皮层的活动, 考察对导航行为或记忆能力的影响。例如, Suthana等人在导航学习阶段, 给5名术前癫痫病人内嗅皮层和海马连续施加50 Hz的微电流, 他们发现, 相较于没有电流刺激的条件, 刺激病人的内嗅皮层后导航行为有明显提高; 然而, 刺激海马的条件下病人的导航能力却没有明显变化(Suthana et al., 2012)。但在随后一个更大规模的实验里, 研究者发现, 不管刺激内嗅皮层还是海马, 均会使导航行为表现显著降低(Jacobs et al., 2016)。
在不同研究中, 直接电刺激对行为产生了不同的影响, 其原因也尚不明确(Mohan et al., 2020)。可能的因素包括不同研究中采用的刺激靶点脑区、刺激强度和频率、行为范式等方面的异质性。因此, 目前我们对如何精准地调控大脑以改善认知功能还知之甚少。这些亟待解决的关键核心问题包括:如何选择直接电刺激的靶点脑区以达到最佳的调控效果、刺激特定脑区对脑认知网络的动态影响以及刺激引起的脑网络的变化和行为改变的对应关系等。为此, 本项目将以得到的空间导航脑网络模型作为指导, 选取导航脑网络中的核心节点脑区和与之连接的白质纤维作为靶点进行微电流刺激, 结合iEEG脑活动记录, 探索核心节点脑区对导航网络动态和导航行为的调控机制。
本项目将采用行为学测试、多模态磁共振脑成像技术、计算建模与机器学习、脑网络组学和神经调控技术等跨学科研究方法, 结合大样本开放数据库, 研究空间导航的脑网络基础及其调控机制。
3.1 研究1:空间导航脑网络的定位和建模
本部分我们将重点关注空间导航脑网络的定位、网络建模和复杂网络分析, 以揭示空间导航脑网络的空间分布和核心节点、模块化等复杂网络拓扑属性, 以及不同模态网络之间的交互关系。具体包括:1) 调研空间导航相关的神经影像研究, 采用大尺度脑影像元分析方法, 对研究文献中报告的功能激活坐标进行元分析, 形成空间导航的脑功能区分布图。进而, 参照大脑解剖先验知识和大脑分割图谱(atlas), 完成相关脑区的分割和命名, 形成空间导航脑功能区图谱。2) 基于得到的导航脑功能区图谱, 结合不同模态磁共振图像, 建立多模态脑网络:结合弥散磁共振成像数据和纤维追踪技术, 量化脑区间白质纤维连接, 构建白质连接网络; 结合静息态功能磁共振成像数据和功能连接方法, 量化脑区间功能连接, 构建功能连接网络; 结合结构磁共振脑成像数据和脑形态学分析方法, 采用作者在已有研究中提出的个体形态学相似性脑网络算法, 构建空间导航脑网络的形态学网络。3).采用复杂网络研究方法, 考察不同模态空间导航脑网络的核心节点、模块化等拓扑特征。采用多元统计方法考察不同模态导航脑网络的相似性, 考察功能网络与结构网络之间的交互关系。
3.2 研究2:空间导航脑网络的影响因素
本部分我们将采用大样本公开数据库(UK Biobank), 通过关联导航脑网络的拓扑属性指标与早期生活经历、全基因组数据, 探索该功能网络的早期生活经历因素和遗传基础。具体包括:1) 考察导航脑网络的拓扑属性指标与性别和出生地(城市或乡村)、家庭经济状况、饮食和酒精摄入等早期生活经历之间的关系; 2) 基于全基因组关联分析和遗传学功能分析, 考察导航脑网络的遗传基础, 探索导航脑网络的候选基因和通路。
3.3 研究3:空间导航脑网络的调控机制
本部分我们将结合前沿的iEEG和直接电刺激技术, 以本项目得到的空间导航脑网络模型为指导, 探索导航脑网络核心节点对网络状态和导航行为表现的调控作用。具体包括:1) 基于癫痫病人术前植入的深度电极(depth electrode), 记录导航脑网络相关脑区的颅内脑电活动, 并采用直接电刺激技术, 考察不同靶点脑区对网络状态的调控作用; 2) 基于癫痫病人术前植入的深度电极, 采用直接电刺激技术, 考察不同靶点脑区对导航行为表现的调控作用。在本部分研究中, 刺激靶点脑区的选择是关键。考虑到网络模型中核心节点的关键作用, 该研究中靶点脑区选择将主要参考上述研究建立的导航脑网络模型中识别出的核心节点。根据已有实验数据和相关理论假设, 海马(“the hippocampus as a binding device”) (Kessels et al., 2001; O’Reilly et al., 2022)和RSC (负责不同子系统的信息整合) (Ekstrom et al., 2017)是目前我们最感兴趣的靶点脑区。研究实施过程中, 靶点脑区和其他相关参数将结合最新的研究进展最终确定。
空间认知是人类认知和智能的“核心知识”, 空间导航能力缺陷被认为是AD的关键认知生物学标志物。揭示人类空间导航的认知神经机制和遗传基础, 不仅在心理学、认知神经科学、脑科学和医学等领域具有重要的科学意义, 同时也具有重要的教育意义和应用价值。
已有研究通常关注海马、内嗅皮质等单个脑区的功能特异性, 因此在传统理论中多局限于单个脑区在空间导航过程中的功能。空间导航是一个复杂的认知过程, 近年来, 研究者指出, 研究空间导航的神经机制不应局限于某个特定脑区(如海马), 而应该从神经环路或网络的角度, 研究不同脑区如何交互以支撑复杂导航行为(Ekstrom et al., 2017; Baumann & Mattingley, 2021; Kong et al., 2017; Weisberg & Ekstrom, 2021)。本项目打破传统的局限于单个脑区功能特异性的研究视角, 采用跨学科的研究手段和计算方法, 对空间导航的脑网络基础进行研究, 有望识别出空间导航脑网络的关键拓扑属性(如模块化和核心节点脑区等), 揭示导航网络中不同模块的内部结构特征和功能意义, 以及关键核心节点的分布特点, 这些结果对于构建空间导航的脑网络理论模型可以提供重要数据(图2)。以导航脑网络核心节点脑区为例, 近年来, 研究者基于RSC在空间导航中的关键作用, 提出了RSC作为导航脑网络核心脑区的理论假设(Ekstrom et al., 2017), 我们预期, 本研究的成果将为进一步检验和完善相关理论提供多个方面的实证数据。同时, 在此基础上, 我们将以导航脑网络的核心节点脑区为直接电刺激靶点, 结合基于磁共振技术的功能连接和白质纤维追踪技术, 探索靶点对导航脑网络的网络动态和导航行为的调控机制。完善的空间导航脑网络理论模型的建立, 可以催生大量重要的研究工作, 以解决新的关键科学问题。例如, 导航脑网络中不同功能模块的具体功能如何?不同模块之间的交互在不同导航任务下是如何动态变化的?交互动态的异常是否会导致脑疾病的产生?
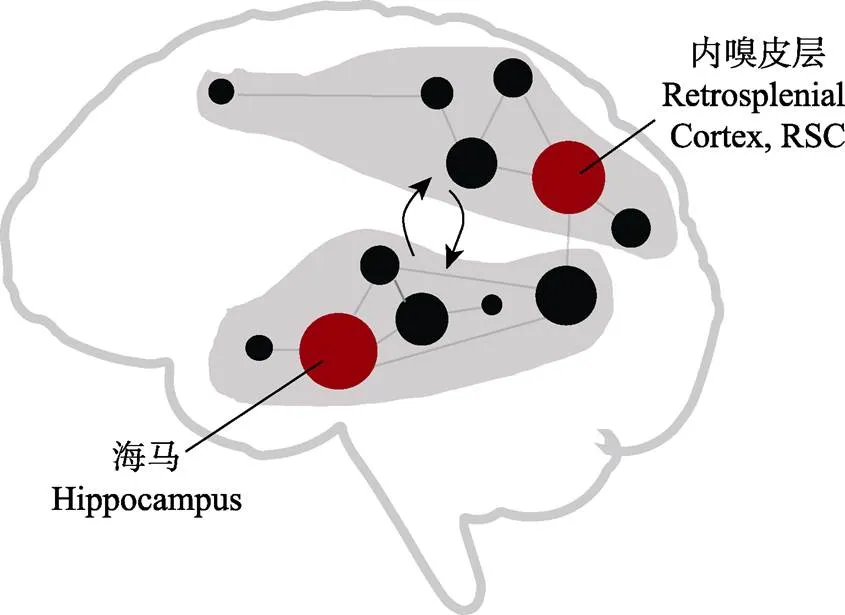
图2 空间导航的脑网络模型示意图(灰色区块为可能存在的功能模块, 红色圆点为可能的核心节点脑区, 灰色箭头为不同功能模块间动态交互)
基于诸多细胞水平的研究发现, 研究者提出了整合位于不同脑区的不同类型神经细胞加工的向量编码理论模型, 试图揭示空间信息不同要素神经表征的统一机制(Bicanski & Burgess, 2020)。这些模型为我们更好地理解空间导航脑网络中不同节点脑区、不同功能模块之间的交互以及这些交互的功能意义, 提供了重要视角; 同时, 导航脑网络模型的建立, 又可以进一步帮助我们在神经环路和网络水平验证和理解这些计算理论。
此外, 大量研究表明, 空间导航能力衰退是AD等认知障碍的重要早期行为表现; 同时, 参与空间导航的重要脑区与早期AD影响的脑区大量重叠。随着社会老龄化, AD等老年痴呆症已经成为严重的健康、经济和社会问题。由北京宣武医院主导的一项最新大规模调查显示, 在我国60岁以上人群中有约1000万AD患者, 占比约为4% (Jia et al., 2020)。关于空间导航的脑网络的研究成果, 将帮助我们从脑认知网络的角度, 理解老龄化与相关脑疾病的底层神经机制, 帮助我们更好地开发新的诊断和干预策略, 以阻断或减缓疾病的发展, 推迟并降低发病率。目前, 针对AD的神经调控研究还相对比较初步, 且多采用TMS、tDCS等无创调控技术。这些技术在研究脑网络的调控机制中, 尤其是以深部脑结构为靶点脑区时, 具有很大的局限性。因此, 本项目选用更为直接、精准的直接电刺激技术, 探索特定脑结构对导航脑网络的调控机制。虽然, 该神经调控研究在癫痫患者中进行, 相关研究成果一方面将帮助我们理解导航脑网络的调控机制, 同时将为AD等空间导航损伤相关的脑疾病的干预和治疗提供重要参考。
综上所述, 本项目采用跨学科研究方法, 对空间导航的脑网络基础和调控机制进行研究。研究成果将为我们理解空间导航的神经环路机制、影响因素, 以及脑认知网络与行为之间的因果关系提供重要科学证据; 同时, 导航脑网络模型及其调控机制为研究AD等认知障碍脑疾病提供了新的重要的视角, 为早期诊断和精准治疗新方案的提出提供参考, 符合国家重大战略需求。
王欣, 武文博, 李竹, 王涛, 张鑫, 青钊, 张冰. (2018). 网格细胞的电生理及脑功能成像研究进展.,(5), 381–385.
许琴, 罗宇, 刘嘉. (2010). 方向感的加工机制及影响因素.,(8), 1208–1221.
张家鑫, 海拉干, 李会杰. (2019). 空间导航的测量及其在认知老化中的应用.,(12), 2019–2033.
Baumann, O., & Mattingley, J. B. (2021). Extrahippocampal contributions to spatial navigation in humans: A review of the neuroimaging evidence.,(7), 640–657.
Benabid, A. L., Pollak, P., Gervason, C., Hoffmann, D., Gao, D. M., Hommel, M., Perret, J. E., & de Rougemont, J. (1991). Long-term suppression of tremor by chronic stimulation of the ventral intermediate thalamic nucleus.,(8738), 403–406.
Bicanski, A., & Burgess, N. (2020). Neuronal vector coding in spatial cognition.(9), 453–470.
Bronstein, J. M., Tagliati, M., Alterman, R. L., Lozano, A. M., Volkmann, J., Stefani, A., ... DeLong, M. R. (2011). Deep brain stimulation for Parkinson disease: An expert consensus and review of key issues.,(2), 165. https://doi.org/10.1001/archneurol.2010.260.
Cornwell, B. R., Johnson, L. L., Holroyd, T., Carver, F. W., & Grillon, C. (2008). Human hippocampal and parahippocampal theta during goal-directed spatial navigation predicts performance on a virtual Morris water maze.,(23), 5983–5990.
Coughlan, G., Laczó, J., Hort, J., Minihane, A. M., & Hornberger,M. (2018). Spatial navigation deficits - overlooked cognitive marker for preclinical Alzheimer disease?,(8), 496–506. https://doi.org/10.1038/s41582- 018-0031-x
Ekstrom, A. D., Huffman, D. J., & Starrett, M. (2017). Interacting networks of brain regions underlie human spatial navigation: A review and novel synthesis of the literature.,(6), 3328–3344. https://doi.org/10.1152/jn.00531.2017
Epstein, R. A., Patai, E. Z., Julian, J. B., & Spiers, H. J. (2017). The cognitive map in humans: Spatial navigation and beyond.,(11), 1504–1513. https://doi.org/10.1038/nn.4656
Evans, A. C. (2013). Networks of anatomical covariance.,, 489–504. https://doi.org/10.1016/j.neuroimage. 2013.05.054
Ezzyat, Y., Wanda, P. A., Levy, D. F., Kadel, A., Aka, A., Pedisich, I., ... Kahana, M. J. (2018). Closed-loop stimulation of temporal cortex rescues functional networks and improves memory.,(1), 365. https://doi.org/10.1038/s41467-017-02753-0
Fisher, R., Salanova, V., Witt, T., Worth, R., Henry, T., Gross, R., ... Group, S. S. (2010). Electrical stimulation of the anterior nucleus of thalamus for treatment of refractory epilepsy.,(5), 899–908. https://doi.org/10. 1111/j.1528-1167.2010.02536.x
Fyhn, M., Molden, S., Witter, M. P., Moser, E. I., & Moser, M. B. (2004). Spatial representation in the entorhinal cortex.,(5688), 1258–1264.
Greenberg, B. D., Malone, D. A., Friehs, G. M., Rezai, A. R., Kubu, C. S., Malloy, P. F., … Rasmussen, S. A. (2006). Three-year outcomes in deep brain stimulation for highly resistant obsessive-compulsive disorder.,(11), 2384–2393. https://doi.org/10.1038/sj.npp.1301165
He, Y., Chen, Z. J., & Evans, A. C. (2007). Small-world anatomical networks in the human brain revealed by cortical thickness from MRI.,(10), 2407–2419.
He, Y., & Evans, A. (2010). Graph theoretical modeling of brain connectivity.,(4), 341–350. https://doi.org/10.1097/WCO.0b013e32833aa567
Hescham, S., Liu, H., Jahanshahi, A., & Temel, Y. (2020). Deep brain stimulation and cognition: Translational aspects.,, 107283. https://doi.org/10.1016/j.nlm.2020.107283
Horner, A. J., Bisby, J. A., Zotow, E., Bush, D., & Burgess, N. (2016). Grid-like processing of imagined navigation.,(6), 842–847.
Jacobs, J., Miller, J., Lee, S. A., Coffey, T., Watrous, A. J., Sperling, M. R., … Rizzuto, D. S. (2016). Direct electrical stimulation of the human entorhinal region and hippocampus impairs memory.,(5), 983–990. https://doi.org/ 10.1016/j.neuron.2016.10.062
Jia, L., Du, Y., Chu, L., Zhang, Z., Li, F., Lyu, D., ... Qiu, Q. (2020). Prevalence, risk factors, and management of dementia and mild cognitive impairment in adults aged 60 years or older in China: A cross-sectional study.(12), e661–e671.
Kelly, C., Biswal, B. B., Craddock, R. C., Castellanos, F. X., & Milham, M. P. (2012). Characterizing variation in the functional connectome: Promise and pitfalls.,(3), 181–188.
Kessels, R. P., de Haan, E. H., Kappelle, L. J., & Postma, A. (2001). Varieties of human spatial memory: A meta-analysis on the effects of hippocampal lesions.(3), 295–303.
Kong, X. Z., Liu, Z. G., Huang, L. J., Wang, X., Yang, Z. T., Zhou, G. F., Zhen, Z. L., & Liu, J. (2015). Mapping individual brain networks using statistical similarity in regional morphology from MRI.,(11), e0141840.
Kong, X. Z., Wang, X., Huang, L., Pu, Y., Yang, Z., Dang, X., Zhen, Z., & Liu, J. (2014). Measuring individual morphological relationship of cortical regions.,, 103–107.
Kong, X. Z., Wang, X., Pu, Y., Huang, L., Hao, X., Zhen, Z., & Liu, J. (2017). Human navigation network: The intrinsic functional organization and behavioral relevance.,(2), 749–764. https://doi.org/ 10.1007/s00429-016-1243-8
Maier-Hein, K. H., Neher, P. F., Houde, J. C., Côté, M. A., Garyfallidis, E., Zhong, J., ... Descoteaux, M. (2017). The challenge of mapping the human connectome based on diffusion tractography.,(1), 1349. https://doi.org/10.1038/s41467-017-01285-x
McIntyre, C. C., & Hahn, P. J. (2010). Network perspectives on the mechanisms of deep brain stimulation.,(3), 329–337. https://doi.org/10.1016/j.nbd.2009. 09.022
Mitchell, K. J., Johnson, M. K., Raye, C. L., & D"Esposito, M. (2000). fMRI evidence of age-related hippocampal dysfunction in feature binding in working memory.,(1-2), 197–206. https://doi.org/10.1016/ s0926-6410(00)00029-x
Mohan, U. R., Watrous, A. J., Miller, J. F., Lega, B. C., Sperling, M. R., Worrell, G. A., … Jacobs, J. (2020). The effects of direct brain stimulation in humans depend on frequency, amplitude, and white-matter proximity.,(5), 1183–1195. https://doi.org/10.1016/j. brs.2020.05.009
O"Keefe, J., & Nadel, L. (Eds.). (1978).. London, Clarendon Press.
O’Reilly, R. C., Ranganath, C., & Russin, J. L. (2022). The structure of systematicity in the brain.,(2), 124–130.
Pu, Y., Cheyne, D., Sun, Y., & Johnson, B. W. (2020). Theta oscillations support the interface between language and memory.,, 1–12.
Smith, S. M., Vidaurre, D., Beckmann, C. F., Glasser, M. F., Jenkinson, M., Miller, K. L., … van Essen, D. C. (2013). Functional connectomics from resting-state fMRI.,(12), 666–682. https://doi.org/10. 1016/j.tics.2013.09.016
Spelke, E. S., & Kinzler, K. D. (2007). Core knowledge.,(1), 89–96.
Suthana, N., Haneef, Z., Stern, J., Mukamel, R., Behnke, E., Knowlton, B., & Fried, I. (2012). Memory enhancement and deep-brain stimulation of the entorhinal area.,(6), 502–510. https://doi. org/10.1056/NEJMoa1107212
Tournier, J. D., Smith, R., Raffelt, D., Tabbara, R., Dhollander, T., Pietsch, M., … Connelly, A. (2019). MRtrix3: A fast, flexible and open software framework for medical image processing and visualisation.,, 116137. https://doi.org/10.1016/j.neuroimage.2019.116137
Wai, J., Lubinski, D., & Benbow, C. P. (2009). Spatial ability for STEM domains: Aligning over 50 years of cumulative psychological knowledge solidifies its importance.,(4), 817–835.
Watrous, A. J., Deuker, L., Fell, J., & Axmacher, N. (2015). Phase-amplitude coupling supports phase coding in human ECoG.,, e07886. https://doi.org/10.7554/ eLife.07886
Weisberg, S. M., & Ekstrom, A. D. (2021). Hippocampal volume and navigational ability: The map (ping) is not to scale.,, 102–112. https://doi.org/10.1016/j.neubiorev.2021.03.012
Wolbers, T., & Hegarty, M. (2010). What determines our navigational abilities?,(3), 138–146.
Yarkoni, T., Poldrack, R. A., Nichols, T. E., van Essen, D. C., & Wager, T. D. (2011). Large-scale automated synthesis of human functional neuroimaging data.,(8), 665–670.
Zhen, Z., Kong, X. Z., Huang, L., Yang, Z., Wang, X., Hao, X., Huang, T., Song, Y., & Liu, J. (2017). Quantifying the variability of scene-selective regions: Interindividual, interhemispheric, and sex differences.,(4), 2260–2275. https://doi.org/10.1002/hbm. 23519
Zuo, X. N., Ehmke, R., Mennes, M., Imperati, D., Castellanos, F. X., Sporns, O., & Milham, M. P. (2012). Network centrality in the human functional connectome.,(8), 1862–1875.
The functional brain network that supports human spatial navigation
KONG Xiang-Zhen1,2, ZHANG Fengxiang1, PU Yi3
(1Department of Psychology and Behavioral Sciences, Zhejiang University, Hangzhou 310028, China) (2Department of Psychiatry of Sir Run Shaw Hospital, Zhejiang University School of Medicine, Hangzhou 310058, China) (3Department of Neuroscience, Max Planck Institute for Empirical Aesthetics, Frankfurt am Main, 60322, Germany)
The system for representing space is one of the core knowledge systems in the human brain. Spatial navigation is emerging as a potential cost-effective cognitive biomarker to detect Alzheimer’s disease (AD) in the preclinical stages. Previous work has revealed multiple regions across the brain associated with human navigation. However, little is known about how these regions work together as a network (referred to as navigation network) to support flexible navigation behaviors. This work presents a conceptual framework for research on how the brain network supports human spatial navigation. Integrative approaches including behavioral testing, computational modeling of brain networks, and brain stimulation were proposed to apply. The results are expected to help elucidate the neural network mechanisms of flexible navigation behaviors in human, and also provide new insights into more efficient prevention and diagnosis of AD.
spatial navigation, brain networks, brain stimulation, neuronal basis, cognitive map
2022-08-19
*国家自然科学基金(32171031)和中央高校基本科研业务费专项资金(2021XZZX006)资助。
孔祥祯, E-mail: xiangzhen.kong@zju.edu.cn
B845.1
猜你喜欢脑区调控神经神经松动术在周围神经损伤中的研究进展实用手外科杂志(2022年2期)2022-08-31中西医结合治疗桡神经损伤研究进展现代临床医学(2022年1期)2022-02-12脑自发性神经振荡低频振幅表征脑功能网络静息态信息流浙江大学学报(理学版)(2021年1期)2021-01-26如何调控困意学苑创造·A版(2020年12期)2020-01-07经济稳中有进 调控托而不举中国外汇(2019年15期)2019-10-14说谎更费脑细胞祝您健康·文摘版(2017年8期)2017-04-06顺势而导 灵活调控作文教学研究(2016年1期)2016-07-05“神经”病友Coco薇(2015年5期)2016-03-29七氟烷对幼鼠MAC的测定及不同脑区PARP-1的影响首都医科大学学报(2015年4期)2015-12-16SUMO修饰在细胞凋亡中的调控作用医学研究杂志(2015年8期)2015-06-22








