滋膵通脉饮对糖尿病心肌病大鼠糖脂代谢及氧化应激的影响*
时间:2023-06-27 19:10:02 来源:雅意学习网 本文已影响 人 
李汶珊,易晓利,卜献春,袁春云,刘佳琴,吴刚强,毛叶,陈琪,谭军
(1.湖南中医药大学,湖南 长沙 410208;
2.长沙卫生职业学院,湖南 长沙 410100;
3.湖南省中医药研究院附属医院,湖南 长沙 410006)
糖尿病患病率逐年上升,目前已经成为影响人类身体健康的第三大慢性非传染性疾病[1]。糖尿病心肌病(diabetic cardiomyopathy,DCM)是糖尿病最严重的并发症之一,是糖尿病引起死亡的主要原因[2]。心肌纤维化是DCM的主要病理改变,长期糖脂代谢紊乱导致蛋白激酶C(protein kinase C,PKC)激活及引起氧化应激损伤是导致心肌纤维化的主要因素[3]。因此,积极纠正糖脂代谢紊乱引起的一系列病理反应是抗心肌纤维化的关键[4],对治疗及延缓DCM发生及发展具有重大临床意义。
中医学认为DCM病因病机主要以气阴两虚为本,瘀阻血脉为标,益气养阴、活血通络为其主要治法。多项研究显示,益气养阴活血化瘀法治疗DCM疗效显著[5-6]。滋膵通脉饮是治疗气阴两虚、瘀血阻络型糖尿病及并发症的有效方药,前期临床观察显示,滋膵通脉饮能有效改善DCM患者临床症状,但其具体机制不明确[7-9]。本研究拟建立DCM大鼠模型,从糖脂代谢紊乱、氧化应激损伤及PKC-β激活探讨滋膵通脉饮治疗DCM作用机制,为进一步临床应用提供参考。
1.1 实验动物 6周龄SPF级雄性SD大鼠51只,体质量180~200 g,由湖南斯莱克景达实验动物有限公司提供,许可证号:SCXK(湘)2019-0004,常规条件饲养,室温为20~23 ℃,湿度为50%~65%,自然采光。本实验通过湖南省中医药研究院动物实验伦理审查,伦理编号:2021-0018。
1.2 药物与试剂 滋膵通脉饮,方药组成:黄芪10 g,地龙10 g,生蒲黄15 g,生地黄15 g,水蛭6 g,僵蚕10 g,麦冬10 g,丹参20 g,川芎10 g,玄参10 g,山茱萸10 g,天花粉10 g,鬼箭羽15 g,全蝎3 g,山楂15 g。以上中药颗粒均购自湖南省中医药研究院附属医院康仁堂药房,由杨华主管中药师鉴定合格。通过水溶解法进行滋膵通脉饮药液的提取制备。PKC-βⅡ抑制剂[Ruboxistaurin(LY333531)HCl](目录号:S7663,批次:01)、羧甲基纤维素钠(CMC-Na)(目录号:S6703,批次:04)均购自上海蓝木化工有限公司;
链脲佐菌素(streptozotocin,STZ)(批号:301A0214)、0.1 mol/L柠檬酸缓冲液(批号:20210429)均购自北京索莱宝科技有限公司;
空腹胰岛素(FINS)ELISA试剂盒(批号:21AUURI801A)购自CRYSTAL CHEM INC;
糖化血红蛋白(GHb)试剂盒(批号:20210701)、甘油三酯(TG)试剂盒(批号:20210625)、总胆固醇(T-CHO)试剂盒(批号:20210625)、低密度脂蛋白胆固醇(LDL-C)试剂盒(批号:20210625)、微量丙二醛(MDA)试剂盒(批号:20210622)均购自南京建成生物工程研究所;
超氧化物歧化酶(SOD)试剂盒(批号:TM703)购自东仁化学科技上海有限公司;
PKC-βⅡ一抗(批号:GR204604-2)购自英国abcam公司;
5%多聚甲醛(批号:WB03004)、戊二醛溶液(2.5%)(批号:WB01026A2)均购自Wellbioscience公司;
水合三氯乙醛(批号:F2103035)购自上海阿拉丁生化科技股份有限公司。
1.3 主要仪器 JJ224BC型电子天平(美国双杰);
EZ-7 Lite型血糖仪、H1型血糖试条(北京华益精点生物技术有限公司);
注式soft型一次性使用采血针(施莱医疗);
H1650R型台式冷冻离心机(湖南湘仪实验室仪器开发有限公司);
TS-1型摇床、GL-88B型旋涡混合器(江苏其林贝尔仪器公司);
DYY-6C型电泳仪、DYCZ-24DN型电泳槽、DYCZ-40D型转膜仪、DYY-6C型恒温箱(北京六一生物科技有限公司);
JB-13型磁力搅拌器、PHS-3C型精密pH计(雷磁上海仪电科学仪器股份有限公司);
BCD-196A型普通冰箱(奥克斯集团有限公司);
HD4925型电磁炉(荷兰飞利浦);
BioPrep-24型生物样品均质仪(杭州奥盛仪器有限公司);
MM721AAU-PW型微波炉(美的集团有限公司);
M199型切片刀(德国莱卡公司);
YD-315型切片机(金华益迪医疗设备有限公司);
BMJ-A型包埋机(常州中威电子仪器有限公司);
BA210T型显微镜(麦克奥迪);
DY89-1型盖玻片、AY89-2型载玻片(海门市远泰实验器材厂)。
1.4 造模与分组 51只大鼠适应性喂养1周后,按随机数字表法抽取9只作为空白对照组,采用普通饲料喂养;
剩余42只大鼠造模。采用高糖高脂饲料(猪油10%+胆固醇2%+胆酸盐0.5%+蔗糖20%+普通饲料67.5%)饮食,连续喂养5周。42只大鼠隔夜禁食不禁水12 h以上,1%的STZ溶液(将STZ置于pH=4.3的柠檬酸缓冲液中),以35 mg/kg单次腹腔注射,建立2型糖尿病模型。空白对照组大鼠腹腔注射等体积柠檬酸缓冲液。注射STZ后第1天及第3天2次随机血糖均≥16.7 mmol/L即提示造模成功[10]。造模过程中有3只大鼠死亡,主要死亡原因为感染。造模成功39只,造模成功率为92.9%(39/42),再用高脂饲料喂养2周,以强化胰岛素抵抗模型[11]。为保证各组样本量一致性,从造模成功的大鼠中采用随机数字表法抽取36只分为模型组、Rx抑制剂组、滋膵通脉饮高剂量组、滋膵通脉饮低剂量组,每组9只;
剩余未入组3只大鼠采用按0.5 mL/100 g剂量腹腔注射10%水合氯醛麻醉处死。
1.5 实验给药 滋膵通脉饮含生药量169 g,参照70 kg成人和200 g大鼠体表面积比值为0.018换算,滋膵通脉饮高、低剂量组灌胃给予滋膵通脉饮药液,给药剂量分别为60.84、15.21 g/kg(相当于临床成人用量的9.64、2.41 g/kg),高剂量为低剂量的4倍;
Rx抑制剂组大鼠灌胃给予Rx抑制剂混悬液(将Rx抑制剂用0.5%CMC-Na溶液配制成混悬液),给药剂量为1 mg/kg,模型组和空白对照组大鼠灌胃给予等体积的蒸馏水,5组大鼠灌胃容量均为10 mL/kg,2次/d(08:00:00和17:00:00各给药1次),连续给药4周。
1.6 观察指标
1.6.1 一般情况观察 分别于治疗前后(造模成功后和治疗4周后)在自然光下观察各组大鼠的精神状态、活动度、皮毛颜色、亮度、柔顺度、饮食量及尿量等。
1.6.2 体质量 分别于治疗前后用天平测各组大鼠体质量,抓取手法严格按照《实验动物的抓取与固定操作规程》进行,读取稳定数值,若数值难以稳定,读取中间数值。
1.6.3 空腹血糖(fiber bragg grating,FBG)分别于治疗前后采用葡萄糖氧化酶法测定各组大鼠FBG水平。
1.6.4 空腹胰岛素(fasting serum lisulin,FINS)、胰岛素抵抗指数(HOMA-IR)和糖化血红蛋白(hemoglobin A1C,HbA1C)治疗4周后,分别采用各试剂盒检测各组大鼠FINS水平及HbA1C水平,具体操作步骤严格按照试剂盒说明书进行,并通过FBG及FINS计算胰岛素抵抗指数(HOMA-IR),HOMA-IR=[(FBG×FINS)/22.5]。
1.6.5 甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,T-CHO)、低密度脂蛋白(low density lipoprotein-cholesterol,LDL-C)治疗4周后,分别采用各试剂盒检测各组大鼠TG、T-CHO及LDL-C水平,具体操作步骤严格按照试剂盒说明书进行。
1.6.6 超氧化物歧化酶(superoxide dismutase,SOD)及丙二醛酸(malondialuronic acid,MDA)治疗4周后,分别采用各试剂盒检测各组大鼠SOD及MDA水平,具体操作步骤严格按照试剂盒说明书进行。
1.6.7 心肌组织PKC-βⅡ蛋白表达水平比较 取0.026 g心肌组织用冰预冷,PBS洗涤后放入均质仪中,加入300 μL RIPA裂解液反复研磨、裂解、离心,提取心肌组织中总蛋白。BCA法测蛋白浓度,取200 μL冷却蛋白上清液按比例加入5×SDS蛋白变性液50 μL,沸水浴5 min后备用。制胶后加入上述变性的蛋白样本进行电泳,电泳结束后转膜,用PBST洗膜,室温下封闭液封闭过夜,次日将膜与一抗(1:2 000)室温孵育90 min,PBST洗3次,15 min/次,将稀释后的二抗与膜共同室温孵育90 min,PBST洗3次,10 min/次。使用ECL化学发光液与膜孵育1 min,用滤纸吸干残余液体,封膜后在凝胶成像系统中成像,用Alpha软件分析光密度值。
1.6.8 心肌组织病理改变情况 取心肌组织冲洗、烤片、切片并脱腊,苏木素染10 min,蒸馏水冲洗,PBS返蓝;
伊红染5 min,蒸馏水冲洗;
梯度乙醇溶液(100%、100%、95%、85%、75%乙醇)脱水,每级5 min。取出后置于二甲苯中透明2次,10 min/次,中性树胶封片,显微镜下观察病理变化。
1.7 统计学方法 采用SPSS 25.0统计软件进行分析,计量资料以“均数±标准差”(±s)表示,满足正态分布,方差齐多组间比较采用单因素方差分析,组间比较用LSD-t检验,方差不齐采用Games Howell检验;
不满足正态分布时采用Kruskal-Wallis H检验。P<0.05为差异有统计学意义。
2.1 各组大鼠治疗前后体质量比较 治疗前,与空白对照组比较,模型组、Rx抑制剂组和滋膵通脉饮高、低剂量组大鼠体质量均明显降低(P<0.05)。治疗后,与空白对照组比较,模型组大鼠体质量明显降低(P<0.05);
与模型组比较,Rx抑制剂组和滋膵通脉饮高、低剂量组大鼠体质量均明显升高(P<0.05);
与Rx抑制剂组比较,滋膵通脉饮高、低剂量组大鼠体质量均明显升高(P<0.05)。(见图1)
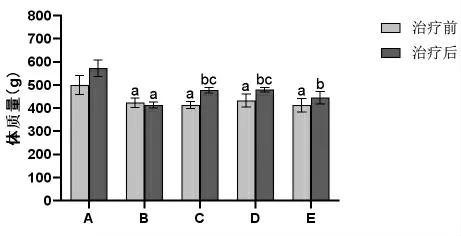
图1 各组大鼠治疗前后体质量比较(±s,n=9)
2.2 各组大鼠治疗前后空腹血糖比较 治疗前,与空白对照组比较,模型组、Rx抑制剂组和滋膵通脉饮高、低剂量组大鼠空腹血糖均明显升高(P<0.05)。治疗后,与空白对照组比较,模型组大鼠空腹血糖明显升高(P<0.05);
与模型组比较,Rx抑制剂组和滋膵通脉饮高、低剂量组大鼠空腹血糖均明显降低(P<0.05);
与Rx抑制剂组比较,滋膵通脉饮高、低剂量组大鼠空腹血糖明显降低(P<0.05),且滋膵通脉饮高剂量组大鼠空腹血糖与滋膵通脉饮低剂量组比较,差异无统计学意义(P>0.05)。(见图2)
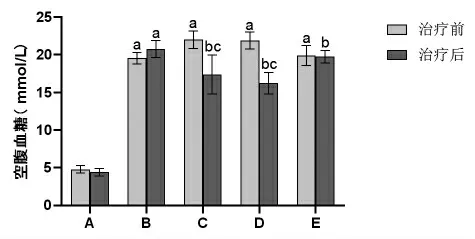
图2 各组大鼠治疗前后空腹血糖水平比较(±s,n=9)
2.3 各组大鼠FINS、HOMA-IR和HbAlc比较 与空白对照组比较,模型组大鼠FINS、HOMA-IR和HbAlc均明显升高(P<0.05);
与模型组比较,Rx抑制剂组和滋膵通脉饮高、低剂量组大鼠FINS、HOMA-IR和HbAlc均明显降低(P<0.05);
与Rx抑制剂组比较,滋膵通脉饮高、低剂量组大鼠FINS、HOMA-IR和HbAlc均明显降低(P<0.05);
滋膵通脉饮高剂量组大鼠FINS、HOMA-IR和HbAlc与滋膵通脉饮低剂量组比较,差异无统计学意义(P>0.05)。(见图3)
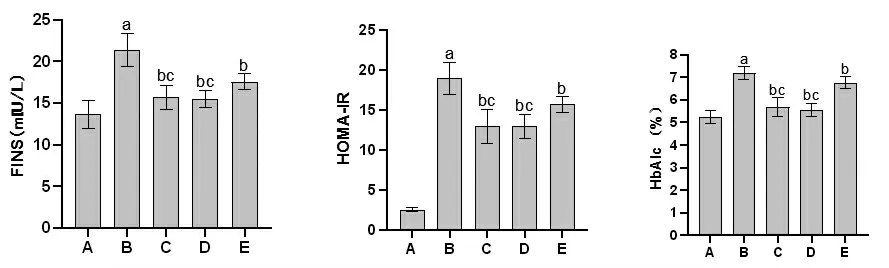
图3 各组大鼠FINS、HOMA-IR 和HbAlc 比较(±s,n=9)
2.4 各组大鼠血脂水平比较 与空白对照组比较,模型组大鼠TG、T-CHO、LDL-C水平均明显升高(P<0.05);
与模型组比较,Rx抑制剂组和滋膵通脉饮高、低剂量组大鼠TG、T-CHO、LDL-C水平均明显均降低(P<0.05);
与Rx抑制剂组比较,滋膵通脉饮高、低剂量组大鼠TG、T-CHO、LDL-C水平均明显降低(P<0.05);
滋膵通脉饮高剂量组大鼠TG、T-CHO、LDL-C水平与滋膵通脉饮低剂量组比较,差异无统计学意义(P>0.05)。(见图4)
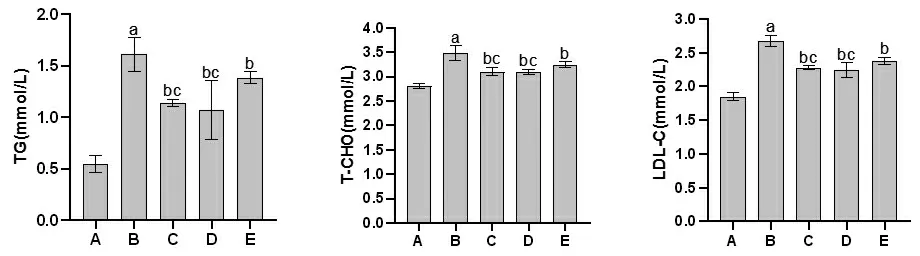
图4 各组大鼠血脂水平比较(±s,n=9)
2.5 各组大鼠MDA含量和SOD活性比较 与空白对照组比较,模型组大鼠MDA含量明显升高(P<0.05),而SOD活性明显降低(P<0.05);
与模型组比较,Rx抑制剂组和滋膵通脉饮高、低剂量组大鼠MDA含量均明显降低(P<0.05),而SOD活性均明显升高(P<0.05),且3组间大鼠MDA含量和SOD活性比较,差异无统计学意义(P>0.05)。(见图5)
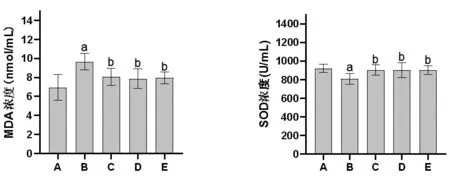
图5 各组大鼠MDA 含量和SOD 活性比较(±s,n=9)
2.6 各组大鼠心肌组织PKC-βⅡ蛋白表达比较 与空白对照组比较,模型组大鼠心肌组织PKC-βⅡ蛋白相对表达量明显升高(P<0.01);
与模型组比较,滋膵通脉饮低剂量组和Rx抑制剂组大鼠心肌组织PKC-βⅡ蛋白相对表达量均明显降低(P<0.01);
滋膵通脉饮高剂量组大鼠心肌组织PKC-βⅡ蛋白相对表达量与模型组比较,差异无统计学意义(P>0.05)。(见图6~7)
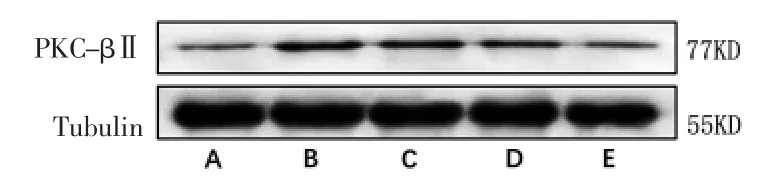
图6 各组大鼠心肌组织PKC-βⅡ蛋白表达Western blotting图
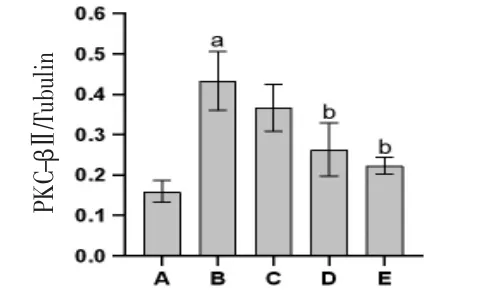
图7 各组大鼠心肌组织PKC-βⅡ蛋白相对表达量比较(±s,n=9)
2.7 各组大鼠心肌病理形态学改变 空白对照组大鼠心肌纤维与心肌细胞的排列整齐,纤维间隙未见明显增宽,细胞核与细胞质着色均匀,对比清楚;
模型组大鼠心肌纤维与心肌细胞排列紊乱,纤维间隙明显增宽,心肌细胞肥大变形、可见炎症细胞浸润、间质纤维化明显;
滋膵通脉饮低剂量组和Rx抑制剂组大鼠心肌纤维与心肌细胞排列稍显紊乱,纤维间隙较模型组增宽不明显,细胞核染色基本清晰,细胞形态较为完整;
滋膵通脉饮高剂量组心肌纤维与心肌细胞排列较紊乱,纤维间隙较模型组增宽不明显,心肌细胞大部分变形,可见炎症细胞浸润、间质纤维化明显。(见图8)
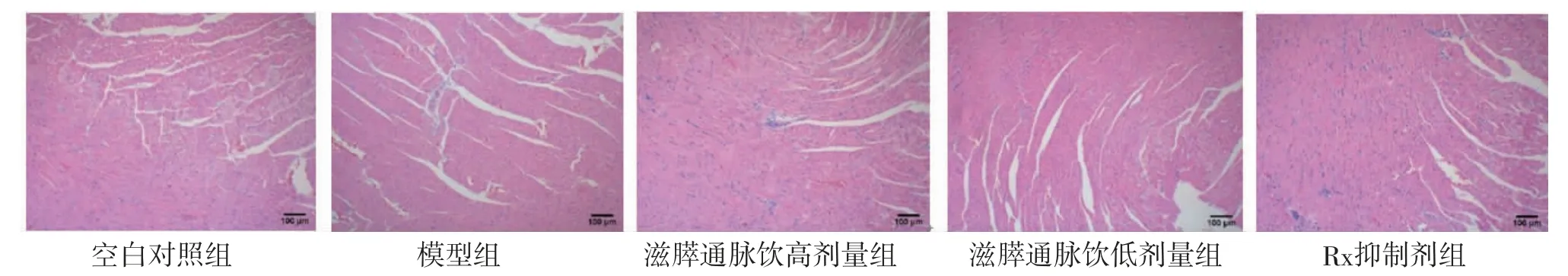
图8 各组大鼠心肌组织病理切片图(HE,×100)
DCM发病机制复杂,心肌代谢紊乱及微血管损伤是导致DCM的关键[12]。糖脂代谢紊乱、胰岛素抵抗及高胰岛素血症均是DCM发生的独立危险因素[13],长期代谢紊乱引可起包括PKC激活、晚期糖基化终末产物增加、RAAS激活等多种生化改变,这些病理性异常共同促进DCM的发生与发展[14-15]。
PKC激活在DCM中发挥着非常重要作用,糖尿病时可通过多种途径激活PKC[12,16-17]。糖尿病本身糖脂代谢紊乱及氧化应激增加均可激活PKC[13],导致DCM发生及发展。目前已经发现PKC有至少12种亚型,其家族成员在结构、分布和底物结合上却不尽相同。研究表明,PKC不同的亚型在糖尿病并发症中可能发挥特异性的作用。PKC-β与心、肾及视网膜组织联系紧密,并在其组织内广泛表达,被认为是与DCM相关的一种主要的亚型[18]。目前研究显示,DCM心肌组织中均存在PKC-β激活。PKC-β阻滞剂(LY333531)能够抑制PKC-β激活,从而阻止或延缓糖尿病并发症的发生及发展[19-20]。
糖脂代谢异常是DCM产生的始动因素。维持心脏舒缩功能的主要因素为线粒体的正常供能,然而在此需满足2个条件:燃料充足及本身结构、功能正常。心脏能量来源主要依赖于脂肪酸,其次是葡萄糖[21]。糖尿病可降低葡萄糖转运蛋白的表达,降低葡萄糖利用率,导致糖代谢异常[22-23]。胰岛素随即升高,诱导脂肪酸转位酶转移至肌膜[24]。过量的脂质也通过提高PKC活性诱导脂肪酸转位酶转位[25]。胰岛素抵抗时,葡萄糖转运蛋白被抑制,进一步导致脂质摄取增加和葡萄糖转运率下降[26]。高血糖状态又将引起胰岛素增加,如此往复,恶性循环。葡萄糖和脂肪酸被利用的平衡状态被打破,脂肪酸产能高、产量高,脂质过载导致耗氧增高。缺氧状态导致心肌收缩功能障碍、心肌肥大、心肌纤维化,甚则心肌细胞凋亡[24]。因此,改善糖脂代谢异常、高胰岛素血症及胰岛素抵抗是治疗此病的重要手段。
氧化应激被认为是DCM发展中的关键机制[27],高血糖会激活氧化应激[28]。长期高血糖状态通过激活蛋白激酶PKC途径和晚期糖基化终产物,从而产生活性氧[29]。活性氧的积累,也可导致线粒体氧化损伤,攻击其自身的蛋白质、DNA和脂质结构[30],导致其呼吸链破坏,从而产生更多的活性氧。活性氧可产生应激反应,引发炎症、纤维化和细胞凋亡,加速糖尿病心肌病的发展。氮氧化合物的激活是内皮细胞中活性氧的主要来源[31],高糖环境会增加氮氧化合物活性、活性氧释放。然而异常的氮氧化合物激活可以促进一氧化氮合成酶失调和解偶联,导致一氧化氮利用率降低,产生超氧化物,加重氧化应激及心肌损伤[32]。有研究表明,肿瘤坏死因子-α和高血糖均通过PKC活化氮氧化合物促进活性氧释放和细胞凋亡[33],说明PKC可活化氮氧化合物,导致一氧化氮合成酶解偶联,从而促进氧化应激的产生。因此,PKC可作为改善氧化应激的治疗靶点,这与本研究中Rx抑制剂组明显改善了氧化应激的结果一致。
中医学认为DCM归属于“消渴”继发“胸痹”范畴[34],统称“消渴病心病”。消渴病多由先天禀赋不足,素体脏腑虚弱,或和后天饮食失节、情志不调、劳欲过度导致脏腑虚损而诱发。消渴缠绵日久化火,致气阴两虚,久则血渐难行,停而成瘀,阻滞心脉,终成消渴病心病[35],因此,消渴病心病主要病机为气阴两虚、心脉瘀阻,以虚为本,以瘀为标,虚实夹杂。滋膵通脉饮是在张锡纯的“滋膵饮”的基础上加活血通络药物而成,是治疗气阴两虚、瘀血阻络之消渴及并发症有效方剂。方中黄芪为补气之主药,山茱萸味酸涩纳气。两药合用,助肺、脾、肾以运气、生气、纳气,共为君药。生地黄补肾阴,麦冬补肺阴,玄参补脾阴,天花粉清热生津。四药标本同治,共为臣药。生蒲黄、丹参、川芎、水蛭化瘀为主,清热为辅。地龙、鬼箭羽、僵蚕均主通络助血行瘀散。七药共为佐药。山楂健胃消食,助脾胃吸收各药之效,以达目的,为使药。全方君臣佐使共同配合,益气养阴,化瘀通络。现代研究表明,山茱萸的有效成分山茱萸总萜能调节糖尿病小鼠体内糖脂代谢过程,对糖尿病有治疗作用[36];
玄参的有效成分玄参多糖对糖尿病大鼠有明显的降血糖作用[37];
鬼箭羽具有降糖、降脂、保护心脑血管的作用[38-39];
丹参提取物丹参多酚酸盐能降低糖尿病患者血糖,发挥血管保护作用,改善血管内皮功能[40];
川芎嗪可抑制细胞凋亡、调节氧化应激反应[41];
山楂的有效成分山楂叶总黄酮有明显的降低糖尿病大鼠血脂、血糖的影响,而且还能改善糖尿病大鼠的抗氧化能力[42]。本研究结果显示,治疗前,模型组大鼠体质量及SOD活性均明显降低,FBG、FINS、HOMA-IR、HbAlc、TG、T-CHO、LDL-C、MDA含量及PKC-βⅡ蛋白相对表达量均明显升高,说明模型大鼠存在PKC-βⅡ的激活、糖脂代谢紊乱及氧化应激。治疗后,与模型组比较,滋膵通脉饮高、低剂量组大鼠体质量及SOD活性均明显升高,FBG、FINS、HOMA-IR、HbAlc、TG、T-CHO、LDL-C、MDA含量及PKC-βⅡ蛋白相对表达量均明显降低;
Rx抑制剂组大鼠SOD活性明显升高,MDA含量及PKC-βⅡ蛋白相对表达量均明显降低;
与Rx抑制剂组比较,滋膵通脉饮高、低剂量组大鼠体质量升高,FBG、FINS、HOMA-IR、HbAlc、TG、T-CHO及LDL-C均明显降低,而SOD活性及MDA含量与Rx抑制剂组无明显差异,说明Rx抑制剂对DCM大鼠氧化应激及PKC-βⅡ激活有改善作用,滋膵通脉饮对DCM大鼠糖脂代谢、胰岛素抵抗、氧化应激及PKC-βⅡ激活有改善作用,结果提示高剂量滋膵通脉饮效果欠佳,考虑为方剂中化瘀通络药物较多,高剂量则易伤脾胃,继而影响药效吸收所致。HE病理图片结果亦表明Rx抑制剂及滋膵通脉饮可改善心肌纤维化。
综上所述,滋膵通脉饮可改善糖尿病心肌病大鼠糖脂代谢及氧化应激,同时可抑制PKC-βⅡ表达抗心肌纤维化。
猜你喜欢通脉低剂量批号一种JTIDS 信号批号的离线合批方法航天电子对抗(2022年4期)2022-10-24医学科技期刊中药品生产批号标注探析中国科技纵横(2018年2期)2018-11-29中药材批号划分与质量管理中成药(2018年7期)2018-08-04药品包装用复合膜与通脉颗粒的相容性中成药(2018年6期)2018-07-1116排螺旋CT低剂量扫描技术在腹部中的应用中国医药指南(2017年3期)2017-11-13自适应统计迭代重建算法在头部低剂量CT扫描中的应用天津医科大学学报(2015年2期)2015-12-22低剂量辐射致癌LNT模型研究进展肿瘤预防与治疗(2015年1期)2015-09-26正常和慢心率CT冠状动脉低剂量扫描对比研究医学研究杂志(2015年11期)2015-06-10通脉降糖胶囊治疗糖尿病周围神经病变的效果观察中国当代医药(2015年8期)2015-03-01通脉化浊汤改善高脂血症痰瘀阻滞证候情况的研究中国中医药现代远程教育(2014年11期)2014-08-08








