鱼腥草根总黄酮超声辅助酶法提取工艺优化及其抗氧化活性研究
时间:2023-06-26 12:30:05 来源:雅意学习网 本文已影响 人 
蒋雨心,邓 岚,范方宇,2,3,
(1.西南林业大学生命科学学院,云南昆明 650224;
2.西南地区生物多样性保育国家林业和草原局重点实验室,云南昆明 650224;
3.云南省森林灾害预警与控制实验室,云南昆明 650224)
鱼腥草(Houttuynia cordataThunb.)为药食同源植物,又名臭根草、折耳根等,主要分布于东亚、东南亚等地区及我国云南、贵州、四川等地[1],因其具有清热解毒、去痈排脓、利尿通淋等功效,被誉为中药中的广谱抗生素,临床上常用于治疗肺炎、气管炎、呼吸道疾病等[2−3]。鱼腥草含挥发油、黄酮、酚酸、生物碱、萜类等多种活性成分,其黄酮类含量最为丰富,以槲皮素及其糖苷为主,具有较好的抗氧化、抗炎、抑菌等作用[4−6]。研究表明,黄酮类化合物能有效缓解机体内因自由基过量造成的氧化损伤,预防多种疾病[7]。展俊岭等[8]以超声、微波联用提取鱼腥草总黄酮,并研究其抗氧化活性,结果表明鱼腥草总黄酮对DPPH·、·OH清除效果较好,且清除率与浓度具有一定的量效关系。蔡文国等[9]通过研究16种产地不同的鱼腥草黄酮抗氧化活性发现,黄酮含量与体外抗氧化活性指标相关性达到极显著水平。研究鱼腥草黄酮的提取对鱼腥草黄酮开发利用具有一定意义。
目前,鱼腥草黄酮提取方法有溶剂提取法、酶辅助提取法、微波辅助提取法、超声辅助提取法及双水相萃取法等。阎红等[10]采用溶剂提取法,以鱼腥草叶为材料,使用乙醇回流提取黄酮,提取率为1.868%,传统的溶剂提取法操作简单但耗时较长,提取效率较低;
李湘等[11]以鱼腥草根为材料,采用超声波辅助提取鱼腥草黄酮,提取率为2.00%,工艺耗时短,且超声波的机械振动及空化作用可以加速鱼腥草黄酮的溶出,提取率提高。但在现有报道的提取工艺中,缺乏鱼腥草粉碎粒径对提取率影响的研究。单位质量鱼腥草的总比表面积不同,受到超声波的空化作用和酶解作用也不同,细胞壁、纤维组织破坏程度将大大影响其提取效果。因此粉碎粒径对提取效果的影响也显得尤为重要。
基于此,本文采用超声波辅助纤维素酶辅法提取黄酮,通过两种手段的辅助,以粉碎的鱼腥草根为原料提取黄酮,以期提高黄酮提取量。此外,在最佳提取工艺的基础上,对鱼腥草黄酮抗氧化活性进行研究,以期为鱼腥草黄酮的开发利用提供参考。
1.1 材料与仪器
鱼腥草全根 云南省昆明市寻甸县金所乡;
纤维素酶 酶活力≥35 u/mg(BR级),南京都南生物公司;
芦丁标准品 HPLC≥98%,上海源叶生物科技公司;
DPPH(1,1-二苯基-2-三硝基苯肼)、ABTS(3-乙基苯并噻唑-6-磺酸) HPLC≥98%,合肥巴斯夫生物科技有限公司;
所有测定用有机溶剂 均为国产分析纯。
DNF-4K智能烘干设备 北京东南风科技有限公司;
SB25-12DTDS超声波清洗机 宁波新艺超声设备有限公司;
UV-2600紫外可见分光光度计 日本岛津公司。
1.2 实验方法
1.2.1 鱼腥草黄酮提取工艺 新鲜鱼腥草全根去除根须,蒸馏水洗净,50 ℃热泵干燥12 h,粉碎,分别过40、60、80、100、120目筛,得粒径<425、<250、<180、<150、<125 μm鱼腥草粉。称取1.00 g鱼腥草粉,按液料比加入质量分数一定的乙醇溶液,用0.1 mol/L的NaOH、0.1 mol/L的冰乙酸调节至纤维素酶酶解适宜pH5,500 W超声功率提取50 min,加入一定质量分数的纤维素酶,45 ℃水浴酶解一定时间,于90~93 ℃灭酶5 min,抽滤,滤液定容至100 mL。
1.2.2 单因素实验 以粒径<250鱼腥草粉、液料比30:1 mL/g、乙醇浓度50%、超声时间50 min、超声功率500 W、酶解时间30 min、加酶量0.5%为固定参数,改变粒径(<425、<250、<180、<150、<125 μm)、液料比(10:1、20:1、30:1、40:1、50:1 mL/g)、乙醇浓度(30%、40%、50%、60%、70%)、酶解时间(10、20、30、40、50 min)、加酶量(0、0.25%、0.5%、0.75%、1%)5个因素,探究对鱼腥草中黄酮提取量的影响。
1.2.3 响应面试验 选取液料比(A)、粒径(B)、乙醇浓度(C)、酶解时间(D)4个试验因素,以鱼腥草黄酮提取量为响应值,利用Design-Expert 13软件进行优化试验设计。试验因素水平如表1所示。

表1 响应面试验因素水平表Table 1 Factors and levels of Box-Behnken test
1.2.4 鱼腥草黄酮提取量的计算
1.2.4.1 芦丁标准曲线的制作 标准曲线的绘制参考何兰香等[12]的方法稍作修改。配制0.2 mg/mL芦丁标准溶液,精确吸取芦丁标准溶液0.5、1.0、1.5、2.0、2.5 mL置于10 mL比色管中,分别加入0.3 mL亚硝酸钠溶液(5%)、硝酸铝溶液(10%),摇匀、静置6 min,加入4 mL氢氧化钠溶液(4%),50%乙醇定容,摇匀,静置15 min,510 nm测吸光度。浓度(X)为横坐标,吸光值(Y)为纵坐标绘制标准曲线,得回归方程Y=11.39X−0.0021,R2=0.9993。
1.2.4.2 黄酮提取量计算 取1 mL黄酮提取液于10 mL比色管中,按标准曲线方法测定吸光值。黄酮提取量按式(1)计算。
式中:10为加显色试剂后待测液体积,mL;
C为鱼腥草黄酮浓度,mg/mL;
100为黄酮提取液总体积,mL;
m为鱼腥草质量,g。
1.2.5 鱼腥草黄酮纯度计算 根据最佳工艺条件提取鱼腥草黄酮,黄酮粗提液经抽滤、浓缩后冻干得鱼腥草黄酮粗提物。取一定质量的鱼腥草黄酮粗提物,54%乙醇定容至25 mL,取1 mL样品液按1.2.4.2方法测定黄酮含量。
式中:m1为鱼腥草粗提物黄酮含量,mg;
m2为鱼腥草粗提物质量,mg。
1.2.6 抗氧化试验 称取一定质量的鱼腥草黄酮粗提物,经含量换算后配制黄酮浓度为10 mg/mL的样品液,用于抗氧化活性测定。采用GraphPad Prism 9.3.1分析拟合并计算EC50值(即引起50%自由基清除率的黄酮浓度,mg/g)鱼腥草黄酮抗氧化能力以EC50值大小判断,EC50值越大,抗氧化能力越弱。
1.2.6.1 DPPH·清除率 参考郭磊等[13]的方法略作修改。将10 mg/mL的黄酮溶液分别稀释至0.01、0.05、0.1、0.2、0.3、0.4、0.5 mg/mL,各取2 mL于比色管,加入2 mL DPPH-乙醇溶液(0.1 mmol/L),37 ℃避光保存30 min,以无水乙醇为参比,517 nm测吸光值(A1);
以2 mL无水乙醇代替样品液,517 nm处测吸光值(A2);
以2 mL无水乙醇代替DPPH-乙醇溶液,517 nm处测吸光值(A3)。同浓度的VC标准液为阳性对照。DPPH·清除率按式(3)计算。
1.2.6.2 ·OH清除率 参考Li等[14]的方法略作修改。将10 mg/mL的黄酮溶液分别稀释至0.1、0.5、1、2、3、4、5 mg/mL,各取1 mL于比色管,分别加入1 mL硫酸亚铁溶液(9 mmol/L)、1 mL过氧化氢溶液(8.8 mmol/L),室温反应10 min,加入1 mL水杨酸乙醇溶液(9 mmol/L),室温反应30 min,以蒸馏水为参比,510 nm测定吸光值(A1);
取1 mL蒸馏水替换样品液,510 nm处测定吸光值(A2);
取1 mL蒸馏水替换硫酸亚铁溶液,510 nm处测定吸光值(A3)。同浓度的VC标准液为阳性对照。·OH清除率按式(4)计算。
1.2.6.3 ABTS+·清除率 参考胡晓波[15]的方法略作修改。测定前取ABTS+溶液(7 mmol/L)与过硫酸钾溶液(2.45 mmol/L)等体积混匀,室温下避光静置12 h得ABTS+母液。测定时无水乙醇稀释至吸光值为0.7±0.02得ABTS+测定液。将10 mg/mL的黄酮溶液分别稀释至0.1、0.2、0.3、0.4、0.5、0.6、0.7 mg/mL,各取0.5 mL于比色管,分别加入5 mL ABTS+测定液,混匀,室温反应20 min,以蒸馏水为参比,734 nm下测定吸光值(A1);
取0.5 mL蒸馏水替换样品液,加入5 mL ABTS+测定液,734 nm测定吸光值(A2);
取0.5 mL不同浓度的样品液,加入5 mL蒸馏水替换ABTS+测定液,734 nm测定吸光值(A3)。同浓度的VC标准液为阳性对照。ABTS+·清除率按式(5)计算。
1.2.6.4 还原力的测定 测定方法参考屈咪[16]略作修改。将10 mg/mL的黄酮溶液分别稀释至0.1、0.5、1、2、3、4、5、6 mg/mL,各取2.5 mL于比色管,分别加入2.5 mL磷酸缓冲溶液(0.2 mol/L,pH6.6)、1%铁氰化钾溶液2.5 mL,混匀,50 ℃水浴20 min,迅速冷却至室温并加入10%三氯乙酸溶液2.5 mL,3000 r/min离心10 min,取上清液5 mL,加入0.1%三氯化铁溶液2.5 mL,蒸馏水定容至10 mL,混匀、静置10 min,以蒸馏水为参比,700 nm测定吸光值。同浓度的VC标准液为阳性对照。
1.3 数据处理
所有试验均设3组平行,利用软件Design-Expert 13进行响应面试验设计,软件IBM SPSS Statistics 26、GraphPad Prism 9.3.1进行数据分析,软件Origin 2018进行绘图。
2.1 单因素实验结果
2.1.1 鱼腥草粒径对黄酮提取量的影响 图1可见,鱼腥草粒径为180~425 μm时,黄酮提取量随粒径的减小明显增加,粒径180~250 μm时黄酮提取量最大,为21.431 mg/g,粒径继续减小黄酮提取量呈显著(P<0.05) 下降趋势。原因可能为粒径减小,单位质量鱼腥草的总比表面积增大,受到超声波的空化作用和酶解作用较强,细胞壁、纤维组织破坏程度较大,有利于提高溶剂渗透速率及鱼腥草黄酮提取量;
粒径过小时,活性位点增多易氧化,细胞壁过度裂解,胞内物质与黄酮竞争溶出,降低了黄酮的提取量[17−18]。另外,由于比表面积增大,颗粒表面聚合力及颗粒间黏附性增强,溶剂加入后易结块,不利于黄酮的溶出[19]。因此,选择粒径<425、<250、<180 μm三个水平进行响应面试验。

图1 鱼腥草粒径对鱼腥草黄酮提取量的影响Fig.1 Effect of particle size on extraction amount of flavonoids from Houttuynia cordata
2.1.2 液料比对鱼腥草黄酮提取量的影响 图2可见,液料比为10:1~30:1 mL/g时,鱼腥草黄酮提取量随液料比的增大明显提高,30:1 mL/g时提取量最大,为21.431 mg/g,液料比大于30:1 mL/g时,黄酮提取量明显降低。原因可能为液料比较小时,鱼腥草颗粒与溶剂接触面积较小,导致部分黄酮未有效溶出;
随着溶剂增加,鱼腥草颗粒与溶剂接触充分,超声波和酶解作用下,黄酮有效溶出,提取量提高;
溶剂过多时,样品中可溶性物质如多糖等对鱼腥草黄酮有吸附作用阻碍其溶出,黄酮提取量下降[20]。另外,溶剂增加,溶剂对超声波能量的吸收随之增加,鱼腥草颗粒受到的超声波作用减弱,不利于黄酮溶出[21]。因此,选择液料比20:1、30:1、40:1 mL/g三个水平进行响应面试验。
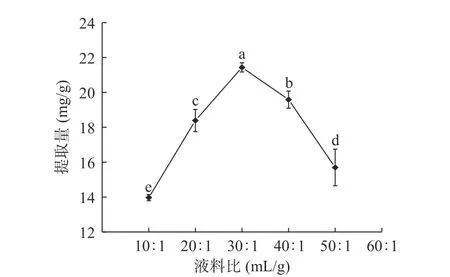
图2 液料比对鱼腥草黄酮提取量的影响Fig.2 Effect of liquid-material radio on extraction amount of flavonoids from Houttuynia cordata
2.1.3 乙醇浓度对鱼腥草黄酮提取量的影响 图3可见,乙醇浓度为30%~60%时,随乙醇浓度升高,鱼腥草黄酮提取量明显提高,60%时黄酮提取量达到最大,为22.192 mg/g,浓度大于60%,黄酮提取量明显降低。原因为随着乙醇浓度的增加,细胞内外浓度差增大,有利于黄酮类物质溶出;
乙醇浓度过高时会影响纤维素酶的酶解作用,同时溶液体系极性差异较大,鱼腥草中极性较小的脂溶性、醇溶性物质与黄酮竞争溶出,导致鱼腥草提取量下降[21−22]。因此,选择乙醇浓度50%、60%、70%三个水平进行响应面试验。

图3 乙醇浓度对鱼腥草黄酮提取量的影响Fig.3 Effect of ethanol concentration on extraction amount of flavonoids from Houttuynia cordata
2.1.4 酶解时间对鱼腥草黄酮提取量的影响 图4可见,酶解10~20 min时,黄酮提取量随酶解时间的增加明显提高,20 min时达到最大值,为22.163 mg/g;
酶解时间过长(>20 min),黄酮提取量明显降低。原因为酶解时间较短,细胞壁内果胶物质未被完全降解,胞内物质未完全释放,黄酮提取量低;
随着酶解时间的增加,细胞壁充分裂解,鱼腥草黄酮有效溶出,提取量提高;
酶解时间过长,较多杂质溶出,底物浓度增大,纤维素酶的酶促反应速率降低,导致黄酮提取量降低[23−24]。因此,选择酶解时间10、20、30 min三个水平进行响应面试验。
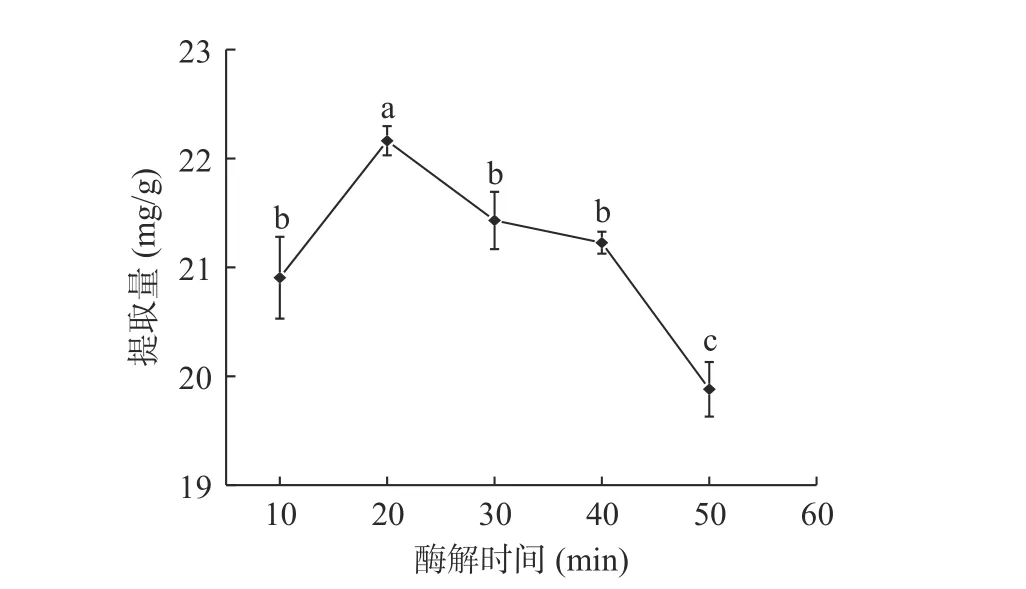
图4 酶解时间对鱼腥草黄酮提取量的影响Fig.4 Effect of enzymolysis time on extraction amount of flavonoids from Houttuynia cordata
2.1.5 加酶量对鱼腥草黄酮提取量的影响 图5可见,添加纤维素酶,鱼腥草黄酮提取量均明显提高,加酶量为0.5%时,黄酮提取量最高为21.431 mg/g,0.25%、0.5%、0.75%提取量差异不明显,加酶量继续增加提取量降低。原因为加酶量较少,细胞壁受到的酶解作用小,导致提取量较低;
随着纤维素酶质量分数的增加,细胞壁与酶的接触机会增加,细胞壁被有效裂解,细胞通透性增加,有利于黄酮溶出;
加酶量过多,过量的酶覆盖于鱼腥草表面,阻碍黄酮溶出,同时抑制酶促反应,导致提取量降低[25−26]。因此,选择纤维素酶添加量0.5%较为适宜。

图5 加酶量对鱼腥草黄酮提取率的影响Fig.5 Effect of enzyme dosage on the yield of the flavonoids from Houttuynia cordata
2.2 响应面试验结果
2.2.1 响应面试验及方差分析结果 以液料比(A)、粒径(B)、乙醇浓度(C)、酶解时间(D)四个因素为优化对象,鱼腥草黄酮提取量为响应值,采用Design-Expert 13软件对鱼腥草黄酮提取工艺进行优化。响应面试验设计及结果见表2。

表2 响应面试验设计及结果Table 2 Test design and result of response surface methodology
通过分析建立数学回归模型,其二次多元回归方程为:Y=−22.06+0.3382A−1.34B−1.05C−0.2633D−0.6583AB+2.34AC−0.8122AD−1.35BC−0.7680BD−0.6148CD−3.27A2−3.07B2−1.19C2−1.38D2。由 表3可知,F值为15.55,P值<0.0001,该回归模型差异极显著,失拟项P值为0.1136>0.05,差异不显著,说明模型拟合较好,能较好地反映出鱼腥草黄酮提取量与各因素间的关系。决定系数R2为0.9477,表明该模型预测值与实际值相关性较高,调整决定系数R2Adj为0.8868,表明该模型能解释响应值88.68%的变化。变异系数(C.V.)为4.68%,表明试验结果可靠性较高。模型中一次项(B)、交互项(AC)、二次项(A2、B2)对响应值影响极显著(P<0.001),一次项(C)、交互项(BC)及二次项(C2、D2)对响应值影响较显著(P<0.01),说明各因素交互作用对鱼腥草提取量的影响非简单的线性关系。各因素对响应值(Y)的影响可通过对应F值大小判断,F值越大,该因素对响应值的影响越显著。各因素对鱼腥草黄酮提取量的影响程度依次为粒径(B)>乙醇浓度(C)>液料比(A)>酶解时间(D),各交互项对鱼腥草黄酮提取量影响程度排序为:AC>BC>AD>BD>AB>CD。
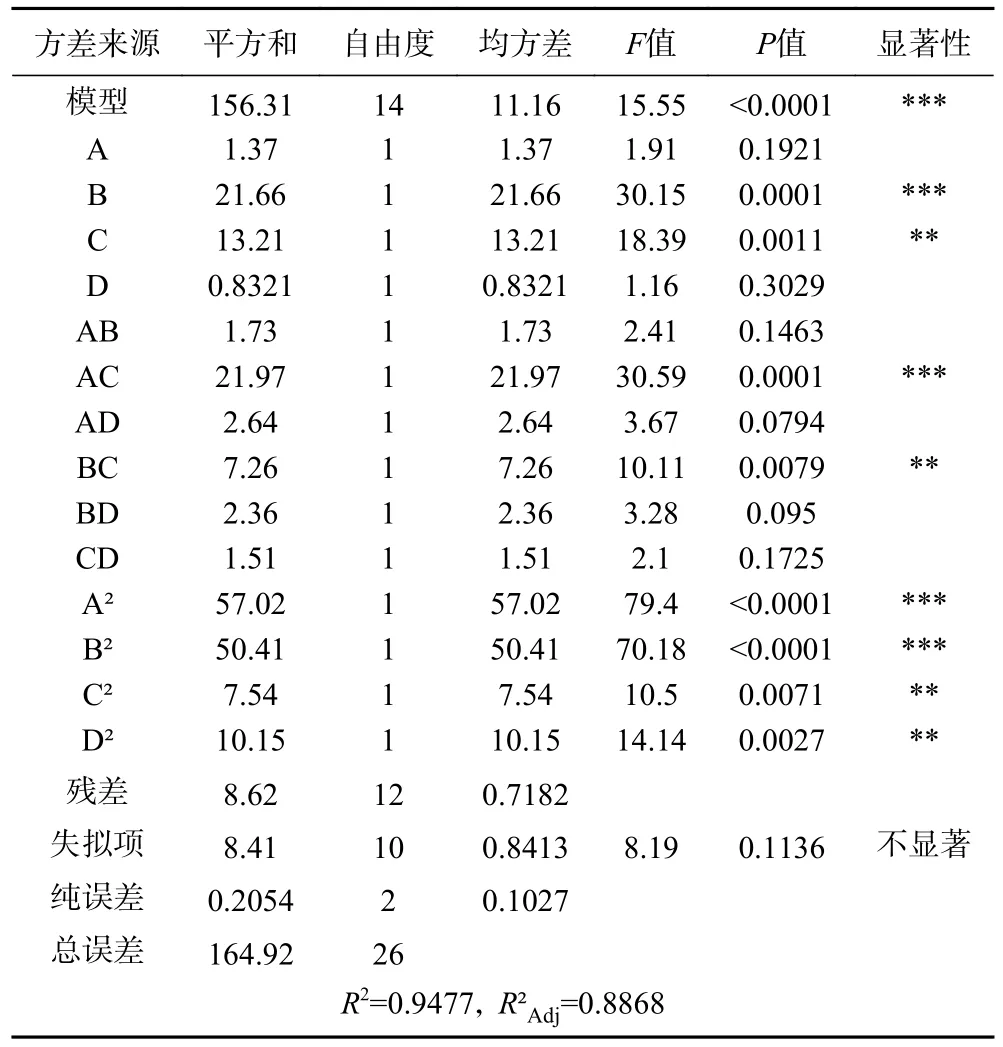
表3 响应面二次模型方差分析Table 3 Analysis of variance of response surface quadratic model
2.2.2 各因素间交互作用及最佳工艺验证 响应面曲面图(3D)的坡度能直观反映出各因素交互作用对响应值(Y)的影响程度。图6可见,液料比和乙醇浓度的曲面图(b)坡度最陡峭,说明对鱼腥草黄酮提取量影响最大,其次为粒径和乙醇浓度(d)。该结果与响应面方差分析结果一致。经模型拟合得到鱼腥草黄酮最佳提取工艺为液料比28.602:1 mL/g、粒径60目、乙醇浓度53.821%、酶解时间21.787 min,在此条件鱼腥草黄酮理论提取量为22.359 mg/g。根据实际对参数少量修整,以液料比28:1 mL/g、粒径<250 μm、乙醇浓度54%、酶解时间22 min进行三次平行验证,得出鱼腥草黄酮实际提取量为22.197 mg/g,与预测值较接近,表明该回归模型用于鱼腥草黄酮提取工艺优化具有可靠性。
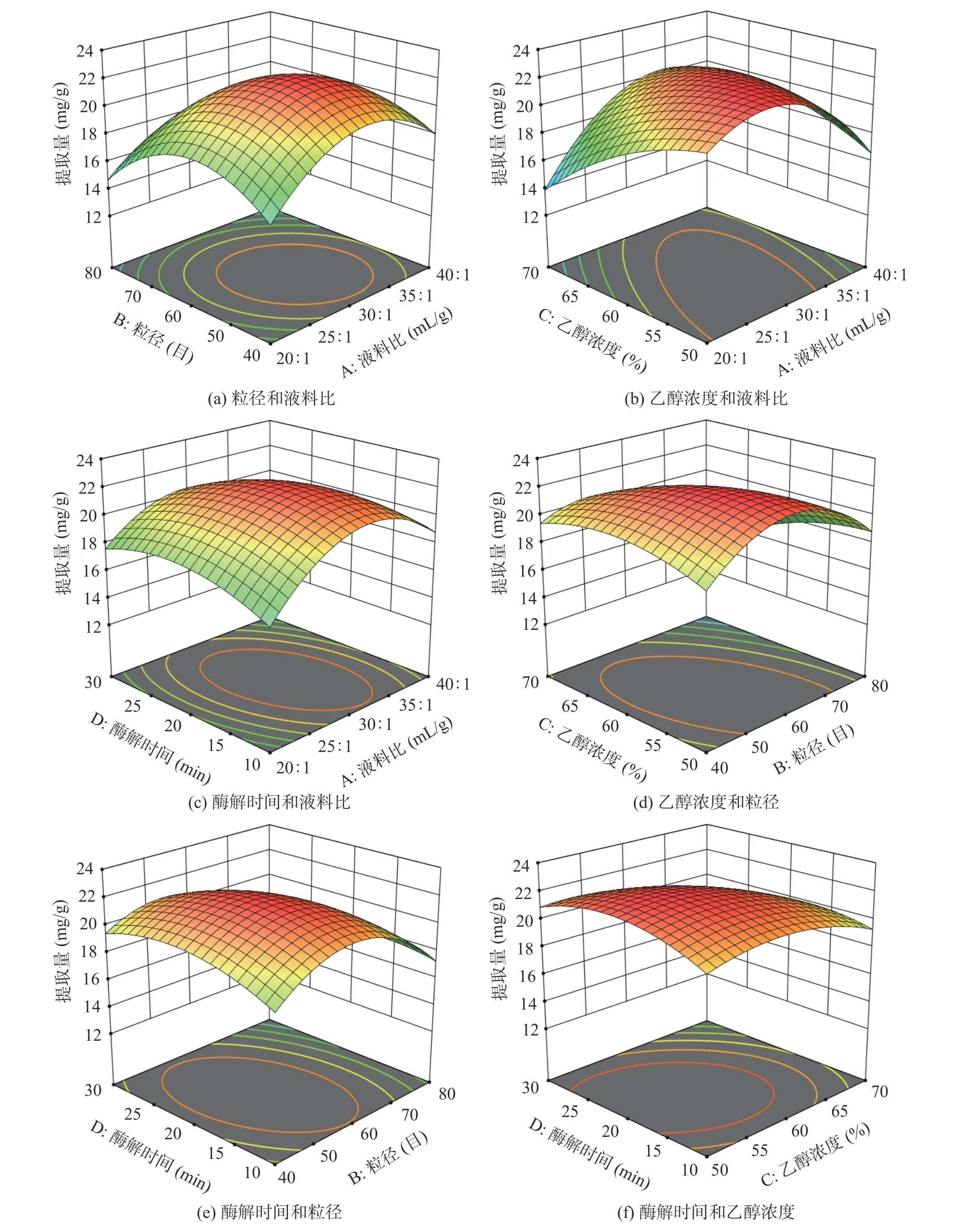
图6 各因素交互作用对鱼腥草黄酮提取量的影响Fig.6 Effect of interaction on extraction amount of flavonoids from Houttuynia cordata
2.2.3 鱼腥草黄酮纯度 通过式(2)计算得出鱼腥草黄酮粗提物纯度为27.26%、25.67%、26.93%,平均值为26.63%。杨宗玲等[27]以超声辅助酶法提取无籽刺梨果渣黄酮,提取物纯度为25.5%。结合本试验说明该工艺提取可得到纯度较好的鱼腥草黄酮。
2.3 抗氧化试验结果
2.3.1 鱼腥草黄酮对DPPH·清除能力 图7可见,0.01~0.2 mg/mL时,VC溶液DPPH·清除率随浓度的增加明显提高(48.87%~95.42%),浓度继续增大各浓度间清除率无明显差异,0.4 mg/mL时,清除率最大为95.50%;
VC对DPPH·清除率EC50值为0.040 mg/mL。据文献可知,VC对DPPH溶液中稳定存在的自由基和正离子两种状态均有清除作用,即使低浓度下也具有较强的清除能力[16]。浓度为0.01~0.4 mg/mL时,鱼腥草黄酮溶液对DPPH·清除率随浓度的增加明显提高(22.65%~91.59%),0.4 mg/mL时,清除率最大为91.59%,浓度继续增加清除率趋于稳定(91.59%~91.65%),无明显差异;
鱼腥草黄酮对DPPH·清除率EC50值为0.097 mg/mL。罗益远等[28]研究发现明鱼腥草黄酮浓度髙于0.2 mg/mL时,DPPH·清除率趋于平稳。结合本试验说明鱼腥草黄酮对DPPH·有较好的清除能力。
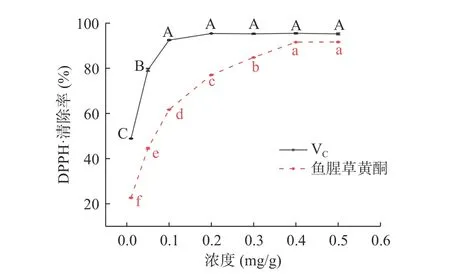
图7 鱼腥草黄酮对DPPH·清除率Fig.7 DPPH· scavenging effect of flavonoids from Houttuynia cordata
2.3.2 鱼腥草黄酮对·OH清除能力 图8可见,0.1~2 mg/mL时,VC溶液对·OH清除率随浓度的增加明显提高(10.74%~97.60%),浓度继续增加,清除率缓慢增加后趋于稳定,各浓度间清除率无明显变化;
VC溶液对·OH清除率EC50值为0.603 mg/mL;
浓度为0.1~4 mg/mL时,鱼腥草黄酮溶液对·OH清除率随着浓度的增加而明显提高(9.40%~72.54%),5 mg/mL时,清除率最大为72.62%,浓度继续增加,清除率基本稳定,无明显差异;
鱼腥草黄酮对·OH清除率EC50值为2.250 mg/mL。该结果低于展俊岭等[8]的研究。原因为不同地区不同种、质鱼腥草抗氧化活性不同。此外鱼腥草黄酮提取物可有效清除·OH,但清除效果不如DPPH·,该结果与宋也好等[29]一致。原因为不同自由基的氧化作用机制存在差异,·OH清除机制为氢原子转移,DPPH·、ABTS+·则为单一电子传递机制,此外同种抗氧化剂对不同自由基的清除作用也不同[30]。
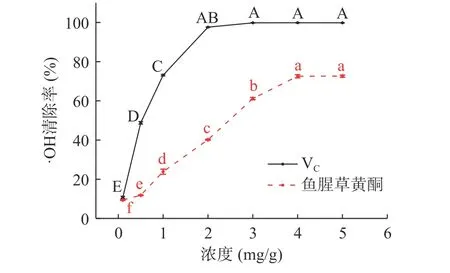
图8 鱼腥草黄酮对·OH清除率Fig.8 ·OH scavenging effect of flavonoids from Houttuynia cordata
2.3.3 鱼腥草黄酮对ABTS+·清除能力 图9可见,不同质量浓度的鱼腥草黄酮对ABTS+·清除率均低于VC。浓度为0.1~0.8 mg/mL时,VC溶液对ABTS+·清除率趋于平稳,无明显差异(98.75%~99.74%);
VC溶液对ABTS+·清除率EC50值为0.001 mg/mL。浓度为0.1~0.6 mg/mL时,鱼腥草黄酮溶液对ABTS+·清除率随浓度的增加明显提高(20.36%~74.21%),0.7 mg/mL时,清除率最大为74.82%,浓度继续增加清除率趋于平稳,无明显差异;
鱼腥草黄酮对ABTS+·清除率EC50值为0.384 mg/mL,小于魏磊等[31]实验中总黄酮对ABTS+·半数清除率。说明虽然清除能力低于VC,但鱼腥草黄酮在ABTS阳离子自由基的清除反应中也具有较强的供氢能力。原因为黄酮类化合物结构上的羟基会对自由基链式反应产生一定的干扰,从而产生抗氧化作用[32−33]。
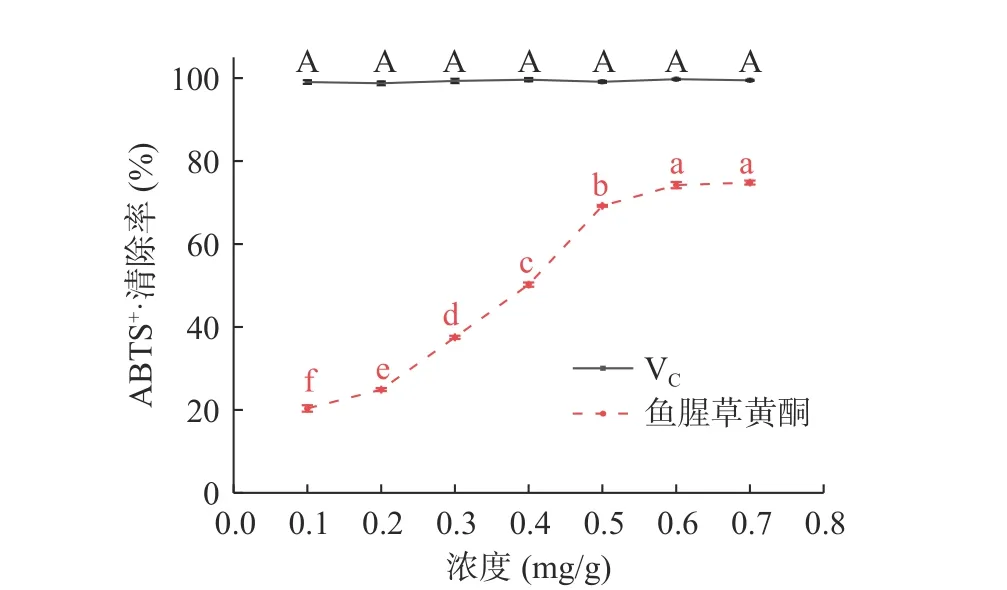
图9 鱼腥草黄酮对ABTS+·清除率Fig.9 ABTS+· scavenging effect of flavonoids from Houttuynia cordata
2.3.4 鱼腥草黄酮的总还原力 图10可见,随着VC和鱼腥草黄酮质量浓度的增加总还原力提高,鱼腥草黄酮的吸光值均低于VC溶液。浓度为0.1~4 mg/mL,VC溶液的总还原能力随浓度的增加明显提高,4 mg/mL时,总还原力最大为4.259,后续随浓度的增加,VC溶液总还原力缓慢降低;
原因可能为VC浓度大于4 mg/mL时,溶液体系中普鲁士蓝生成物产生沉淀或因溶液颜色过深导致吸光值下降[27]。浓度为0.1~5 mg/mL时,鱼腥草黄酮溶液的总还原力随浓度的增加明显提高,5 mg/mL时,总还原力最大为3.406,继续增加则趋于稳定,且无明显差异。何洁等[34]通过研究鱼腥草黄酮的总还原力,发现黄酮浓度为0.269 mg/mL 时,总还原力为0.5,而本试验在黄酮浓度为0.1时总还原力达到0.92。说明鱼腥草总黄酮具有较好的还原能力,在一定浓度范围内呈现良好的剂量-效应关系。
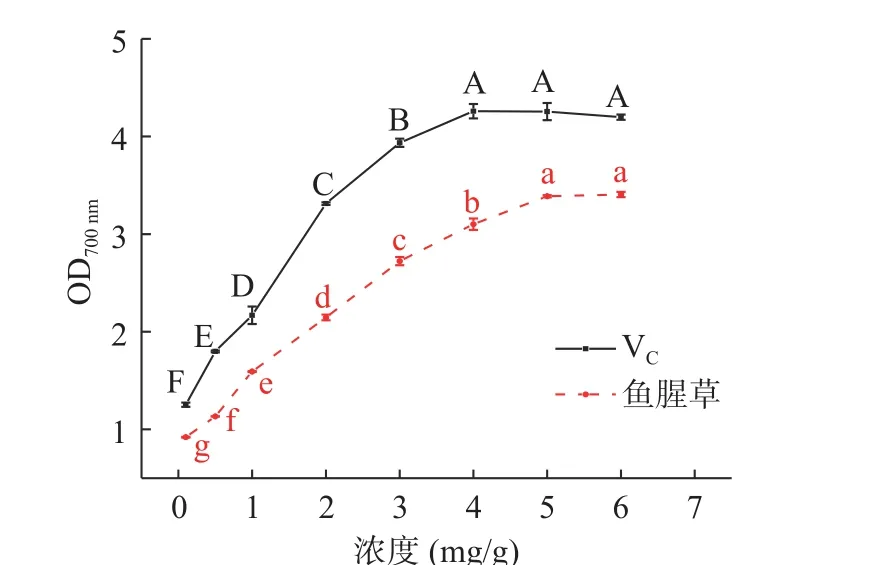
图10 鱼腥草黄酮的总还原力Fig.10 Reducing power of flavonoids from Houttuynia cordata
本文采用超声辅助酶法提取鱼腥草根总黄酮,以黄酮提取率为指标,通过单因素实验筛选出适宜的液料比、粒径、乙醇浓度、酶解时间、加酶量,通过Box-Behnken响应面优化鱼腥草黄酮提取最佳条件,并对黄酮抗氧化活性进行研究。结果表明,最佳提取工艺为液料比28:1 mL/g、粒径<250 μm、乙醇浓度54%、酶解时间22 min,在此条件下鱼腥草黄酮的实际提取率为22.197 mg/g,经减压浓缩纯度达到26.63%。抗氧化试验表明鱼腥草黄酮提取物对DPPH·、·OH、ABTS+·均具有一定的清除能力,其对DPPH·、·OH、ABTS+·的EC50值分别为0.097、2.250、0.384 mg/mL,同时具有较好的还原能力,5 mg/mL时总还原力为3.406。与传统溶剂提取法相比,超声辅助酶法提取鱼腥草根总黄酮耗时较短,提取率高,为鱼腥草根总黄酮提取提供了理论依据。所获得的黄酮提取物表现出较好抗氧化活性,可作为一种潜在的功能成分应用于食品中,为进一步实现鱼腥草资源的高值化利用提供了参考。后续研究可对鱼腥草根总黄酮的分离纯化、结构鉴定及体内、体外生理活性机理作进一步深入研究,探索鱼腥草黄酮新的潜在应用,以提高利用率。
猜你喜欢吸光鱼腥草液料金色的吸管作文与考试·小学低年级版(2021年12期)2021-08-09T-501色泽分析方法的建立魅力中国(2020年8期)2020-12-07亦药亦食的鱼腥草基层中医药(2020年6期)2020-09-11新型多功能饮品复合调配分离瓶的研发科技视界(2018年22期)2018-10-08鱼腥草治疗慢性鼻腔炎特别健康(2018年9期)2018-09-26夏季良药鱼腥草基层中医药(2018年6期)2018-08-29гУТТУИНИя сЕРДЦЕЛИсТНая中国(俄文)(2016年7期)2016-09-18半菁染料作为染料敏化太阳能电池吸光材料的理论研究物理化学学报(2015年5期)2015-02-28混砂机液料流量的精确控制中国铸造装备与技术(2012年5期)2012-11-04流量反馈控制在呋喃树脂混砂机上的应用中国铸造装备与技术(2012年4期)2012-09-01









