右美托咪定调控miR-150-5p/P2X7受体轴减轻脑出血大鼠小胶质细胞活化
时间:2023-06-26 11:25:04 来源:雅意学习网 本文已影响 人 
周华勇, 赵玉萍, 杨 旭, 张珊珊, 季一飞
(四川省南充市中心医院/川北学院第二临床学院神经内科, 四川 南充 637000)
脑出血(intracerebral hemorrhage,ICH)是指脑实质非外伤性内血管破裂导致的出血,是脑卒中的一种类型,具有较高的发病率、致残致死率,严重影响生命健康。因此,研究ICH发病机制以及寻找防治新靶点在临床上具有重要意义。研究表明[1],ICH发生时,小胶质细胞(microglia,MG)作为中枢神经系统的重要免疫防线,首先做出反应,其活化后参与调控脑损伤引起的炎性反应,在神经损伤反应过程中起到关键作用。临床上右美托咪定(Dexmedetomidine,DEX)广泛用于重症病患的镇静、镇痛。大量研究证实,DEX具有抑制炎性反应、抗氧化、抗凋亡等作用,对脑、心肌等多种组织器官缺血再灌注损伤具有保护作用[2]。近年来有研究表明[3],DEX能够通过抑制MG活化以及P2X7受体(Purinergic P2X7 receptor,P2X7R)激活发挥脑保护作用。但临床上DEX对ICH造成的脑损伤的作用研究较少。现已发现微小RNA(microRNA)作为重要的基因调控分子,在机体炎性反应和免疫应答中发挥重要作用[4]。研究显示,miR-150-5p在胶原酶诱导的出血性中风大鼠的血浆中表达上调[5],但其在ICH大鼠中的作用还未有研究。本文通过构建ICH大鼠模型,旨在探讨DEX对ICH大鼠MG活化的影响以及miR-150-5p/P2X7R轴的调控作用。
1.1实验动物:SPF级雄性SD大鼠65只,6周龄,体质量200-220g(广州中医药大学,许可证号为SCXK(粤)2018-0034)。饲养环境为:温度(22-25)℃,湿度为50%~55%,昼夜交替为12h∶12h。实验前适应性饲养1周,期间自由采食饮水。所有动物实验均按照本院国家卫生研究院和伦理委员会发布的《实验动物护理与使用指南》进行,且符合动物的3R原则。
1.2实验药物与试剂:DEX(四川省维克奇生物科技有限公司);
miR-150-5p antagomir及其阴性对照NC antagomir(百奥迈科生物技术有限公司);
HE染色试剂盒、TNF-α、IL-1β ELISA试剂盒、TRIzol试剂盒和DAB显色试剂盒(均购买于北京索莱宝);
SuperScript IV反转录试剂盒(美国Thermo Fisher公司);
P2X7R抗体(美国EMD Millipore公司);
Iba-1抗体(Alexa Fluor®488荧光)、β-actin抗体、羊抗兔IgG(HRP标记)(英国Abcam公司);
miR-negative control(NC)、miR-150-3p mimics(上海汉恒生物科技有限公司);
293T细胞(深圳市豪地华拓生物科技有限公司)。
1.3大鼠的分组及处理:将大鼠分为假手术(sham)组(n=12)与模型(model)组(n=63)。参照文献[6]方法建立ICH大鼠模型:大鼠用戊巴比妥钠麻醉后,在脑立体定位仪上固定大鼠头部,对正中部位的头皮进行消毒、切口,然后分离骨膜,暴露冠状缝、前囱。在前囱前2.0mm、中线右侧3.0mm的地方钻一个1.0mm直径的圆孔,使用微量注射器经股动脉抽取血液50μL,并将其缓慢注射至圆孔内(速度2μL/min),微量注射器在原地停留10min,以防止回流,最后将伤口缝合,并进行消毒以防感染。通过观察主要出血部位是海马CA2区,出血量约25%。提尾时自行向右侧转圈或内收为造模成功标准[7]。造模成功的大鼠随机分为DEX低剂量(DEX-L)组、DEX高剂量(DEX-H)组、DEX+NC antagomir组和DEX+miR-150-5p antagomir组,每组12只。DEX低剂量组腹腔注射DEX 25μg/kg,DEX高剂量组腹腔注射DEX 50μg/kg,DEX+NC antagomir组腹腔注射DEX 50μg/kg和NC antagomir(20nmoL/L)5μL,DEX+miR-150-5p antagomir组腹腔注射DEX 50μg/kg和miR-150-5p antagomir(20nmoL/L)5μL,假手术组腹腔注射等量生理盐水,每日1次,每次0.2mL,连续给药7 d。
1.4神经功能评分:末次给药结束后24h,根据改良后的Garcia行为学评分法[8]从自主运动(0~3分)、体态对称性(1~3分)、前肢伸展运动(0~3分)、两侧胡须触摸反应(1~3分)、抓持和攀爬铁笼能力(1~3分)和两侧身体触觉反射(1~3分)6个方面对各组大鼠进行神经功能评分,得分总和作为最终神经功能评分,分数越低提示神经功能损伤越严重,功能正常时得分最高为18分,功能损伤最严重时得分最低为3分。
1.5ELISA检测血清TNF-α、IL-1β含量:神经功能评分结束后,经颈静脉取血0.5mL,离心分离血清,按照ELISA试剂盒说明书绘制标准曲线,计算TNF-α、IL-1β含量。
1.6脑组织含水量的测定:取血完成后,每组随机挑选4只大鼠,称重后麻醉,断颈处死大鼠取脑组织,滤纸吸取脑组织表面液体称取湿重,置于100℃烘箱中24h后称取干重。根据干湿重法计算脑组织含水量:含水量=(湿重-干重)/湿重×100%。
1.7HE染色观察脑组织病理变化:各组随机选取4只大鼠,取出血区脑组织,固定后制备常规石蜡切片,HE染色后置于光学显微镜下观察大脑皮层病理变化。
1.8免疫荧光观察MG细胞形态:取1.7制备好的石蜡切片,进行脱蜡处理,运用磷酸盐缓冲液(PBS)反复漂洗,修复后,加入2%牛血清白蛋白(BSA)封闭1h,漂洗后加入兔抗鼠Iba-1一抗(1∶500),4℃孵育过夜,再次漂洗后加入二抗(1∶1000),室温孵育1h,PBS漂洗,光学显微镜下观察MG细胞形态。显微镜下拍照后采用ImageJ软件对阳性染色细胞进行计数。
1.9qRT-PCR法检测脑组织miR-150-5p、P2X7R mRNA相对表达:取剩余大鼠,处死后分离出血区脑组织,部分组织加入TRIzol试剂提取总mRNA,逆转录合成cDNA,以U6、β-actin为内参进行qRT-PCR扩增,检测miR-150-5p、P2X7 mRNA相对表达。实验结果采用2-ΔΔCt法进行计算。引物序列见表1。

表1 引物序列
1.10Western blot法检测脑组织Iba-1、P2X7R蛋白表达:加入蛋白裂解液提取1.9剩余大鼠出血区脑组织总蛋白,采用BCA法检测总蛋白浓度。取30μg蛋白上样进行电泳、转膜,TBST清洗后加入4%脱脂牛奶封闭2h,加入Iba-1(1∶500)、P2X7R(1∶1000)、β-actin(1∶1000)一抗,4℃孵育过夜,TBST清洗后加入HRP标记的羊抗兔IgG二抗(1∶2500)。室温下孵育2h,TBST清洗后利用DAB显色试剂盒显色,凝胶成像系统拍照,分析条带灰度值。目标蛋白相对表达量=目的条带灰度值/内参(β-actin)条带灰度值。
1.11双荧光素酶报告基因实验:通过TargetScan数据库预测miR-150-5p的下游靶基因可能为P2X7R。PCR扩增P2X7R mRNA与miR-150-5p潜在的野生结合位点,构建P2X7R野生型(P2X7R-WT)和突变型(P2X7R-MUT)重组质粒载体,将miR-NC、miR-150-5p mimics与P2X7R-WT、P2X7R-MUT共同转染至293T细胞上,37℃培养箱培养48h后,收集并裂解细胞,使用双荧光素酶报告基因分析。
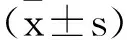
2.1DEX对ICH大鼠神经功能评分的影响:给药7d后,与假手术组比较,模型组大鼠神经功能评分明显降低(P<0.05);
与模型组比较,DEX低、高剂量组大鼠神经功能评分均明显升高(P<0.05);
与DEX高剂量组、DEX+NC antagomir组比较,DEX+miR-150-5p antagomir组神经功能评分显著下降(P<0.05)。见表2。

表2 各组大鼠神经功能评分的比较
2.2DEX对ICH大鼠血清中炎性因子含量以及脑组织含水量的影响:与假手术组比较,模型组大鼠血清中TNF-α、IL-1β含量以及脑组织含水量明显升高(P<0.05);
与模型组比较,DEX各剂量组大鼠血清中TNF-α、IL-1β含量及脑组织含水量明显降低(P<0.05);
与DEX高剂量组、DEX+NC antagomir组比较,DEX+miR-150-5p antagomir组上述指标水平显著升高(P<0.05)。见表3、表4。

表3 各组大鼠血清中TNF-α IL-1β含量的比较

表4 各组大鼠脑组织含水量的比较
2.3DEX对ICH大鼠脑组织病理学变化的影响:假手术组大鼠脑组织中未见出血灶,大脑皮质细胞形态正常,排列规律,结构整齐;
模型组大鼠脑组织中大量红细胞与炎性细胞浸润,细胞排列凌乱,出现溶解坏死和核固缩现象;
DEX各剂量组病理变化逐渐减轻,红细胞与炎性细胞数量减少,核固缩现象减少;
DEX+NC antagomir组的病理变化与DEX-H组的基本一致;
DEX+miR-150-5p antagomir组可见大量红细胞和炎性细胞浸润,大脑皮质细胞结构紊乱,细胞排列无序。见图1。

图1 各组大鼠脑组织病理变化(HE,×400)
2.4DEX对ICH大鼠MG细胞形态变化的影响:假手术组MG数量较少,且胞体小,分支与突起细长,未见活化;
与假手术组比较,模型组大鼠脑组织中MG数量明显增加,胞体变大,细胞突起与分支缩短变粗,MG活化;
与模型组比较,DEX各剂量组MG数量明显减少,胞体变小;
与DEX高剂量组、DEX+NC antagomir组比较,DEX+miR-150-5p antagomir组MG数量显著增多,胞体变大。见图2。定量分析结果显示,6组MG数量差异有统计学意义(F=126.561,P=0.000);
模型组MG数量[(139.46±12.38)个/视野]明显多于假手术组[(3.59±0.41)个/视野](P<0.05),DEX低、高剂量组MG数量[(98.67±11.42)个/视野、(43.79±6.21)个/视野]明显少于模型组(P<0.05),DEX+miR-150-5p antagomir组MG数量[(119.72±12.48)个/视野]明显多于DEX高剂量组、DEX+NC antagomir组[(45.86±6.25)个/视野](P<0.05)。

图2 各组大鼠脑组织中MG形态的变化(免疫荧光,×400)
2.5DEX对ICH大鼠脑组织中miR-150-5p、P2X7R mRNA表达的影响:与假手术组比较,模型组大鼠脑组织中miR-150-5p表达显著降低(P<0.05),P2X7R mRNA表达显著升高(P<0.05);
与模型组比较,DEX各剂量组大鼠脑组织中miR-150-5p表达显著升高(P<0.05),P2X7R mRNA表达显著降低(P<0.05);
与DEX高剂量组、DEX+NC antagomir组比较,DEX+miR-150-5p antagomir组脑组织中miR-150-5p表达显著降低(P<0.05),P2X7R mRNA表达显著升高(P<0.05)。见表5。

表5 各组大鼠脑组织中miR-150-5p P2X7R mRNA表达的比较
2.6DEX对ICH大鼠脑组织中Iba-1、P2X7R蛋白表达的影响:与假手术组比较,模型组大鼠脑组织中Iba-1、P2X7R蛋白表达显著增加(P<0.05);
与模型组比较,DEX各剂量组Iba-1、P2X7R蛋白表达显著降低(P<0.05);
与DEX高剂量组、DEX+NC antagomir组比较,DEX+miR-150-5p antagomir组脑组织中Iba-1、P2X7R蛋白表达显著升高(P<0.05)。见图3、表6。

表6 各组大鼠脑组织中Iba-1 P2X7R蛋白表达的比较

图3 各组大鼠脑组织中Iba-1、P2X7R蛋白表达A:sham;
B:model;
C:DEX-L;
E:DEX-H;
E:DEX+NC antagomir;
F:DEX+miR-150-5p antagomir
2.7P2X7R是miR-150-5p的下游靶基因:通过Target Scan软件对miR-150-5p的靶基因进行预测,P2X7R 3’端存在miR-150-5p的互补序列,见图4。通过双荧光素酶报告基因实验对miR-150-5p的靶基因验证发现,miR-150-5p mimics能够显著增加P2X7R-WT的荧光素酶活性(P<0.05),而对P2X7R-MUT的荧光素酶活性无明显影响(P>0.05)。见表7。

图4 miR-150-5p靶向调控P2X7R表达

表7 荧光素酶活性的比较
ICH发病率高、致死率高,严重影响病患健康,但目前对于ICH尚无有效的防治手段。炎性反应是ICH后导致脑损伤的主要病理机制,MG是神经系统中主要的免疫细胞,其活化后促进组织TNF-α、IL-1β等炎性因子的分泌[9]。本研究结果表明ICH模型大鼠神经功能评分下降,脑组织中大量红细胞与炎性细胞浸润,细胞排列凌乱,出现溶解坏死和核固缩现象,提示大鼠神经功能受损。免疫荧光法检测MG形态变化,结果显示ICH模型大鼠MG数量增加,胞体变大,细胞突起与分支缩短变粗;
Iba-1是MG的一种主要标记抗体,ICH模型大鼠脑组织中Iba-1蛋白表达明显升高,提示ICH后MG活化。此外,ICH模型大鼠血清中TNF-α、IL-1β含量升高,进一步说明ICH造成的脑损伤与起机体炎性反应的发生相关。以上结果均提示ICH造模成功。
DEX已被证实具有减少炎性因子释放,改善机体免疫、抑制氧化应激的作用[3]。已有研究显示,DEX能够改善ICH大鼠的神经功能损伤和氧化应激损伤并抑制神经细胞凋亡[10]。但DEX对MG活化的影响及调节机制尚不清楚。本研究结果表明,DEX干预后的ICH大鼠神经功能评分增加,血清中TNF-α、IL-1β含量下降,与上述研究相同,说明DEX能够恢复ICH大鼠的神经功能,并减轻大鼠体内炎症的发生。此外,我们还观察到DEX干预使ICH大鼠脑组织病变减轻,MG数量减少,逐渐恢复静息状态,脑组织中Iba-1蛋白表达下降,提示DEX对ICH后MG活化具有抑制作用,且通过抑制MG活化减轻ICH大鼠炎症的发生。
研究表明,P2X7R是主要在免疫细胞以及上皮细胞中表达的嘌呤受体离子通道,且DEX的作用机制与调控P2X7R通路有关[3]。另有研究表明,P2X7R能够在中枢神经系统中表达,促进MG活化,诱导炎性因子的释放,参与多种神经疼痛调节过程[11]。一些MicroRNA被证实在ICH炎性反应以及ICH引起的细胞凋亡等发生发展中起着重要作用[12]。既往研究显示,骨关节炎患者外周血中miR-150与P2X7R mRNA水平呈负相关[13],且本研究通过软件预测和双荧光素酶报告基因实验结果表明,P2X7R确实是miR-150-5p的作用靶点。近期研究表明,miR-150-5p在老年急性缺血性脑卒中患者血清中下调表达,可作为诊断老年急性缺血性脑卒中的生物学标志物[14]。与此研究结果相似的是,本研究发现ICH模型大鼠脑组织中miR-150-5p表达降低,P2X7R mRNA和蛋白表达升高,二者趋势正好相反,提示miR-150-5p、P2X7R参与ICH发生发展,可能在ICH大鼠中发挥靶向调控作用。深入研究发现,与模型组比较,DEX各剂量组大鼠脑组织中miR-150-5p表达升高,P2X7R mRNA和蛋白表达降低,提示DEX能够上调ICH大鼠脑组织中miR-150-5p的表达,下调P2X7R表达,进而影响阻碍MG活化。DEX干预基础上加入miR-150-5p antagomir后大鼠血清中炎性因子含量和Iba-1蛋白表达升高,组织结构病变加重,P2X7R表达升高,再次证实DEX能够通过调控miR-150-5p/P2X7R轴抑制MG活化,进而减轻炎症反应的发生,在ICH中发挥保护作用。
综上所述,DEX可抑制MG活化,在ICH中发挥保护作用的机制可能与上调miR-150-5p、下调P2X7R表达有关。
猜你喜欢脑组织活化神经功能无Sn-Pd活化法制备PANI/Cu导电织物材料与冶金学报(2022年2期)2022-08-10间歇性低氧干预对脑缺血大鼠神经功能恢复的影响天津医科大学学报(2021年3期)2021-07-21生姜对亚硝胺合成及体内代谢活化的抑制作用云南化工(2020年11期)2021-01-14小学生活化写作教学思考作文成功之路·小学版(2020年6期)2020-07-27小脑组织压片快速制作在组织学实验教学中的应用中国组织化学与细胞化学杂志(2017年1期)2017-06-15芒果苷对自发性高血压大鼠脑组织炎症损伤的保护作用中成药(2017年6期)2017-06-13不同程度神经功能缺损的脑梗死患者血尿酸与预后的相关性研究安徽医科大学学报(2015年9期)2015-12-16辛伐他汀对脑出血大鼠神经功能的保护作用及其机制探讨山东医药(2015年38期)2015-12-07山楂叶总黄酮对2型糖尿病大鼠脑组织的保护作用医学研究杂志(2015年12期)2015-06-102,4-二氯苯氧乙酸对子代大鼠发育及脑组织的氧化损伤作用癌变·畸变·突变(2015年3期)2015-02-27







