OSTC对头颈部鳞状细胞癌预后及免疫治疗的影响
时间:2023-06-16 12:15:04 来源:雅意学习网 本文已影响 人 
胡益 黄钧涛 施云斌 沈毅
头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)包括口腔、口咽、下咽和喉的恶性肿瘤。全球每年有超过830 000人被诊断患有HN‐SCC,超过430 000例患者死于这种疾病[1-2]。手术、放疗和化疗的多模式治疗策略是治疗HNSCC最常用的临床手段[2]。近年来,随着免疫抑制剂以及分子靶向药物研究的深入,复发性及转移性HNSCC的治疗策略变得更加多样化和复杂化。为了辅助诊断、制定个性化的治疗方案,开发新的生物标志物以准确预测HN‐SCC患者的预后至关重要。研究报道,通过触发包括未折叠蛋白(unfolded protein response,UPR)反应在内的一系列适应性应激反应,癌细胞可以适应营养、氧气缺乏相关的微环境限制,恢复内质网蛋白稳态[3-4]。未折叠蛋白质在内质网进行糖基化,其中糖蛋白上的聚糖链通过天冬酰胺的酰胺基与多肽链共价相连形成的N-糖基化参与蛋白质折叠和质量控制,为精确指导蛋白质底物折叠和质量控制系统提供模板,因此,N-糖基化被认为与肿瘤的增殖、侵袭、转移、免疫逃逸密切相关[5-6]。另外,研究发现蛋白质低糖基化是激发UPR反应的途径之一,而寡糖组装径路的缺陷或寡糖转移酶亚基的突变是诱发UPR反应的重要因素。寡糖转移酶复合物非催化亚基(oligosaccha‐ride transferase complex non-catalytic subunit,OSTC)可与寡糖转移酶复合物的催化亚基(STT3a)相结合组成寡糖转移酶复合物(oligosaccharide transferase,OST)[7-8]。近年来,较多的研究强调了OST亚基基因突变引起的人类疾病,包括其在多种肿瘤中的异常表达,进而诱导肿瘤增长、凋亡、迁移、侵袭等行为[5,9-10]。然而,OSTC在HNSCC中的表达及其与疾病的病理特征、预后的关系尚不明确。本文通过数据挖掘分析OSTC对HNSCC预后及免疫治疗的影响,以期为后续研究OSTC基因在HNSCC发生、发展中的作用提供参考,现报道如下。
1.1 OSTC在HNSCC中的表达情况及与患者预后的关系分析 使用TIMER 2.0数据库(http://timer.cistrome.org)分析OSTC在不同肿瘤中的表达情况,对TCGA数据库中TCGA-HNSC队列的504例肿瘤样品及44例正常癌旁组织样品进行差异分析,分析其OSTC的表达差异。根据OSTC表达量的中位数,将TCGA-HNSC队列的肿瘤样品分为高表达组和低表达组,采用Survival和Survminer R软件包进行Kaplan-Meier分析,评估OSTC高表达组、低表达组在总体预后及无进展生存期的差异。
1.2 OSTC表达量与HNSCC患者临床特征的关系分析 分析OSTC高表达组、低表达组的临床特征(包括年龄、性别、肿瘤分级、临床分期、T分期、N分期)差异,并绘制热图及箱式图。
1.3 构建预后预测列线图 采用单因素联合多因素Cox预后分析临床病理特征及OSTC表达量对预后的影响。当某项因素在两种分析中均P<0.05时,可以认为该特征是预后的独立影响因素,随后以此构建预后预测列线图。采用校准曲线分析1、3、5年生存的预测可靠性。
1.4 生物学功能分析 使用基因集富集分析(gene set enrichment analysis,GSEA)算法,通过它们在生物学功能和信号通路富集差异来识别并揭示HNSCC患者中OSTC高表达组、低表达组信号通路的差异,分析确定OSTC参与的生物学过程及功能。
1.5 免疫微环境分析 通过CIBERSORT算法对肿瘤免疫细胞浸润情况进行量化,采用Spearman秩相关分析免疫细胞浸润与OSTC表达的关系,分析OSTC与免疫检查点基因表达量的相关性,使用estimate包对肿瘤样品免疫微环境打分,并分析其在不同表达组间免疫微环境的差异。此外,分析OSTC表达量与免疫检查点基因表达的相关性,预测其免疫治疗效果。
1.6 免疫治疗及化疗疗效预测 通过分析TCIA数据库中的数据评估OSTC高表达组、低表达组使用的程序性死亡受体 1(programmed cell death protein 1,PD-1)、细胞毒性T淋巴细胞抗原4(cytotoxic T lymphocyte antigen-4,CTLA-4)治疗的疗效差异,采用免疫表型评分(immunophenoscore,IPS)评估。使用 pRRophetic包计算4种HNSCC常用化疗药(顺铂、紫杉醇、多西他赛、吉西他滨)的药物50%抑制浓度(half maximal in‐hibitory concentration,IC50),评估高表达组、低表达组对化疗药物的敏感性。
2.1 OSTC在HNSCC中的表达情况及与患者预后的关系 TIMER 2.0数据库显示OSTC在HNSCC、浸润性乳腺癌、膀胱移行细胞癌、肾透明细胞癌、肺腺癌等多种肿瘤组织中表达值明显高于正常组织,见图1a(插页)。TCGA数据库中TCGA-HNSC队列的504例HNSCC肿瘤样品及44例正常癌旁组织样品差异分析结果显示OSTC在HNSCC中表达水平明显升高(P<0.05),见图1b(插页)。对OSTC高表达组、低表达组进行Kaplan-Meier生存分析,结果显示,OSTC表达水平与HNSCC患者的总生存时间(overall survival,OS)及无进展生存时间(progression free survival,PFS)均明显相关(均P<0.05),低表达组预后更好,见图1c-d(插页)。

图1 OSTC基因表达与临床相关性分析(a:OSTC基因在所有主要肿瘤与相应正常组织的差异表达情况;
b:OSTC基因在HNSCC与相应正常组织的差异表达情况;
c:OSTC表达水平与HNSCC患者OS的关系;
d:OSTC表达水平与HNSCC患者PFS的关系)
2.2 OSTC表达量与HNSCC患者临床特征的关系 对HNSCC样本的临床病理特征进行亚组分析,结果显示,OSTC的表达量与HNSCC患者肿瘤分级、临床分期、T分期、N分期明显相关(均P<0.05),而与年龄、性别无明显相关性(均P>0.05),见图2。

图2 不同临床特征分组的HNSCC患者OSTC表达水平(a:OSTC表达与临床特征差异热图;
b、c、d、e、f、g:分别为不同年龄、性别、肿瘤分级、临床分期、T分期、N分期的患者OSTC表达差异分析箱式图)
2.3 预后预测列线图 单因素Cox及多因素Cox分析表明,OSTC基因表达量HR值分别为1.549(95%CI:1.180~2.033)和 1.444(95%CI:1.093~1.907),具有较好的预测效能。此外,HNSCC患者的年龄和N分期也可认为是影响最终预后的独立预后因素,随后以此3项特征构建预后预测列线图。通过校准曲线分别分析1、3、5年的预测可靠性,提示预测结果与实际观察结果具有一致性。见图3。
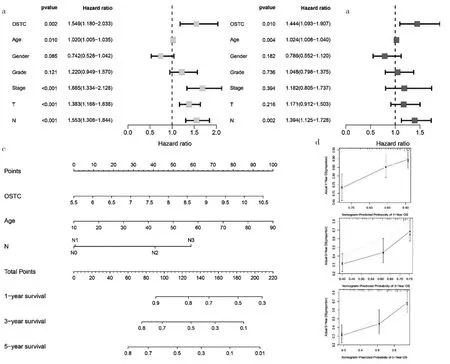
图3 预后预测列线图(a:单因素Cox分析;
b:多因素Cox分析;
c:预后预测列线图;d:校准曲线)
2.4 OSTC基因生物学功能富集分析结果 OSTC低表达组主要富集在基于免疫受体体细胞重组的适应性免疫反应、B细胞介导的免疫、B细胞受体信号通路、补体激活、循环免疫介导的体液免疫反应等,提示低表达与免疫治疗密切相关;
而基于KEGG的信号通路富集分析提示OSTC高表达组主要富集在细胞外基质通路、focal adhesion信号通路、神经活性配体-受体相互作用等通路上,低表达组主要富集在嗅觉传导通路及免疫缺陷信号通路。
2.5 免疫微环境分析结果 OSTC表达量与浆细胞、活化CD4+记忆T细胞、CD8+T细胞和Tregs细胞浸润呈负相关,上述免疫细胞在低表达组富集更多。OSTC与细胞程序性死亡蛋白1(programmed cell death pro‐tein 1,PDCD1)、CD244、CD27表达量呈负相关。低表达组免疫评分更高,而高表达组细胞外基质评分更高,两组整体ESTIMATE评分比较差异无统计学意义(P>0.05)。见图4(插页)。鉴于这些发现,或可认为OSTC低表达患者可能对免疫治疗更敏感。

图4 免疫微环境分析(a:免疫细胞浸润比较;b:OSTC表达量与免疫细胞的相关性;
c:OSTC表达量与免疫检查点基因的相关性;
d:高表达组、低表达组间免疫评分、细胞外基质评分、ESTIMATE评分的比较)
2.6 OSTC表达与免疫治疗及化疗疗效预测分析 通过分析TCIA数据库中IPS,OSTC低表达组PD-1、CT‐LA4+PD-1的IPS更高,且均差异有统计学意义(均P<0.05),对于CTLA4治疗,两组IPS比较差异无统计学意义(P>0.05),提示低表达组对PD-1和CTLA4+PD-1治疗更为敏感。顺铂、紫杉醇在OSTC高表达组的IC50值较低,提示高表达组患者可能对顺铂、紫杉醇化疗具有较高的药物敏感性。然而,多西他赛及吉西他滨在两组间比较差异无统计学意义。见图5。

图5 OSTC表达与免疫治疗及化疗疗效分析(a:PD-1、CTLA4疗效比较;
b:4种化疗药物疗效比较)
HNSCC由于确诊晚、易复发、易转移、治疗抵抗等特性,患者5年生存率较低。目前,大多数HNSCC患者的基本治疗仍然以手术、放化疗为主。然而,常用化疗药物如西妥昔单抗由于耐药性仅显示出中等疗效[2]。最新的派姆单抗的免疫疗法通过阻断PD-1/程序性死亡配体-1(programmed death ligand 1,PD-L1)信号通路来激活T淋巴细胞,抑制肿瘤细胞生长,为晚期、转移性或复发性HNSCC患者带来新的希望[11-13]。目前,基于对HNSCC免疫生物学的理解,研发新的生物标志物来改善HNSCC患者的临床管理,包括更好的预后评估和疾病监测将是开发更有效、毒性更小、特异性更高的靶向治疗的关键。
N-连接糖基化是真核细胞中重要的蛋白质修饰。研究发现,与邻近正常组织相比,肿瘤组织中通常表现出广泛的糖基化改变。寡糖转移酶复合物通过催化预组装的寡糖从脂联寡糖供体转移到糖基化受体位点(通常为N-X-T/S,其中X≠P)或新合成蛋白质序列子的天冬酰胺残基上[3]。目前已知的OST复合物由12个亚基组成,其中多个亚基被证明在肿瘤发生、增殖和转移中发挥着不同的作用[14-15]。Takahashi等[16]发现核糖体结合蛋白2(ribophorin2,RPN2)可以通过失活糖原合酶激酶-3b来稳定突变体p53,RPN2的过表达可促进乳腺癌的生长。同样,Ding等[17]发现核糖体结合蛋白1敲低可导致内质网应激诱导的细胞凋亡,从而抑制乳腺癌细胞增殖和侵袭。Shibatani等[18]通过蓝原生聚丙烯酰胺凝胶电泳解离核糖体相关膜蛋白后,首次证实了OSTC为OST复合物的新亚基。而后,Xie等[19]研究发现miR-1307通过钙网蛋白(cal‐reticulin,CALR)-OSTC-内质网蛋白折叠途径引起细胞周期蛋白失衡,进而导致细胞增殖失控,最终诱发肿瘤。另外通过CALR-OSTC-内质网蛋白折叠途径,miR-1307可影响癌蛋白和蛋白激酶(H-ras、PKM2和PLK1)的活性,从而促进肝癌的增殖发展,同时验证试验明确CALR敲低和过量OSTC都消除了miR-1307在肝癌中的致癌功能。
本研究首先通过TIMER 2.0数据库分析癌组织与相应的正常组织中OSTC基因的表达量,发现OSTC在多种癌组织中均有表达上调的现象。笔者重点关注到OSTC在HNSCC组织中表达异常。进一步通过对TCGA数据库中HNSCC的临床病理参数OSTC表达水平与HNSCC患者的OS及PFS的关系分析,发现OSTC高表达导致了HNSCC患者更差的预后。临床病理特征亚组比较表明,除年龄、性别亚组(可能由低病例样本引起)外,其余亚组与肿瘤预后均有相关性。基于上述结果,笔者认为这种新的预后预测列线图具有较高的预测价值。
CD8+T细胞作为获得性免疫系统的关键参与者,可通过PD-1/PD-L1免疫抑制轴消除肿瘤细胞、破坏免疫耐受并增强免疫治疗反应[20]。Hanna等[21]发现CD8+T细胞高浸润对于头颈癌患者抗PD-1/PD-L1治疗更有效。Nguyen等[22]发现OS和无复发生存期与较高表达的CD4+和CD8+呈正相关。通过研究免疫细胞浸润情况及相关分析,本研究发现OSTC低表达组表现出更多的免疫细胞浸润,尤其是CD8+T细胞,且OSTC表达量与CD8+、活化CD4+记忆T细胞呈负相关,认为OSTC的表达量可能可预测HNSCC免疫治疗效果。GSEA分析也提示OSTC低表达组主要富集在免疫受体细胞重组等多条体液免疫反应相关性通路,另外,通过分析TCIA数据库中的数据对PD-1和CTLA4的疗效比较也支持了OSTC低表达组表现出更好的免疫治疗反应。鉴于这些发现,OSTC的低表达可能增强HNSCC患者对免疫治疗的反应,可作为预测免疫治疗效果的一种潜在生物学标志。免疫治疗效果较差的OSTC高表达组则表现出对顺铂、紫杉醇化疗药物的高敏感性,对于免疫效果治疗不佳的患者提供了其他治疗思路。
本研究尚有不足,尽管通过数据挖掘分析探究了OSTC作为一种HNSCC发病驱动基因的可能性,但尚缺乏相关实验数据支撑。因此仍需进一步实验设计以全面评估OSTC表达与HNSCC患者临床病理特征之间的关系。
综上所述,OSTC有望成为HNSCC免疫治疗的一个新的生物标志物,为后续HNSCC的预后评估和疾病诊治提供重要的参考价值。
猜你喜欢 寡糖免疫治疗通路 肿瘤免疫治疗发现新潜在靶点中国生殖健康(2020年7期)2020-12-10癌症免疫治疗相关的PD1-PDL1通路作用机制及其研究进展天津医科大学学报(2019年3期)2019-08-13壳寡糖在农业生产中的应用中国化肥信息(2018年6期)2018-08-23HPLC法测定远志及其3种炮制品中3种寡糖酯中成药(2017年8期)2017-11-225%氨基寡糖素AS在番茄上的应用效果初探现代农业(2016年6期)2016-02-28暴发型流行性脑脊髓膜炎早期诊断及免疫治疗探讨中外医疗(2015年18期)2016-01-04Kisspeptin/GPR54信号通路促使性早熟形成的作用观察中国病理生理杂志(2015年8期)2015-12-21非小细胞肺癌免疫治疗临床新进展医学研究杂志(2015年5期)2015-06-10proBDNF-p75NTR通路抑制C6细胞增殖医学研究杂志(2015年3期)2015-06-10巴戟天寡糖胶囊和氟西汀治疗肠易激综合征的效果比较中国当代医药(2015年31期)2015-03-01









