PCBP4对肝癌细胞增殖的影响及机制
时间:2023-06-08 17:50:26 来源:雅意学习网 本文已影响 人 
杜双秋,王 芸,孙林林,裴文俊,高家林,2,章 尧
(1.皖南医学院 a.安徽省活性生物大分子研究重点实验室;
b.生物化学与分子生物学教研室;
c.药学院,安徽 芜湖 241002;
2.皖南医学院第一附属医院 弋矶山医院 内分泌科,安徽 芜湖 241001)
原发性肝癌目前是世界上第三大致命癌症[1]。作为原发性肝癌的主要病理分型,肝细胞肝癌(hepatocellular carcinoma,HCC)的五年生存率为18%,仅次于胰腺癌[2]。手术治疗是目前最具潜力的根治性疗法[3]。但由于HCC恶性程度高、病情进展迅速以及易转移等特点,有机会进行手术的HCC患者比例较低。因此,HCC早期标志物和精准治疗靶点的探寻十分重要。
多聚(rC)结合蛋白4[Poly(rC) binding protein 4,PCBP4]是PCBP家族的成员之一,是一种RNA结合蛋白。PCBP4在转录后的调控过程中起关键作用,如mRNA的稳定性、选择性剪接和蛋白翻译过程[3-4]。PCBP家族亦被证明与癌症进展密切相关,主要集中于甲状腺癌和前列腺癌[5-7]。抗肿瘤药物在发挥抑制肿瘤的过程中参与调控PCBP4的表达[8]。研究指出在低分化和高度增殖的肺腺癌和鳞状细胞癌中PCBP4的表达水平明显下调[9]。PCBP4也被证明是一种新的p53靶基因[10]。p53是一种肿瘤抑制因子,其可通过诱导细胞基因参与细胞周期的调节来抑制细胞增殖。在HCC中,PCBP4的影响作用尚未报道。本研究旨在探讨PCBP4的表达对HCC增殖的影响及其可能机制,为肝癌的发生发展提供潜在的诊断标志物或治疗靶点。
1.1 数据库分析 使用癌症基因组图谱(TCGA:http://tcgadata.nci.nih.go-v/tcga/)数据库中的数据采用Wilcox检验方法分析肝癌配对样本(癌旁组织50例,癌组织50例)与非配对样本(癌旁组织50例,癌组织374例)中PCBP4基因的差异性表达;
采用Kaplan-Meier Plotter在线分析PCBP4高表达组与PCBP4低表达组中肝癌患者的预后情况。
1.2 细胞培养 人肝癌细胞HepG2和Hep3B细胞购于上海中科院细胞库。细胞在含有10%胎牛血清的DMEM(Gibco,USA)培养基中于37℃和5%CO2的培养箱中培养。
1.3 细胞转染与细胞模型构建 PCBP4-siRNA购于广州瑞博生物科技有限公司。siRNA靶序列:GCGAGACTGTAAAGCGAAT。根据LipofectamineTM3000(赛默飞-L3000015)转染试剂的操作说明,细胞密度在70%~80%汇合度时转染。成功构建HepG2-NC对照组、HepG2-siPCBP4干扰组,Hep3B-NC对照组、Hep3B-siPCBP4干扰组细胞模型。
1.4 实时荧光定量PCR 用TRIzol提取RNA的方法得到总RNA,然后使用cDNA合成试剂盒(10071325,赛默飞,美国)反转录成cDNA。q-PCR采用染料法,使用Luna®Universal q-PCR Master Mix试剂在美国应用生物7500仪器上进行反应。反应参数:95℃ 1 min(预热),95℃ 15 s,60℃ 30 s(40个循环)溶解曲线(95℃ 15 s,60℃ 1 min,95℃ 15 s)。引物在上海生工生物技术有限公司合成。引物序列,正向:GGGCGAGACTGTAAAGCGAATCC;反向:CGGTGATGGTGGTGATGCGTTC。以β-actin为内参基因,采用2-ΔΔCt法计算基因相对表达量。
1.5 Western blot 细胞使用RIPA裂解液和PMSF的混合物充分溶解,在超声破碎仪中破碎细胞。使用Nano 2000微量分光光度计测定细胞蛋白的浓度。细胞蛋白(40 μg)在12%的SDS-PAGE中进行分离,然后转移至PVDF膜中,在室温下使用5%脱脂牛奶进行封闭,4℃孵育一抗过夜,室温孵育相应的二抗2 h,使用化学发光试剂ECL在凝胶成像仪上进行成像。本研究使用的抗体:PCBP4(美国,Thermo Fisher Scientific,PA5-50704)、CDK1(中国,碧云天,AF1516)、CDK2(中国,碧云天,AF1063)、cyclinB1(中国,abclonal,A16038)和β-actin(美国,Sigma,A1978)。
1.6 CCK-8实验 根据CCK-8检测试剂盒的说明对细胞活力进行检测。将转染好的细胞以5×103的密度接种于96孔板中,在细胞生长12、24、48、72 h后,以1∶10的比例加入CCK-8试剂混合液,培养箱内孵育2 h。然后使用检测微板阅读器(美国BioTeK)在450 nm处的OD吸光度进行检测。
1.7 Edu增殖实验 使用Edu增殖试剂盒检测细胞的增殖能力。细胞接种到24孔板中,待细胞贴壁后,将细胞与Edu溶液孵育2 h。PBS洗涤3次,4%多聚甲醛固定细胞,甘氨酸溶液进行中和,与Apollo®荧光染料反应。最后用Hoechst33342反应液对细胞核进行染色。结果用荧光倒置显微镜(Olympus,日本)进行观察和采集。使用ImageJ软件进行统计分析。
1.8 本研究每组实验至少进行3次重复。
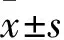
2.1PCBP4基因在HCC中表达及其预后
2.1.1PCBP4基因在HCC癌组织中的表达 非配对样本中,PCBP4基因在癌组织中的表达水平高于癌旁组织(图1A,t=16.906,P<0.001);
配对样本分析结果与非配对样本一致,癌组织中PCBP4基因的表达水平高于癌旁组织(图1B,t=10.336,P<0.001)。
2.1.2PCBP4基因在HCC癌组织中的表达与其预后的相关性分析 如图2所示,PCBP4基因高表达组患者相较于低表达组患者的总体生存期和无病生存期较差(P<0.05)。
2.2 干扰PCBP4基因表达的肝癌细胞模型的验证 在HepG2和Hep3B肝癌细胞中,干扰组(si-PCBP4)中的mRNA的表达水平低于对照组(NC)(图3A,t=41.930,P<0.001;
图3B,t=34.130,P<0.001),且干扰组中的蛋白表达水平仍低于对照组(图3C,t=4.844,P<0.01;
图3D,t=4.862,P<0.01)。

***P<0.001。

*P<0.05。

**P<0.01,***P<0.001。
2.3 干扰PCBP4基因表达对肝癌细胞增殖活力的影响 与对照组相比,PCBP4基因的下调抑制了肝癌细胞的增殖活力(图4A,24 h,t=2.815,P=0.048;
48 h,t=3.726,P=0.024;
72 h,t=5.815,P=0.004;
图4B,24 h,t=4.625,P=0.009;
48 h,t=8.478,P=0.001;
72 h,t=6.148,P=0.004)。Edu细胞增殖实验结果与上述实验一致,PCBP4基因的下调抑制了肝癌细胞的增殖(图4C,t=5.351,P=0.006;
图4D,t=4.304,P=0.013)。
2.4PCBP4基因表达下调对肝癌细胞的细胞周期相关蛋白的影响 相较于对照组,PCBP4基因表达下调导致CDK1、CDK2和cyclinB1表达水平均下降(图5A,CDK1:t=3.209,P=0.033,CDK2:t=16.650,P<0.001;
cyclinB1:t=2.961,P=0.042;
图5B,CDK1:t=3.554,P=0.024;
CDK2:t=4.827,P=0.009;
cyclinB1:t=6.131,P=0.004)。

scale bar:100 μm。*P<0.05,**P<0.01。

*P<0.05,**P<0.01,***P<0.001。
PCBP蛋白家族成员已被证明可参与HCC的进展过程。研究显示,PCBP1具有结合氧化RNA的能力,因此参与细胞对氧化条件的反应,有助于诱导细胞凋亡[11];
PCBP1也可通过调节CD44基因的选择性剪接来抑制人肝癌细胞系HepG2细胞的侵袭[12]。PCBP2通过与单链多聚(rC)基序的直接结合,在各种信号分子的转录和翻译调节中起重要作用[13]。PCBP2基因的过表达导致HCC预后不良并促进癌细胞的增殖[13-14]。由此可见,PCBP蛋白家族的不同成员在HCC的进展过程中可能存在完全不同的作用。相较于其他成员,PCBP4在HCC中的研究鲜有报道。PCBP4也称为MCG10和p53肿瘤抑制因子的靶标,PCBP4的异位表达可诱导G2/M细胞周期阻滞和细胞凋亡[10,15]。研究发现,PCBP4基因缺陷的小鼠容易患肺腺癌、淋巴瘤和肾肿瘤[15]。而PCBP4基因的表达与HCC发生发展的机制尚不清楚。本研究通过生物信息学分析发现,PCBP4基因在人HCC中明显高表达,且高表达组患者的总体生存期和无病生存期明显低于低表达组,提示不良预后。因此,本课题组推测PCBP4可能与HCC的发生发展密切相关,其具备作为肝癌预后标志物的潜力。
过度增殖是肿瘤细胞持续发展的典型特征。本研究结果显示,抑制PCBP4基因的表达可有效抑制肝癌细胞的增殖活力。确认的是,细胞增殖受到细胞周期进程的调控。因此,细胞周期进程的失调往往导致恶性肿瘤不可控的过度增殖[16]。肿瘤相关细胞周期的调控通常是由细胞周期依赖性蛋白激酶(CDK)家族介导[17],比如CDK1和CDK2,两者也是重要的细胞增殖蛋白[18]。本课题组发现PCBP4基因表达水平的抑制可明显下调CDK1和CDK2的表达进而抑制细胞周期进程,这与抑制PCBP4基因表达导致细胞增殖活力下降的结果一致。先前的一项研究表明,PCBP4基因的表达可导致结肠癌和肺癌细胞的G2/M期转化停滞和细胞凋亡[19]。细胞周期相关蛋白cyclinB1表达水平的下调可有效阻滞G2/M期的转化,这一机制被利用于抗肿瘤药物的研发[20-21]。在本研究中,抑制PCBP4基因的表达则促使人肝癌细胞中cyclinB1的表达下调。
总之,本研究表明PCBP4基因的过度表达与HCC的不良预后相关且促进肝癌细胞增殖。当PCBP4基因的表达受抑制后,肝癌细胞增殖活力明显下降且cyclinB1的表达水平明显下调,这些结果表明PCBP4可能通过调控G2/M期的转化来影响肝癌细胞的进展。需要注意的是,PCBP4在不同组织来源的肿瘤细胞中对G2/M期的影响有所不同,且PCBP蛋白家族的不同成员在肿瘤进展中的作用也存在差异[15,22]。因此,PCBP4乃至PCBP蛋白家族成员在不同肿瘤疾病中的作用机制以及是否能够作为防治靶点仍需进一步探究。
猜你喜欢 细胞周期肝癌蛋白 lncRNA LINC01206调控银屑病角质形成细胞的功能研究皮肤性病诊疗学杂志(2021年5期)2021-11-27XB130在肝癌组织中的表达及其对细胞侵袭、迁移的影响昆明医科大学学报(2021年4期)2021-07-23植物细胞周期如何“刹车”?三农资讯半月报(2021年1期)2021-01-27隐源性肝癌与病毒性肝癌临床特征比较中西医结合肝病杂志(2020年2期)2020-10-27ITSN1蛋白磷酸化的研究进展天津医科大学学报(2019年6期)2019-08-13LCMT1在肝癌中的表达和预后的意义天津医科大学学报(2019年3期)2019-08-13硫酸高乌甲素对人肝癌HepG2细胞增殖、凋亡与细胞周期的影响中成药(2017年9期)2017-12-19知母皂苷AⅢ对白血病细胞HL-60增殖、凋亡和细胞周期的影响及机制探讨中成药(2017年7期)2017-11-22猪胎盘蛋白的分离鉴定中成药(2017年8期)2017-11-22SAK -HV 蛋白通过上调 ABCG5/ABCG8的表达降低胆固醇的吸收医学研究杂志(2015年7期)2015-06-22







