不同剂型普罗布考对大鼠肠系膜淋巴转运及药代动力学的影响
时间:2023-06-05 17:45:17 来源:雅意学习网 本文已影响 人 
张笑瑞, 曹 静, 吴倩倩, 刘季俊, 陈国元, 吴宝金
(1. 中国科学院分子细胞科学卓越创新中心动物实验技术平台,上海 200031; 2. 上海中医药大学实验动物中心,上海 200031)
普罗布考是一种人工合成的脂溶性抗氧化剂[1],具有降血脂[2]、抗动脉粥样硬化[3]、治疗糖尿病[4]等广阔的临床应用前景[5]。脂溶性药物因水溶性较差[6],不利于在胃肠道扩散吸收,导致它们的生物利用度降低[7],因此这类药物的口服吸收问题一直是制剂研发领域需要解决的难点。近年来,经肠系膜淋巴转运介导的口服吸收途径得到广泛关注[8-9]。研究发现,脂溶性药物能否特异性地被吸收到肠淋巴液中与乳糜微粒有关,药物在乳糜微粒中的含量越大,药物经肠系膜淋巴吸收的比例就越高,两者呈明显的线性相关[8-10]。体外实验表明,普罗布考在乳糜微粒中的含量最高可达38%[11-12]。因此,改变普罗布考的剂型在理论上会影响其经肠系膜淋巴系统转运吸收的比例,进而影响该药的药代动力学参数,但目前尚未检索到相关的研究报告。
大鼠肠系膜淋巴管插管是开展药物经肠系膜淋巴系统转运研究广泛使用的动物模型。然而制备该模型的手术难度高、成功率低,且动物处于麻醉或受限制的状态,无法模拟动物正常生理状态下的淋巴转运效果[9]。本实验室建立了一种新型大鼠肠系膜淋巴管-颈静脉辅助回流模型,避免了手术应激、全身麻醉或动物受限对肠系膜淋巴吸收的影响,实现大鼠在清醒、自由饮食状态下,实时并长期收集生理状态下肠系膜淋巴液的功能[13]。本研究即采用自主创建的大鼠肠系膜淋巴管-颈静脉辅助回流模型,研究普罗布考在橄榄油制剂及混悬液制剂状态下经肠淋巴吸收的比例,以及其药代动力学差异,以期为脂溶性药物的相关工作提供科学的研究模式和可靠的数据参考。
1.1 实验动物
SPF 级雄性SD 大鼠12 只,9 周龄,体质量为(280±9)g,购自浙江维通利华实验动物技术有限公司[SCXK(浙)2019-0001],质量合格证为20211221Aazz0 619000169。大鼠饲养于中国科学院分子细胞科学卓越创新中心实验动物屏障设施[SYXK(沪)2018-0007],自由饮水和饮食,温度20~25 ℃,相对湿度40%~70%,噪声≤60 dB,生活照明20 lx(12/12 h 明暗循环)。所有大鼠3 只/笼饲养,适应性饲养7 d 后开始实验。本研究中动物实验方案经中国科学院分子细胞科学卓越创新中心实验动物使用与管理委员会审核批准(IACUC No.SIBCB-S118340-2112-045)。
1.2 药品试剂与主要仪器
普罗布考(C31H48O2S2)原粉和柳胺酚(C13H11NO3)由凯惠药业(上海) 有限公司提供,批号为051M14375V 和23288-49-5;
普罗布考片剂由齐鲁制药(山东)集团有限公司提供,批号为H10980054;
色谱级乙腈(CH3CN)为美国Sigma-Aldrich公司生产,批号为S93271;
醋酸铵(NH4OAc)为美国TEDIA 公司生产的色谱纯试剂,批号为601058;
橄榄油(A0285378)为美国Acros 公司产品;
舒泰50(Zoletil 50)为法国Virbac 公司产品;
水为超纯水;
其他化学试剂均为分析纯。液相色谱质谱联用仪(API-4000)为美国Sciex 公司产品;
电子天平(Mettler-Toledo XP26)为瑞士Mettler Toledo 公司产品;
高速大容量低温离心机(5810R)为德国Eppendorf 公司产品;
小型摇床(Vibrax VXR)和振荡器(Vortex 3)为德国Ika公司产品;
超声波清洗器(KQ5200DA)为昆山市舒美超声仪器有限公司;
大鼠2 通道VAB 系绳(VABR2T/25)、大鼠2通道血管通路按钮(VABR2B/25R22)、大鼠2 通道VAB 回路连接器(VABR2L)、PinPort 进样器(PNP3M)、2 通道转子(375/D/25LT)、多轴平衡臂(MCLA/MED)、大鼠采样笼器具(MTANK/WF)和聚氨酯(polyurethane,PU)导管(BTPU-027、BTPU-040)均购自美国Instech公司。
1.3 制剂配制
普罗布考橄榄油制剂:精密称取42.48 mg 普罗布考原粉,缓慢加入橄榄油定容至21.24 mL,涡旋1~2 min,超声10~15 min直至化合物完全溶解,得到质量浓度为2 mg/mL 的黄色澄清溶液。4 ℃低温保存备用,有效期为1周,使用前放至室温。
普罗布考混悬液制剂:精密称取93.89 mg 普罗布考片剂粉末(纯度为62.55%),缓慢加入10 mmol/L 磷酸盐生理盐水缓冲液(pH 7.4)定容至29.36 mL,涡旋2~3 min,超声30~40 min,得到质量浓度为2 mg/mL的白色混悬液。4 ℃低温保存备用,有效期为1周,使用前放至室温。
1.4 动物模型构建
动物麻醉:使用舒泰50 以50 mg/kg 的剂量对大鼠进行肌内注射,待观察到呼吸频率降低、肌肉舒张和无疼痛反射后,将大鼠固定于手术台上进行手术。
肠系膜淋巴管插管:术前对大鼠腹部剃除毛发并用75%乙醇溶液消毒,沿腹中线上腹部2/3处做正中切口,打开腹膜腔并暴露出左肾静脉和下腔静脉区域,此时可观察到与肠系膜动脉并行的肠系膜淋巴管。在体视显微镜下分离肠系膜淋巴管,在淋巴管上方45°角做切口,插入淋巴导管并深入1 cm,分别固定导管和淋巴管肠端。将导管另一端引导并接入颈部VAB的淋巴管端口。
颈静脉插管:在颈腹部左侧锁骨区域做切口,暴露颈外静脉,在血管上方45°角做切口,插入静脉导管并深入3.5 cm 到达左锁骨下静脉处,分别固定导管和颈静脉近心端。将导管另一端引导并接入VAB的颈静脉端口。完成插管后,将VAB 和VAB 回路连接器相连,缝合创口。
清醒活动装置连接:将VAB、2 通道VAB 系绳、转子、多轴平衡臂、采样笼盒连接,将收集导管放置在淋巴插管的高度[13]。
1.5 动物分组与用药实验
将12只大鼠随机分为4组:混悬液制剂-颈静脉单插管组(H-JD组),混悬液制剂-颈静脉和肠淋巴管双插管组(H-JCS 组),橄榄油制剂-颈静脉单插管组(G-JD 组),橄榄油制剂-颈静脉和肠淋巴管双插管组(G-JCS 组)。H-JD 组和G-JD 组大鼠行颈静脉单插管手术,建立颈静脉插管模型。H-JCS 组和G-JCS 组大鼠行颈静脉插管和肠系膜淋巴管双插管手术,建立肠淋巴管-颈静脉辅助回流模型,并结合清醒活动装置组成肠系膜淋巴液收集系统。
各组大鼠行插管手术后恢复7 d,H-JD 组与HJCS组大鼠口服灌胃普罗布考混悬液制剂20 mg/kg,GJD组与G-JCS组大鼠口服灌胃普罗布考橄榄油制剂20 mg/kg。各组大鼠在清醒状态下,分别于给药后0、0.25、0.5、1、2、4、8、24、48、72 h 通过颈静脉插管采集血液50 μL,其中H-JCS组和G-JCS组大鼠分别于给药后0~4、4~8 和8~24 h 时间段内连续采集淋巴液。
1.6 液相色谱和串联质谱联用(LC-MS/MS)法测定
测定条件:采用API-4000型液相色谱质谱联用仪进行测定。色谱柱为Ultimate XB-C8(2.1 μm×50 μm,5 μm,LD),流动相中乙腈和醋酸铵的比例为3∶17,流速为0.45 mL/min,进样量为5 μL,色谱柱温度为40 ℃。质谱检测方式为多反应监测(multiple reaction monitoring,MRM)模式进行二级质谱分析,负离子模式下扫描,电喷雾离子源。普罗布考与内标柳胺酚的检测离子对分别为m/z515.3/277.2 和m/z444.3/319.2,雾化气50 Psi,辅助雾化气50 Psi,离子去簇电压-45 V,碰撞活化电压-34 V,加热温度500 ℃。
样品处理:收集的全血样品用去离子水按1∶3比例稀释,淋巴液样品用肝素抗凝处理。在30 μL 全血和淋巴液样品中各加入150 μL 乙腈(含有100 ng/mL的内标柳胺酚),涡旋5 min,离心5 min(14 000 r/min),取上清液进行LC-MS/MS分析。
标准曲线制备:用空白全血和淋巴液分别配成不同浓度的普罗布考标准品系列,使其药物质量浓度分别为3 000、1 000、300、100、30、10、3 和1 ng/mL,按全血和淋巴液处理方法处理后,进行LC-MS/MS 分析。以普罗布考与内标柳胺酚的峰面积比(A)为纵坐标,普罗布考浓度(C)为横坐标,绘制标准曲线,并建立回归方程,求出其相关系数(R2)。
1.7 数据分析及统计
根据药物平均浓度-时间数据,采用WinNonlin 6.2软件按非房室模型计算普罗布考的药代动力学参数,包括到达峰值浓度(Cmax)、到达峰值时间(Tmax)、消除半衰期(T1/2)、药-时曲线下面积(AUC)、药物经肠系膜淋巴转运比例、相对生物利用度(Frel)和淋巴液剂量百分比。低于80%定量下限的数据不参与药代动力学参数的计算。数据分析使用GraphPad Prism 8.0软件,多组之间比较采用方差分析,组内两两比较采用LSD-t检验,以评价两种制剂的生物等效性。
2.1 普罗布考在全血和淋巴液中的标准曲线
普罗布考的色谱峰峰形尖锐且对称,样品与杂质分离良好,无明显干扰峰(图1)。全血中普罗布考的线性回归方程为y=517.3x+9 654(R2=0.999 2),表明全血普罗布考在1~3 000 ng/mL 质量浓度范围内线性关系良好,标准曲线见图2A。淋巴液中普罗布考的线性回归方程为y=230.62x+10 425(R2=0.999 2),表明淋巴液普罗布考在1~10 000 ng/mL 质量浓度范围内线性关系良好,标准曲线见图2B。以上方程式中,x代表药物浓度,y代表对应的峰面积。

图1 普罗布考色谱图Figure 1 Chromatogram of blood and lymph with and without probucol

图2 普罗布考的标准曲线图Figure 2 Standard curves of probucol in blood and lymph
2.2 全血药代动力学参数
各组大鼠口服普罗布考橄榄油制剂和普罗布考混悬液制剂后的血药浓度-时间数据见表1,药-时曲线如图3A。药-时数据经药代动力学程序软件WinNonlin 6.2 处理,药代动力学参数见表2。普罗布考在大鼠体内的药代动力学过程呈非房室模型。H-JD、HJCS、G-JD 和G-JCS 各组大鼠体内普罗布考的半衰期(T1/2) 分别为(12±1) h、(17±3) h、(13±3)h 和(19±11)h,说明普罗布考在大鼠体内消除较慢。经统计学分析,与H-JD 组和H-JCS 组相比,G-JD 组和G-JCS 组大鼠全血的Cmax、Tmax、AUClast、Frel和淋巴液的剂量百分比均显著升高(P<0.05);
其中G-JD 组全血的AUClast显著高于G-JCS 组,差异有统计学意义(P<0.05),其平均AUClast之差为4 280 h·ng·mL-1,而H-JD组和H-JCS组之间差异无统计学意义(P>0.05)。通过计算得出普罗布考橄榄油制剂经肠系膜淋巴转运比例高于普罗布考混悬液制剂(35%vs0%)。
表1 各组大鼠的血药浓度Table 1 Drug concentrations in the blood of rats in each group( ±s,n=3)

表1 各组大鼠的血药浓度Table 1 Drug concentrations in the blood of rats in each group( ±s,n=3)
注:H-JD组指混悬液制剂-颈静脉单插管组;
H-JCS组指混悬液制剂-颈静脉和肠淋巴管双插管组;
G-JD组指橄榄油制剂-颈静脉单插管组;
GJCS组指橄榄油制剂-颈静脉和肠淋巴管双插管组。Note: H-JD, suspension preparation-jugular vein single cannulation group; H-JCS, suspension preparation-jugular vein and intestinal lymphatic double cannulation group; G-JD, olive oil preparation-jugular vein single cannulation group; G-JCS, olive oil preparation-jugular vein and intestinal lymphatic double cannulation group.
采血时间Blood collection time/h 0 0.25 0.5 12482 4 48 72普罗布考Probucol ρ/(ng·mL-1)H-JD组H-JD group- - 5 34±7 62±48 126±91 104±87 67±30 12±5 5±1 H-JCS组H-JCS group- - -28±32 38±32 188±167 100±36 69±49 22±15 11±10 G-JD组G-JD group- - -13±5 76±30 143±26 379±138 289±296 85±23 15±5 G-JCS组G-JCS group- - - -19±23 82±119 128±184 252±189 48±13 18±1
表2 各组大鼠的全血药动学参数Table 2 Pharmacokinetic parameters of the whole blood of rats in each group( ±s,n=3)

表2 各组大鼠的全血药动学参数Table 2 Pharmacokinetic parameters of the whole blood of rats in each group( ±s,n=3)
注:H-JD组指混悬液制剂-颈静脉单插管组;
H-JCS组指混悬液制剂-颈静脉和肠淋巴管双插管组;
G-JD组指橄榄油制剂-颈静脉单插管组;
GJCS组指橄榄油制剂-颈静脉和肠淋巴管双插管组。AUClast指从给药时间开始到最后一个点这段时间的曲线下面积,AUCINF指从给药开始到理论外推无穷远这段时间的曲线下面积。Note: H-JD, suspension preparation-jugular vein single cannulation group; H-JCS, suspension preparation-jugular vein and intestinal lymphatic double cannulation group; G-JD, olive oil preparation-jugular vein single cannulation group; G-JCS, olive oil preparation-jugular vein and intestinal lymphatic double cannulation group. AUClast, the area under the curve from time zero to time of last measurable concentration;AUCINF,the area under the curve from time zero to infinity.
参数Parameters峰值时间Tmax/h峰值浓度Cmax/(ng·mL-1)半衰期T1/2/h药-时曲线下面积AUClast/(h·ng·mL-1)药-时曲线下面积AUCINF/(h·ng·mL-1)H-JD组H-JD group 11±12 148±60 12±1 3 210±885 3 293±899 H-JCS组H-JCS group 5±2 207±137 17±3 3 677±2 014 3 970±2 295 G-JD组G-JD group 13±9 453±204 13±3 12 360±6 629 12 623±6 650 G-JCS组G-JCS group 19±9 309±177 19±11 8 080±3 064 8 947±2 218
2.3 相对生物利用度
通过橄榄油制剂(实验制剂)的AUC 与混悬液制剂(对照制剂)的AUC相比,计算出Frel,结果见表3。以H-JD组为参比,G-JD组中普罗布考的Frel为(409±269)%。以H-JCS 组为参比,G-JCS 组中普罗布考的Frel为(309±256)%。结果提示,与H-JD 组和H-JCS组相比,G-JD组和G-JCS组的生物利用度明显提高。

表3 各组大鼠的相对生物利用度(Fre)lTable 3 Relative bioavailability(Frel)of rats in each group(n=3)
2.4 肠淋巴液药动学参数
肠淋巴管-颈静脉辅助回流模型大鼠口服普罗布考橄榄油制剂和普罗布考混悬液制剂后的淋巴液剂量百分比参数见表4,剂量百分比曲线如图3B。经统计学分析,与H-JCS 组相比,G-JCS 组大鼠淋巴液的剂量百分比显著升高(P<0.05)。
表4 各组大鼠的淋巴液剂量百分比参数Table 4 Dose percentage parameters of lymphatic fluid of rats in each group( ±s,n=3)
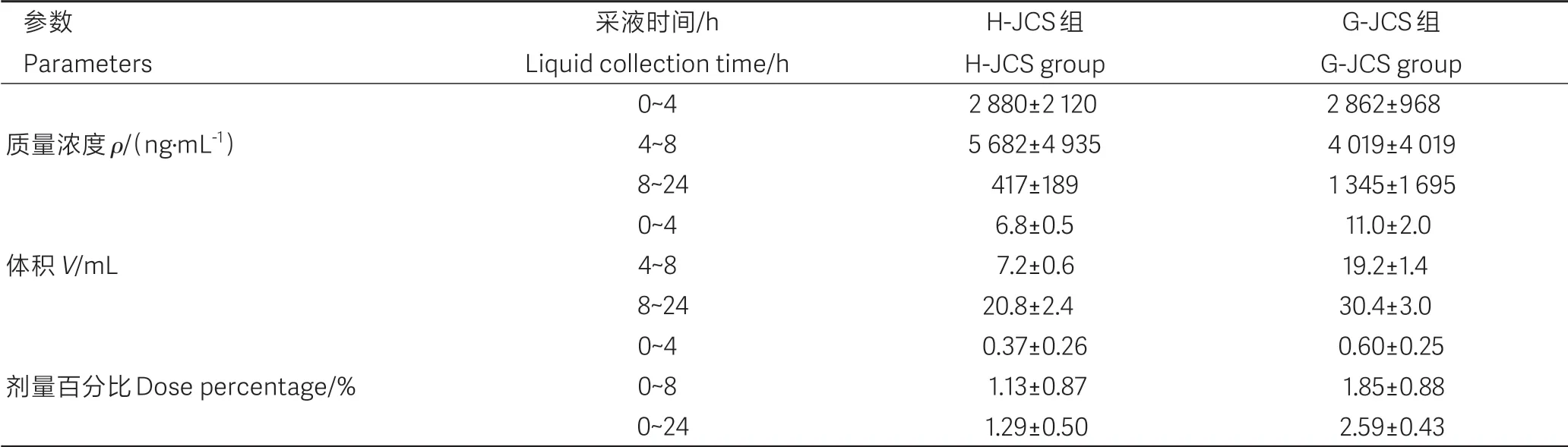
表4 各组大鼠的淋巴液剂量百分比参数Table 4 Dose percentage parameters of lymphatic fluid of rats in each group( ±s,n=3)
注:H-JCS组指混悬液制剂-颈静脉和肠淋巴管双插管组;
G-JCS组指橄榄油制剂-颈静脉和肠淋巴管双插管组。Note:H-JCS,suspension preparation-jugular vein and intestinal lymphatic double cannulation group;
G-JCS,olive oil preparation-jugular vein and intestinal lymphatic double cannulation group.
参数Parameters质量浓度ρ/(ng·mL-1)体积V/mL剂量百分比Dose percentage/%采液时间/h Liquid collection time/h 0~4 4~8 8~24 0~4 4~8 8~24 0~4 0~8 0~24 H-JCS组H-JCS group 2 880±2 120 5 682±4 935 417±189 6.8±0.5 7.2±0.6 20.8±2.4 0.37±0.26 1.13±0.87 1.29±0.50 G-JCS组G-JCS group 2 862±968 4 019±4 019 1 345±1 695 11.0±2.0 19.2±1.4 30.4±3.0 0.60±0.25 1.85±0.88 2.59±0.43

图3 各组大鼠的药物浓度-时间曲线(A)和淋巴液剂量百分比曲线(B)Figure 3 Drug concentration-time curve(A)and dose percentage curve of lymphatic fluid(B)in all groups of rats
与传统门静脉系统吸收途径相比,脂溶性药物经肠系膜淋巴转运具有明显的优势,不仅吸收比例高,还可以避开肝脏的首过消除效应[7,14]。某些脂类大分子物质因溶解度和溶出速率低,只能依赖肠系膜淋巴管的转运吸收[15-16]。大鼠肠系膜淋巴管插管模型是研究药物经淋巴系统转运最广泛的技术手段,但传统的肠系膜淋巴液直接引流的方式存在明显的缺陷:在淋巴液采集过程中,动物长时间处于禁食禁水、麻醉或被限制的状态,这些因素会导致其肠淋巴液流速和淋巴转运能力下降,不能模拟生理状态下的淋巴转运过程[17]。本研究利用一种新型的大鼠肠系膜淋巴管-颈静脉辅助回流模型,结合清醒活动装置,实现了大鼠在清醒自由、正常采食饮水的状态下实时收集淋巴液并用于分析,实验数据真实地反映了普罗布考经大鼠肠系膜淋巴系统转运的药代动力学特征。
普罗布考作为脂溶性药物,在胃肠道中难溶且吸收不规则,导致其口服生物利用度较低(<10%)[18],限制了该药的药效发挥和临床应用。因此,对该药进行剂型改造、吸收模式及药代动力学的深入研究受到了研究者的普遍关注。近年来,自微乳、微囊、聚合物胶束和纳米粒等新型制剂技术的应用可以改善普罗布考在体内的组织分布和生物利用度[19],并提高其在体内的持效时间[20]。然而这类制剂往往成本高昂,部分因含有大量的表面活性剂,不能长期给药,限制了相关技术的应用[19]。Schönfeld等[21]研究发现,脂质制剂可以提高脂溶性药物经肠系膜淋巴系统的转运能力。被脂质包装后的药物在口服后,一部分药物经传统肝门静脉途径进入全身血液循环,另一部分药物经小肠黏膜上皮细胞吸收后,与不饱和脂肪酸、三酰甘油等共同组装成为乳糜微粒,并经小肠毛细淋巴管-肠淋巴管-胸导管途径入血[22]。橄榄油中富含大量的长链脂肪酸和单不饱和脂肪酸[23],理论上可以促进普罗布考溶解并进入小肠黏膜上皮细胞与乳糜微粒结合[11],进而提高其口服吸收水平。本研究工作证实了上述过程,同时也发现橄榄油对普罗布考的药代动力学参数有较大的影响。
本研究表明,各组普罗布考的药-时曲线均符合非房室模型,其在大鼠体内分布较快,消除较为缓慢,且消除半衰期大于分布半衰期,说明普罗布考在体内的药代动力学过程为慢消除过程。与普罗布考混悬液制剂组相比,普罗布考橄榄油制剂组全血的Cmax、Tmax、AUClast、生物利用度和淋巴液剂量百分比显著升高(P<0.05),表明普罗布考的混悬液制剂和橄榄油制剂不具有生物等效性,经橄榄油溶解的普罗布考在大鼠体内的生物利用度和肠淋巴系统代谢能力得到提升,体内持效时间进一步增加。在橄榄油制剂状态下,颈静脉单插管大鼠全血的AUClast显著高于颈静脉-肠淋巴管双插管大鼠(P<0.05),而混悬液制剂组间无显著差异(P>0.05),这可能是由于大鼠的肠系膜淋巴液被收集后,经肠淋巴系统途径运输的部分药物未进入体内血液循环,这说明普罗布考溶于橄榄油制剂后被特异性地吸收到肠淋巴液中。总之,普罗布考橄榄油制剂在大鼠体内的肠淋巴转运比例及生物利用度都得到显著提升。
综上所述,本研究采用新型的大鼠肠系膜淋巴管-颈静脉辅助回流模型开展了普罗布考的药代动力学研究,发现橄榄油制剂可以显著促进普罗布考经肠系膜淋巴系统的转运吸收,提高了普罗布考在大鼠体内的生物利用度。本研究为脂溶性药物的肠淋巴转运研究、普罗布考的剂型改造及其药代药效研究提供了新的技术手段及可靠数据。
[医学伦理声明Medical Ethics Statement]
本研究涉及的所有动物实验通过中国科学院分子细胞科学卓越创新中心实验动物使用与管理委员会的审核批准(IACUC No.SIBCB-S118340-2112-045)。所有实验操作均遵照中国科学院分子细胞科学卓越创新中心动物实验技术平台发布的《动物实验技术平台标准操作规程》的条例进行。
All animal experiments involved in this study have been reviewed and approved by the Laboratory Animal Use and Management Committee of the Center for Excellence in Molecular Cell Science, Chinese Academy of Sciences(IACUC No. SIBCB-S118340-2112-045). All experimental procedures were carried out in accordance with the regulations ofStandard Operating Procedures for Animal Experiment Technology Platformsestablished by the Animal Core Facility, Shanghai Institute of Biochemistry and Cell Biology, Center for Excellence in Molecular Cell Science,Chinese Academy of Sciences.
[作者贡献Author Contribution]
张笑瑞、曹静和吴倩倩负责收集资料、实验设计、实验操作、数据及论文撰写;
刘季俊和陈国元负责开展普罗布考药物分析并参与论文撰写;
吴宝金提供研究经费,负责研究方案与论文的审核及修改。
[利益声明Declaration of Interest]
所有作者均声明本文不存在利益冲突。
猜你喜欢 淋巴液颈静脉罗布 内淋巴囊分流术治疗颈静脉球憩室致类梅尼埃病样症状1例中华耳科学杂志(2022年6期)2022-12-29横窦狭窄合并颈静脉球高位对乙状窦血管血流动力学影响的数值模拟北京生物医学工程(2022年3期)2022-06-29罗罗布的狂想曲作文大王·笑话大王(2020年4期)2020-04-19大鼠肠淋巴液引流方法的改进遵义医科大学学报(2019年5期)2019-11-29促进淋巴液流通爱你(2018年29期)2018-11-14促进淋巴液流通爱你·健康读本(2018年10期)2018-05-14颅内压监测和颈静脉血气分析在重型颅脑损伤中的应用进展右江医学(2018年6期)2018-03-04罗罗布作文大王·笑话大王(2017年9期)2017-09-18罗罗布作文大王·笑话大王(2016年7期)2016-08-08罗罗布作文大王·笑话大王(2016年2期)2016-02-24







