胃癌组织中EPAS1的表达及临床意义
时间:2023-06-03 19:35:19 来源:雅意学习网 本文已影响 人 
贾 茹,王 理
胃癌是常见的消化系统肿瘤。2018年全球癌症数据统计显示,胃癌的发病率居恶性肿瘤第5位,病死率居第3位[1]。缺氧是典型的实体瘤微环境,与肿瘤的发生、发展密切相关[2]。含有内皮PAS结构域的蛋白1(endothelial PAS domain protein 1, EPAS1),又称为缺氧诱导因子2-α(hypoxia-inducible factor-2α, HIF-2α),HIF的α亚基,可介导细胞和全身对缺氧的反应[3]。EPAS1在许多缺氧反应基因的转录中具有重要作用,研究显示EPAS1与肿瘤的发生、发展密切相关[4]。因此,本文采用免疫组化法检测胃癌组织中EPAS1的表达,探讨其与胃癌临床病理特征的关系及意义。
1.1 材料从癌症基因组图谱数据库(https://portal.gdc.cancer.gov/)获取375例胃癌患者的临床数据,其中男性241例,女性134例;
年龄58~74岁,平均(69.54±5.42)岁;
肿瘤TNM分期:Ⅰ期76例,Ⅱ期111例,Ⅲ期150例,Ⅳ期38例。
选取2019年1月~2020年1月浙江大学医学院附属第二医院收治的95例经术后病理证实的胃癌标本。所有患者通过电话或门诊随访,截至日期2022年1月30日。其中男性67例,女性28例;
年龄28~94岁,平均(62.62±10.23)岁。同时收集上述病例的癌旁组织和50例内镜下腺瘤组织作为对照组。纳入标准:(1)结合术后病理明确诊断为原发性胃癌。(2)行ESD手术或D2胃癌根治术。(3)术后生存时间≥3个月。排除标准:(1)合并其他类型恶性肿瘤。(2)既往罹患肿瘤或自身免疫系统疾病。(3)术前接受新辅助化疗。本实验经我院伦理委员会审核,患者均知情同意。
1.2 主要试剂与仪器10%中性福尔马林、苏木精购自宁波同盛公司,DAB购自北京中杉金桥公司,anti-EPAS1抗体购自赛默飞世尔公司,生物组织包埋机及荧光倒置生物显微镜购自徕卡公司。
1.3 方法
1.3.1生物信息学数据分析 (1)下载后的表达谱数据,使用经Toil流程统一处理的FPKM格式的RNAseq数据log2转化后获得。(2)临床相关性及预后分析:将数据库中HTSeq-FPKM格式的RNAseq数据转换成TPM格式,并进行log2转化后获得。(3)从数据库中获取肿瘤分期、转移及生存情况等临床信息,使用R语言(http://www.r-project.org/)进行操作。
1.3.2临床数据收集 收集患者年龄、性别、体重指数(body mass index, BMI)、基础疾病、HP感染、肿瘤位置、浸润深度、脉管侵犯、N分期、M分期、TNM分期、组织学类型、分化程度、手术方式、住院时间、总生存期(overall survival, OS)、无进展生存期(progression free survival, PFS)。其中TNM分期依据AJCC分期手册(第8版)标准进行[5],OS是指患者从术后开始至死亡或失访时间。
1.3.3免疫组化 免疫组化染色使用SP法。将5 μm厚石蜡切片经二甲苯Ⅰ、Ⅱ脱蜡各10 min,置于100%、95%、90%、80%、70%乙醇中各5 min进行脱水,在煮沸的蒸馏水中加热15 min。室温下用含10%血清的封闭溶液封闭1 h,加入EPAS1抗体,4 ℃ 孵育过夜。滴加二抗室温孵育30 min,DAB显色,苏木精复染后脱水封固,显微镜下观察。
标本由2名病理医师对染色强度和染色范围进行半定量评分,根据细胞染色强度进行评分:无着色为0分、弱着色为1分、中度着色为2分、强着色为3分;
根据细胞核阳性染色百分比进行评分:阳性细胞数<5%为0分、5%~25%为1分、26%~50%为2分、51%~75%为3分、>76%为4分。两项评分相乘作为最终评分:0~6分为低表达组;
>6分为高表达组[6]。
1.3.4细胞培养 人胃癌细胞AGS、HGC-27、MGC-803、SGC-7901和人正常胃黏膜GES-1细胞系均由消化肿瘤中心赠送,并储存在我院临床实验室。实验均使用含10%胎牛血清的RPMI-1640培养基,在37 ℃、5%CO2环境中培养。
1.3.5qRT-PCR法 按照qRT-PCR试剂盒操作说明书配置PCR反应体系。使用HiScript III RT SuperMix将1 μg总RNA逆转录为互补DNA(cDNA),所有引物均由北京擎科生物公司设计和合成。通过定量实时RCR扩增目标cDNA,使用ChamQ Universal SYBR qPCR Master Mix进行实时PCR。循环条件:95 ℃ 30 s,95 ℃ 10 s,60 ℃ 30 s,合计40个循环;
95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。用actin作为内参。使用2-ΔΔCt方法计算目的基因的相对mRNA表达。EPAS1引物序列:上游5′-CGGAGGTGTTCTA TGAGCTGG-3′;
下游5′-AGCTTGTGTGTTCGCAGG AA-3′;
actin引物序列:上游5′-CATGTACGTTGCT ATCCAGGC-3′;
下游5′-CTCCTTAATGTCACGCAC GAT-3′
1.3.6Western blot法 将组织加入含1%蛋白酶抑制剂的细胞裂解缓冲液,冰上裂解30 min,在4 ℃ 下12 000g离心10 min,取上清液转移至新1.5 mL EP管中;
将20 μg的待测蛋白和10 μL蛋白marker加入上样孔,在配置好的10%SDS PAGE凝胶中进行电泳分离,随后在200 mA、1 h条件下,冰盒内将蛋白样品电转移到PVDF膜上,Western blot封闭液室温下摇床封闭1 h,4 ℃下anti-EPAS1抗体孵育过夜,IgG二抗在室温下摇床上孵育1 h,使用敏感的ECL试剂盒测量免疫反应条带。

2.1 胃癌中EPAS1的表达及与预后的关系通过TCGA数据库分析显示:胃癌组织中EPAS1 mRNA表达显著高于正常胃黏膜组织(P<0.05,图1A),EPAS1 mRNA低表达组患者的OS和PFS均高于EPAS1高表达组,表明患者预后较好,差异有统计学意义(P<0.05,图1B、C)。

图1 胃癌中EPAS1的表达以及预后分析:A.TCGA数据库分析胃癌组织中EPAS1 mRNA的表达,*P<0.05;
B.TCGA数据库分析EPAS1表达与患者总生存期的关系;
C.TCGA数据库分析EPAS1表达与患者无进展生存期的关系
2.2 胃癌和癌旁组织中EPAS1的表达免疫组化及免疫荧光结果显示:EPAS1主要定位于细胞质和细胞核中,胃癌组织中EPAS1的免疫组化表达得分显著高于癌旁、腺瘤组织,差异均有统计学意义(t=6.213、10.691,P<0.05)。癌旁组织中EPAS1的免疫组化表达得分亦显著高于腺瘤组织,差异有统计学意义(t=7.187,P<0.05,表1,图2)。通过qRT-PCR和Western blot实验检测胃癌细胞中EPAS1 mRNA和蛋白表达也证明,胃癌细胞系中EPAS1 mRNA和蛋白的表达水平均显著高于正常胃黏膜细胞GSE-1(图3)。

图2 胃癌、癌旁和腺瘤组织中EPAS1的表达:A.腺瘤组织中EPAS1不表达;
B.癌旁组织中EPAS1不表达;
C.胃癌组织中EPAS1高表达;
D.胃癌组织中EPAS1低表达,SP法
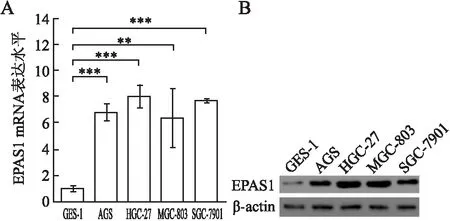
图3 转录(A)和翻译(B)水平验证EPAS1在不同胃癌细胞系中的表达水平:**P<0.01;
***P<0.001

表1 胃癌、癌旁、腺瘤组织中EPAS1的表达
与癌旁组织、腺瘤组织相比,*P<0.001
2.3 胃癌组织中EPAS1表达与临床病理特征及预后的关系胃癌中EPAS1高表达58例,低表达37例,分析EPAS1表达与临床病理特征的关系显示:EPAS1表达与患者年龄、性别、BMI、基础疾病、肿瘤位置、脉管侵犯、淋巴结转移、远处转移、TNM分期、组织学类型、手术方式无关(P均>0.05,表2)。浸润深度T3、T4以及低分化组EPAS1的表达水平显著增高(t=3.138、2.275,P<0.05,图4)。高表达组侵犯浆膜及浆膜下结缔组织的比例显著高于低表达组(χ2=9.63,P=0.022),且低分化的比例显著高于低表达组(χ2=4.25,P=0.039),且EPAS1高表达组的OS均显著低于EPAS1低表达组(t=7.149,P<0.001,图5)。Cox单因素及多因素分析结果显示:EPAS1表达(HR:2.095,95%CI:1.019~4.307,P<0.001)是OS的独立预测因子(表3)。
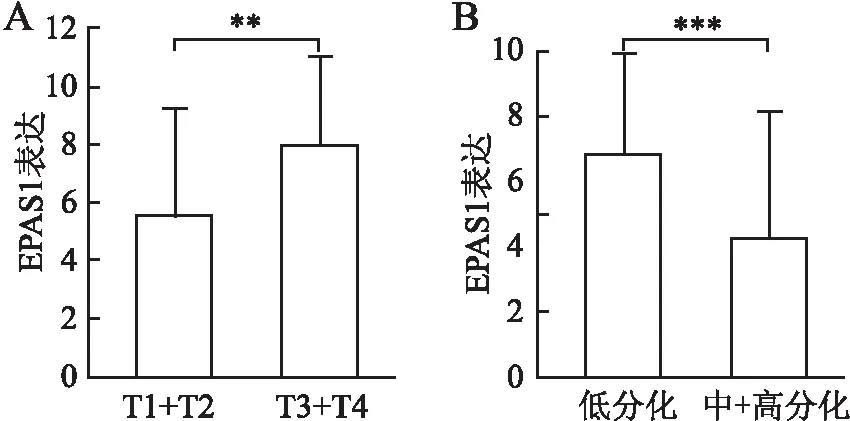
图4 EPAS1表达与胃癌临床病理特征的相关性:A.不同T分期胃癌中EPAS1的表达,**P<0.01;
B.不同分化程度胃癌中EPAS1的表达,***P<0.001

图5 EPAS1不同表达组胃癌患者的预后分析

表2 EPAS1表达与胃癌临床病理特征的关系[n(%)]

表3 Cox单因素及多因素回归分析
转录复合物HIF作为氧稳态的主要调节器,不同靶点的HIF-α异构体可以通过多个基因的转录激活,调节肿瘤对缺氧的反应[7]。其中EPAS1在细胞对长时间低氧的反应中起关键作用,不仅可以参与铁代谢,还通过对糖酵解酶和葡萄糖转运蛋白的调节降低耗氧量[8]。尽管最近研究发现EPAS1在消化道肿瘤的发展过程中发挥作用[9],但在胃癌中的研究较少。因此,本实验拟通过TCGA数据库和临床标本分析EPAS1表达以及与预后和临床病理特征的相关性。
本实验结合TCGA数据库和临床样本的免疫组化分析发现,与腺瘤组织相比,胃癌组织中EPAS1显著高表达,并且表达多位于细胞核与细胞质中。与HIF-1α在所有细胞中普遍表达不同,EPAS1具有一定的组织特异性,仅在特定组织类型中表达,如内皮细胞或肿瘤细胞中[10-11]。当发生缺氧时,EPAS1的α亚基稳定并转移到细胞核,与HIF-1β形成异源二聚体,并结合靶基因调控元件内的缺氧反应元件识别缺氧反应。因此,既往研究也证实EPAS1在缺氧诱导时主要位于细胞核或细胞质中[12]。
为进一步探索EPAS1与胃癌患者预后的相关性,本组分析TCGA数据库结果显示:EPAS1表达上调与胃癌患者预后不良相关,临床数据也进一步证实EPAS1高表达胃癌患者的总生存率显著低于EPAS1低表达组,这些结果均表明EPAS1可能是胃癌患者的预后标志物。多项研究报道肿瘤组织中EPAS1的mRNA和蛋白质水平均高表达,并且与不同肿瘤类型的发生、进展和预后相关[13-14]。在肿瘤微环境中,由于不规则毛细血管的形成,血流缓慢,但由于肿瘤细胞的快速增殖,肿瘤细胞需氧量增加导致肿瘤内部缺氧,通过激活基因表达程序,诱发EPAS1启动细胞对缺氧环境的适应性反应[15]。此外,EPAS1可能会招募SP1转录因子和其他辅因子形成“EPAS1增强分子”,诱导转录发生[16]。EPAS1表达与胃癌临床病理特征相关性分析显示:EPAS1高表达与原发灶深度浸润和低分化程度显著相关。
综上,EPAS1可能是胃癌患者的预后标志物,并且与原发灶浸润和分化程度显著相关。同时本研究存在一些局限性:首先,本实验为单中心回顾性研究,样本量相对较少,仍需进一步扩大研究证实该结论。其次,本研究中仅使用了石蜡切片,检测EPAS1 mRNA表达水平的能力有限,仍需收集新鲜组织标本进行验证。
猜你喜欢 腺瘤免疫组化病理 超声检查在甲状腺腺瘤诊断中的应用价值探析中国典型病例大全(2022年9期)2022-04-19SOX6是鉴别上皮样间皮瘤和肺腺癌的一种新型免疫组化标志物临床与实验病理学杂志(2021年7期)2021-12-03病理诊断是精准诊断和治疗的“定海神针”保健医苑(2021年7期)2021-08-133例淋巴瘤样丘疹病临床病理分析现代临床医学(2021年4期)2021-07-31足部小汗腺汗管纤维腺瘤1例并文献复习皮肤病与性病(2021年3期)2021-07-30肿瘤病理:从检查到报告抗癌(2021年2期)2021-07-09免疫组化病理技术及质量控制方式的研究医学食疗与健康(2021年27期)2021-05-13胸腺瘤与自身免疫性疾病的研究进展天津医科大学学报(2021年2期)2021-03-29甲状腺腺瘤的类型有哪些?健康之家(2020年12期)2020-12-28自动免疫组化染色与人工染色对CerbB—2的影响中国民族民间医药·下半月(2016年8期)2016-10-24









