马铃薯抗旱性研究进展
时间:2023-01-18 18:40:07 来源:雅意学习网 本文已影响 人 
刘维刚,唐 勋,付 学,张欢欢,朱存兰,张 宁,司怀军*
(1.甘肃农业大学农学院,甘肃 兰州 730070;
2.省部共建干旱生境作物学国家重点实验室/甘肃农业大学,甘肃 兰州 730070;
3.甘肃农业大学生命科学技术学院,甘肃 兰州 730070)
马铃薯(Solanum tuberosumL.)是重要的非谷类粮食作物,全球种植面积约为1 930万hm2,年总产量近4亿t,仅次于水稻、小麦和玉米[1]。马铃薯作为粮菜兼用作物,营养丰富,食用形式多种多样。除直接食用外,马铃薯也是重要的动物饲料和工业原料。马铃薯属环境敏感型作物,外界环境的变化是马铃薯生长发育、产量及品质的主要限制因素。自然环境下,马铃薯在生长过程中时刻面对多种环境胁迫,包括非生物胁迫(干旱、热害、高盐等)和生物胁迫(病虫害),严重影响其产量与质量[2,3]。由于马铃薯根系短而疏浅导致输水能力有限,因此马铃薯特别容易受到外界环境刺激的影响。温度、干旱和盐胁迫被认为是影响马铃薯生长和产量的主要不可控因素[4],而干旱影响尤为严重。干旱可分为极端性和间歇性两种情况。在极端干旱期间,土壤水的可利用量逐渐减少,造成作物过早死亡,从而导致作物大幅度减产甚至绝产;
间歇性干旱是有限时期灌溉不足的结果,间隔多次发生,不一定是致命的,这种干旱往往造成作物减产。干旱的原因包括降雨不足、土壤盐渍化、生活用水和工业生产用水与农业用水竞争[5]。全球变暖将进一步加剧干旱蒸发量的增加,更为严峻的是专家预测到2100年极端干旱地区的比例将从1%增至30%。而到2069年左右全球范围内因为干旱导致的马铃薯减产达18%~32%[6]。据不完全统计,中国马铃薯的种植面积已经超过500多万hm2,年产量超过1亿万t,位居世界之首[7]。
干旱影响马铃薯的营养生长,从而影响株高、叶片大小、叶片数量以及光合速率,还能直接影响块茎的产量和品质[8]。马铃薯的抗旱性是复杂的数量性状,受微效多基因和多变环境的共同调控[9],是众多因素综合调控的结果。由于马铃薯是同源四倍体作物,研究难度较大,且抗旱性状受多种机制调控,多种因素的影响,研究面临众多瓶颈,很难取得实质性的进展。目前,关于马铃薯抗旱性的研究主要集中在表型的改变、抗旱生理生化指标的变化、光合作用的改变上,而对抗旱相关基因的作用机理和抗旱性机制的研究较少。本文系统总结了近年来马铃薯在干旱胁迫响应的研究进展,为后续马铃薯抗旱基础研究和选育抗旱性新品种提供理论依据。
1.1 干旱对马铃薯植株的影响
干旱引起植物的第一个胁迫症状通常是对芽的快速抑制,在较小程度上是影响根的生长,紧接着是部分或完全的气孔关闭,伴随着光合作用、蒸腾作用和二氧化碳吸收的减少(图1)。如果不能缓解,干旱将导致植物生殖发育中断,叶片过早衰老、枯萎、干燥和死亡[10,11]。因此,干旱对于马铃薯农艺性状的影响是最直接最明显的。马铃薯属浅根系作物,根系的发育对马铃薯的生长发育至关重要。马铃薯不同品种根系大小及其结构存在明显的差异,在干旱胁迫下,根系越发达,抗旱性越强,对其产量的影响越小[12]。干旱胁迫下根长和面积与块茎产量之间的相关性研究发现,根越长越大的马铃薯品种表现出更高的耐旱性[13]。此外,根系拉力对马铃薯根系在土壤中的长度、深浅、密度以及对水分吸收能力等有影响[14],根系拉力越大的品种抗旱性越强。在幼苗期干旱对马铃薯生长的影响最严重,而且随着干旱时间的延长马铃薯茎粗、株高会明显降低甚至会出现萎焉。轻度干旱胁迫能够增加马铃薯株高[15],在干旱胁迫下晚熟品种的株高往往比早熟品种的株高更高[16]。干旱胁迫对于马铃薯的叶面积指数及茎叶结构也有影响。水分胁迫下叶面积减少,导致轻微缺水的植物叶绿素浓度增加,会影响光同化物、干物质的产生以及块茎产量[17]。叶面积指数越大,品种越抗旱,这对于维持马铃薯的产量具有重要的意义[18]。郑植尹和王芳[19]在对‘青薯9号’和‘闽薯1号’的抗旱特性研究时发现,水分胁迫对马铃薯植物学性状(株高、茎粗、叶面积等)的影响较为严重,这与张瑞玖等[20]的研究结果基本一致。干旱条件下,马铃薯冠层在调节蒸散、干物质分配和块茎产量方面具有重要作用[21]。干旱胁迫时马铃薯生长速率和最大冠层盖度对块茎形成和块茎膨大有不利的影响。干旱胁迫下,生长速率、最大冠层盖度对块茎膨大的影响大于对块茎形成的影响[22]。
1.2 干旱对马铃薯块茎的影响
干旱胁迫对马铃薯的最严重影响之一是阻止匍匐茎分化和块茎形成。干旱严重影响块茎品质和产量水平,阻碍植株的营养生长和生殖生长(图1)。产量是马铃薯抗旱强弱的综合体现。干旱引起的块茎产量损失在很大程度上取决于干旱持续时间、严重程度和生长周期。干旱引发马铃薯块茎的缺陷,如块茎破裂、空心、内部褐斑、继发性生长、畸形并显着增加α-茄碱和α-查卡宁糖生物碱的含量,可能导致包括诱发癌症在内的多种健康问题[13]。干旱胁迫能够使块茎单株产量、单株块茎数、单位面积产量、收获指数和结薯率均降低[15,23,24]。在块茎形成时期,干旱对于马铃薯的产量和块茎数产生较为直接的影响,这是由于该时期需要大量的营养物质及水分,干旱影响叶片的蒸腾、植株叶片数和植株的生长。
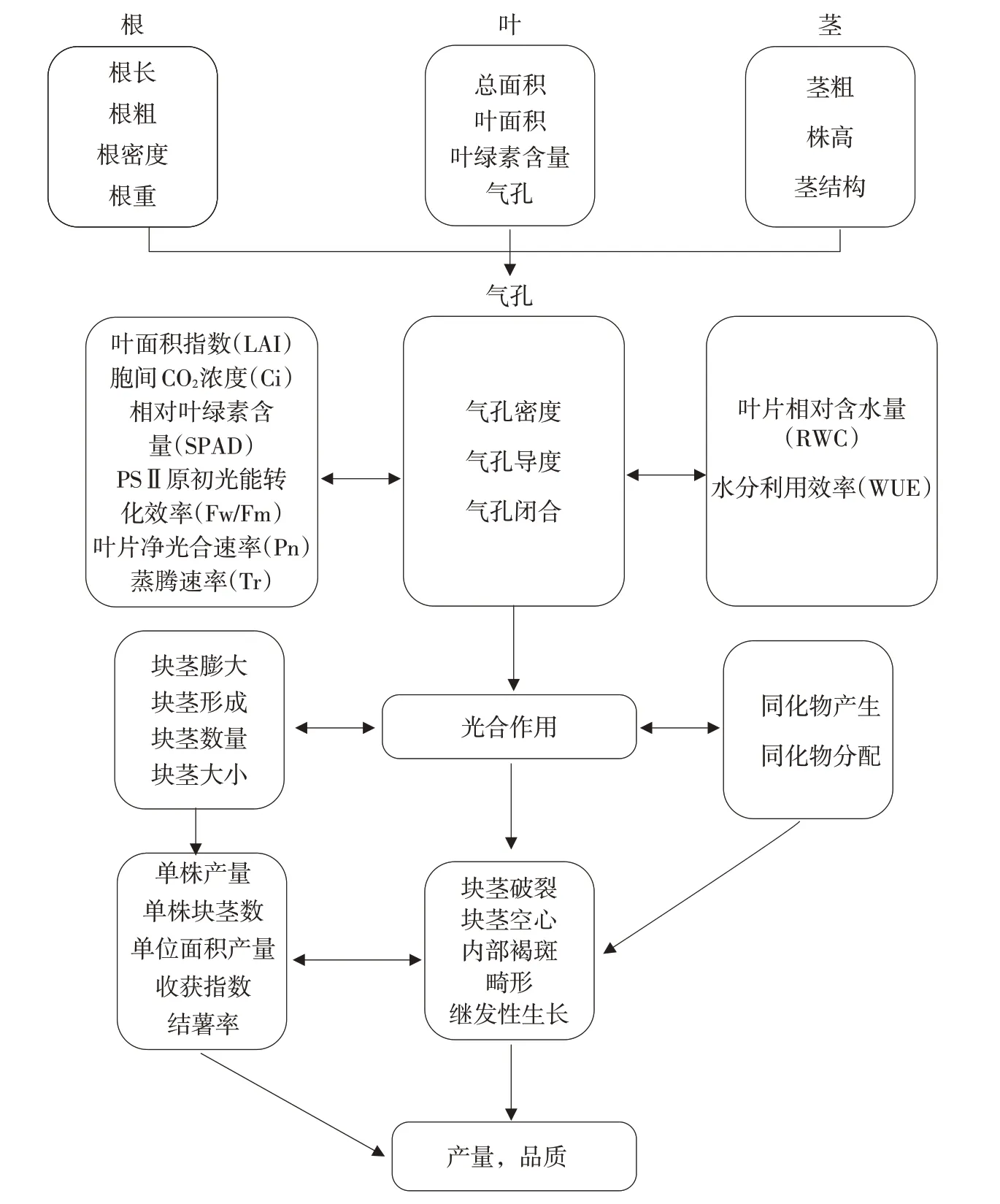
图1 干旱胁迫对马铃薯生长发育及光合作用的影响Figure 1 Effects of drought stress on potato growth and photosynthesis
光合作用对马铃薯的抗旱性具有重要的作用(图1)。相对叶绿素含量(SPAD值)可用于评价作物不同品种的耐旱性,有关马铃薯的光合作用研究表明,干旱胁迫下叶片SPAD值的增加并没有增加净光合速率,而块茎干物质含量因干旱胁迫影响有所降低[25]。研究表明,水分胁迫会影响马铃薯的光合作用特性,且叶片净光合速率(Net photosynthetic rate,Pn)、蒸腾速率(Transpiration,Tr)、气孔导度(Stomatal conductance,Gs)、SPAD值、叶面积和产量都是对照>中度处理>严重处理[23]。后来研究表明,水分胁迫通过SPAD值、Gs、胞间CO2浓度(Intercellular CO2concentration,Ci)的变化来间接影响叶片Pn和Tr,从而影响马铃薯的光合作用机制,甚至影响马铃薯的产量[26]。分根交替干旱能够增强马铃薯叶片的光合作用机制,如增加叶片的光合能力、光合最大势能和光量子利用效率[27,28],同时提高了过氧化物酶(Peroxidase,POD)、过氧化氢酶(Catalase,CAT)和超氧化物歧化酶(Superoxide dismutase,SOD)的活性以增强对植物的保护[29]。类胡萝卜素既是光合色素又是一种重要内源抗氧化剂,对光合结构也具有一定保护作用[30],因此类胡萝卜素对于光合作用具有重要的意义。干旱胁迫下马铃薯叶片叶绿素和类胡萝卜素含量显著降低,而增施氯化钾显著减轻干旱胁迫下二者降低的幅度,这说明喷施氯化钾能够增加马铃薯体内二者含量。同样地,干旱胁迫下幼苗叶片Pn、Tr、Gs均有显著降低,而喷施氯化钾能够提高干旱胁迫下叶片中的Pn、Tr、Gs,同时提高水分利用效率(Water use efficiency,WUE),这表明干旱胁迫下,氯化钾通过提高作物的光合作用能力及水分利用效率从而增强马铃薯的抗旱性[31]。植物中光合作用和碳分配高度相关。光合作用产生的同化物通过碳分配反馈光合作用的速率。干旱通过光合作用、木质部和韧皮部运输及诱导糖合成来干扰碳分配和碳积累。干旱胁迫影响马铃薯的气孔导度和叶绿素含量,从而影响碳分配和最终的块茎产量[32]。非生物胁迫导致敏感品种的光合碳同化减少更大,这与较低的叶片Tr和PSⅡ有关[33]。繁殖期缺水会减少马铃薯的碳积累,减少从营养组织到块茎的碳再活化,并减少块茎数量和块茎大小[34]。
干旱主要影响植物的渗透调节、质膜的过氧化反应以及抗氧化保护酶等方面。渗透调节是细胞为了保证能在低水势情况下吸收水分并通过降低结合水的自由能从而降低细胞内水势的机制。干旱甚至造成生物膜损伤从而使膜系统损坏和瓦解、透性增加、色素丧失、离子外漏等,生物膜损伤严重时可威胁到植株的生命。虽然马铃薯的水分利用效率高于谷类作物(小麦,水稻,玉米)[21],但由于其根系疏浅,且在水分胁迫后难以恢复,从而导致马铃薯块茎品质下降和产量减少。干旱胁迫会引起植物内环境的变化,原有的代谢平衡被打破,导致有害物质如活性氧(Reactive oxygen species,ROS)、丙二醛(Malondialdehyde,MDA)的大量积累,细胞膜结构被破坏,引起体内代谢紊乱。为了维持体内的环境平衡,植物会启动自身防御和清除系统来应对干旱胁迫(图2)。其中,脯氨酸(Proline,Pro)、MDA、SOD、POD、CAT是马铃薯中研究最多的生理生化指标。
3.1 干旱胁迫影响MDA和Pro含量
MDA和Pro含量的变化是反映植物抗旱性的重要标志。植物在遭受干旱胁迫时,体内MDA含量的增加降低了自身细胞的渗透势,而Pro含量的增加有助于调节体内渗透势而维持水分平衡(图2)。Pro除了参与蛋白质和细胞膜的稳定外,还充当中间氮储存器,并在细胞再水化过程中充当碳和能量的来源。一般情况下,在干旱胁迫时马铃薯体内的MDA增加降低了自身细胞的渗透势,而Pro在叶片内含量的增加,能够调节体内渗透势以维持水分平衡,从而起到保护作用[26,35]。Pro含量在不同品种间的变化也存在差异,在干旱敏感品种中比在耐旱品种中增加得更早。有研究表明,Pro积累与块茎重量呈负相关,这表明Pro可能是一种胁迫指标,而不是一种胁迫的保护剂[36]。
3.2 干旱胁迫影响抗氧化性酶的活性
POD、SOD、CAT能够控制、减少或清除细胞内活性氧的水平和过氧化产物,减轻对细胞的危害,维持体内的相对平衡和健康(图2)。POD活性在马铃薯幼苗时期变化不大,但随着干旱胁迫时间延长,其活性在第6 d达到最大值,这表明植物体内通过分泌POD酶来响应干旱胁迫[37]。CAT是分解过氧化氢的关键酶,在干旱胁迫下植物体内的CAT活性增加以清除H2O2从而减少对植株的损害[38]。有研究表明,马铃薯中CAT活性随着干旱胁迫程度的增加而增加[39],由于半干旱地区马铃薯的适应性,其在不同程度的干旱胁迫下CAT活性变化不大。总之,在干旱前期SOD、POD、CAT活性随着干旱胁迫强度的增加而增大,这是马铃薯应激保护反应,但随着干旱程度的进一步增强,马铃薯体内水分严重失衡,超出其自身调节的范围,则SOD、POD、CAT受到破坏导致其活性降低。此外,王天等[40]研究表明,可通过施用适量的磷肥增强抗氧化酶活性和根系活力从而提高马铃薯植株的抗旱性。

图2 干旱胁迫对马铃薯生理生化指标的影响Figure 2 Effects of drought stress on biochemical and physiological indexes of potato
马铃薯已经进化出了各种分子机制,通过生理和生化反应到基因表达和代谢途径的变化来应对抗干旱胁迫(图3)。

图3 马铃薯响应干旱胁迫的分子机制Figure 3 Molecular mechanism of potato response to drought stress
4.1 脱落酸信号通路参与调控马铃薯对干旱胁迫的响应
脱落酸(Abscisic acid,ABA)是一种普遍存在于植物中的信号分子,用于关闭气孔并诱导多种与胁迫相关基因的表达。ABA参与植物的生长发育、种子休眠、果实发育[41,42],也参与对非生物胁迫的响应,如干旱。在干旱胁迫下,马铃薯中ABA通过调控气孔的闭合来影响地上地下干物质的分配,从而调控马铃薯的产量[43,44]。适度干旱能够增加根、匍匐茎与叶片中ABA含量,外源高浓度(5和10 μmol/L)ABA能促进马铃薯结薯数和薯重的增加[45]。因此,研究马铃薯中ABA在干旱胁迫下的调控机理具有重要的意义。干旱胁迫能够刺激植物ABA的合成。ABA能够诱导应激相关基因的表达,并且与干旱相关基因的表达是通过ABA依赖性和ABA非依赖性机制来控制的[46]。Schafleitner等[47]认为马铃薯植株对干旱胁迫的耐受能力是受DREB1A(脱水反应元件结合蛋白)的上调表达调控的,该序列是控制ABA依赖性基因表达的主要顺式作用元件。后来,Watanabe等[48]将AtDREB1a转基因马铃薯与非转基因马铃薯进行了比较,发现DREB1a转基因品系的耐旱性明显增强。研究表明,ABF是ABA信号传导的关键调节因子,属bZIP转录因子,他们与ABA反应元件(ABRE)结合,调控非生物胁迫期间ABA信号传导,也在调控马铃薯块茎的形成过程中发挥重要作用[49]。过表达AtABF4基因的马铃薯植株能够增强耐盐性和耐旱性,并增加块茎产量[50]。StABF1基因在ABA、干旱、盐胁迫和冷胁迫下被诱导,这表明StABF1基因可能是马铃薯中依赖ABA信号通路而响应胁迫的关键调节因子[51]。9-顺式-环氧类胡萝卜素双加氧酶(9-cis epoxycarotenoid dioxygenase,NCED)是植物中ABA生物合成途径的关键限速酶,该基因的表达模式直接影响ABA代谢。PEG-6000模拟干旱胁迫处理4个品种,干旱敏感型品种中的ABA含量明显高于其他3个品种,ABA含量与StNCED1表达量之间呈现出正相关关系(R>0.7)[52]。水分胁迫下,吲哚乙酸(Indoleaceticacid,IAA)含量降低,ABA含量升高,IAA/ABA比值降低,影响根系正常发育、水分和养分的吸收及出苗[53]。辣椒(Capsicum annuum)的CaBZ1基因编码bZIP转录因子,该基因的表达受到盐、渗透胁迫和ABA诱导。过表达CaBZ1基因的马铃薯植株增加了ABA含量,且与胁迫相关基因(如CYP707A1、CBF和NAC类基因)的表达量上升,增强对干旱胁迫的耐受性[54]。StCDF1可通过ABA依赖性方式调节气孔开放从而影响马铃薯植株的抗旱性[55]。对‘鄂马铃薯3号’的转录组测序表明,在干旱胁迫下,ABA信号转导核心因子蛋白激酶StSnRK2.4和StSnRK2.8与转录因子StAREB2的基因呈现差异性表达[56]。后来对SnRK2基因家族的鉴定和表达分析也表明,SnRK2的表达与干旱胁迫紧密相关[57]。
4.2 其他信号通路参与调控马铃薯对干旱胁迫的响应
研究表明,MAPK信号通路深度参与调控植物对干旱胁迫的响应。同样地,MAPK信号对马铃薯干旱胁迫的响应具有重要的调控作用。马铃薯在聚乙二醇(Polyethylene glycol,PEG)、甘露醇处理下其光合作用和气孔导度受StMAPK3调控,这就表明StMAPK3是干旱/渗透胁迫的调节因子[58]。对15个马铃薯MAPKs的表达量分析表明,StMAPK11在干旱条件下明显上调。后续研究表明,StMAPK11通过抗氧化活性和光合作用增强马铃薯植物的抗旱性[59]。此外,stu-miR856的表达降低可能会驱动2个StMAPK基因家族成员的过表达,这可能有助于调节马铃薯植株适应干旱胁迫[60]。对耐旱和干旱敏感品种的RNA-seq分析,共筛选到22个马铃薯干旱响应基因,其中包含丝裂原活化蛋白激酶激酶激酶15(MAPKKK15),MAPKKK15已被证明在干旱条件下在转录水平上被激活[61]。
4.3 泛素蛋白酶体途径参与调控马铃薯对干旱胁迫的响应
泛素蛋白酶体系统(Ubiquitin-proteasome system,UPS)作为蛋白质的翻译后修饰机制,深度参与调控马铃薯对干旱胁迫的响应。在对PEG处理下的马铃薯蛋白质组泛素化分析表明,共检测到200个Lys的泛素化修饰,通过比较发现共有25个是泛素的差异化修饰位点[62]。后来研究表明,U-box型泛素连接酶StPUB27通过调控气孔导度负调节马铃薯的抗旱性[63]。RING-finger型E3连接酶StRFP2通过影响Pro、MDA含量和CAT活性提高马铃薯植株的保水能力,从而正调控马铃薯的抗旱性[64]。对泛素结合酶E2的基因家族鉴定和表达分析表明,多个E2基因与马铃薯抗逆胁迫有关[65]。干旱胁迫可诱导StUBC12基因呈现差异性表达[66]。
4.4 转录因子参与调控马铃薯对干旱胁迫的响应
目前,已鉴定出植物中许多响应非生物胁迫的转录因子(Transcription factors,TFs),包括MYB、bZIP、WRKY、AP2/EREBPs和bHLHs。众多转录因子参与调控马铃薯对干旱胁迫的响应。研究表明,NF-Y转录因子与植物的抗旱性有关。StNFYA7过表达增强植株耐旱性,与减少叶片水分流失有关[67]。StNF-YC9通过增强光合作用速率、抗氧化酶活性和Pro积累以及降低马铃薯植株中MDA的积累,在马铃薯耐旱性中发挥重要作用[68]。StNFYB3.1的过表达导致马铃薯对ABA反应增强气孔关闭,推测StNFYB3.1通过调控ABA介导的气孔关闭从而提高马铃薯植株水分利用效率和耐旱性[69]。在马铃薯中共鉴定出233个MYB基因,多个受干旱胁迫诱导表达。如StMYB030(AtMYB44同源基因)在干旱胁迫处理下显著上调[70]。R1型MYB样转录因子(StMYB1R-1)在马铃薯中表达通过调节水分流失增强植株的耐旱性,表明StMYB1R-1作为转录因子参与干旱相关基因的激活[71]。R2R3-MYB型转录因子StMYB12A/C和miR858参与马铃薯苯丙素途径黄酮醇的代谢,这表明StMYB12A/C和miR858可能是马铃薯响应干旱胁迫的调节因子[72]。在马铃薯品种‘Desiree’中沉默CBP80基因,可增强ABA过敏性气孔关闭,增加叶气孔和毛状体密度。同时,miR159的水平降低,其靶基因MYB33和MYB101表达量升高。这表明CBP80可通过依赖ABA介导的气孔闭合来响应干旱胁迫,这可能是通过调节miR159、MYB33和MYB101的表达水平来实现的[73]。后来证实,MYB33、MYB65和MYB101转录因子通过调节ABA信号通路影响拟南芥和马铃薯对干旱的反应。因此,缺乏CBP80/ABH1会影响miR159的生物合成,导致MYB转录因子增加从而改善马铃薯对干旱的反应[74]。在马铃薯中异源过表达拟南芥的bZIP转录因子可增加块茎产量、改善块茎质量并增强植株的耐盐和耐旱性[50]。韩悌倩[75]对具有抗旱性有差异的2个马铃薯品种转录组测序分析,共筛选到6个Aux/IAA转录因子,qRTPCR验证表明在干旱胁迫下,其表达量在根中呈现差异性表达。这表明,Aux/IAA转录因子可能通过调控根部的发育响应干旱胁迫。
4.5 miRNA参与调控马铃薯对干旱胁迫的响应
MicroRNAs(miRNAs)是一类非编码内源性小RNA(长20~24个核苷酸),在转录后水平负调节真核生物的基因表达,参与调控植物的生长发育,生物和非生物胁迫。对干旱处理下马铃薯的sRNA高通量测序表明,共有1 338个miRNA有差异表达,miRNA的靶基因涉及转录因子(HD-Zip、SPL和SPL)、抗旱相关的功能蛋白等,这表明miRNA在马铃薯响应干旱胁迫过程中扮演重要的角色[76]。研究表明,miR171(stu-miRNA171a/b/c)、miR159、miR164、miR166、miR390、miR395、miR397、miR398、miR408和miR482、miR811、miR814、miR835、miR4398等miRNAs家 族 响 应 干 旱 胁迫[73,77-79]。干旱胁迫下,miR159通过调控其靶基因R2R3MYB(StGAMyb-like1、StGAMyb-like2.1和StGAMyb-like2.2)响应干旱胁迫[80]。通过生物信息学和qRT-PCR分析表明,miR172、miR396a、miR396c和miR4233可能调节P5CS基因,而miR2673和miR6461可能分别调节P5CR和ProDH基因以响应干旱胁迫[81]。Stu-mi164通过调控其靶基因StNAC262的丰度降低马铃薯对渗透胁迫的抗性[82]。
4.6 其他调控因子参与马铃薯对干旱胁迫的响应
此外,其他的许多酶/基因也参与了马铃薯响应干旱胁迫。用拟南芥诱导型启动子rd29A驱动甜菜碱醛脱氢酶(Betaine aldehyde dehydrogenase,BADH)基因并转化马铃薯,结果发现在干旱胁迫下转化植株相比非转化植株(NT)鲜重增加了17%~29%,此外,转化植株在干旱胁迫下叶片相对电导率更低,使用基因工程技术增强这一途径能够成功提高许多植物的干旱耐受性[83]。类似的研究表明,与对照相比,转BADH基因的马铃薯植株提高了对盐及干旱的抗性[84]。海藻糖是一种具有调节细胞渗透压的渗透调节物质。海藻糖和海藻糖-6-磷酸(Trehalose-6-phosphate,T6P)分别由海藻糖-6-磷酸磷酸酶(Trehalose 6-phosphate phosphatase,TPP)和海藻糖-6-磷酸合成酶(Trehalose-6-phosphate synthase,TPS)催化合成。将TPS1基因转化到马铃薯中,结果表明转基因植株的相对含水量和光合作用速率明显高于对照组而气孔导度低于非转化植株,这表明海藻糖的积累有利于提高马铃薯的耐旱性[84]。马铃薯响应干旱胁迫往往与植物激素有关。色胺途径(TAM pathway)中的YUCCA是IAA生物合成的关键酶。研究表明,过表达YUCCA家族成员AtYUC6的马铃薯植株能够增强耐旱性,同时降低叶中活性氧的水平[85]。StRcd1基因在干旱胁迫诱导下表达,这表明StRcd1在干旱胁迫下发挥重要的作用[86]。马铃薯DRO1参与响应干旱胁迫,并与株高、根长、叶绿素含量和SOD活性的调控密切相关[87]。StCDPK28可通过降低MDA、H2O2含量,增加CAT、SOD和POD活性,提高马铃薯植株的抗旱能力[88]。异源表达AtCDPK1增强了马铃薯的保水能力以提高植株的抗旱性[89]。StPIPs的表达改善了植物的整体水分关系,并有助于维持光合作用和气孔导度,最大限度地减少碳饥饿并增强整个植株对干旱胁迫的耐受性[90]。表皮模式因子2(EPF2)是气孔发育的负调节因子,过表达EPF2提高了植株的光合速率、光系统II效率和瞬时水分利用效率,增强了植株的抗旱能力[91]。
基因组学、蛋白质组学、代谢组学的研究加快了对马铃薯抗旱机理的研究进程。对马铃薯StIgt、HSP90基因家族的全基因组鉴定和表达分析表明,在干旱/PEG胁迫下呈现差异性的表达,这就表明HSP90、StIgt在响应干旱胁迫过程中发挥着重要作用[92,93]。李鹏程等[94]研究表明,DNA的甲基化与响应马铃薯干旱胁迫的相关表型有关。对马铃薯耐旱品种和干旱敏感品种在干旱胁迫的差异表达分析表明,共有23个基因在干旱胁迫下表达谱明显不同,这些基因包括碳水化合物转运蛋白、MAPKKK15、SCPL19、nsLPT[61]。Sprenger等[95]比较干旱敏感型品种(‘Milva’和‘Alegria’)和耐旱品种(‘Desiree’和‘Saturna’)在温室和田间的转录组测序表明,在干旱胁迫下分别有54个基因均上调表达,48个基因均下调表达,包括HSP20、HSP70、ABA受体PYL4、MAPK激酶、PERK1激酶、受体激酶等。章玉婷等[96]对耐旱马铃薯品种‘宁蒗182’的蛋白组学分析,发现12个差异表达蛋白,包括光合系统及线粒体保护、胁迫响应信号传导、运输相关蛋白等。张丽莉[97]对3个马铃薯品种蛋白组学分析发现,有16个与抗旱有关的差异表达蛋白。
上述研究表明,马铃薯的抗旱与ABA信号通路、MAPK激酶、受体激酶、热激蛋白等有关。
5.1 关注光合作用对马铃薯抗旱性的影响
在过去研究中,对于马铃薯的抗旱性研究主要集中在产量、植物表型、光合作用及呼吸速率,对光合作用的机制研究较少。尽管大多数研究表明在干旱条件下增强光合作用可以显著改善植物的生长,但其对块茎产量和品质的影响在很大的程度上仍然未知。因此,未来的研究仍需侧重于在干旱胁迫下光合作用与马铃薯块茎产量和品质的作用关系。
5.2 确定马铃薯中关键耐旱性调控因子
尽管在2011年完成了对马铃薯基因组的测序工作,但对于关键耐旱性调控因子的挖掘并未取得实质性的进展。目前对马铃薯耐旱性的研究仅停留在采用基因工程技术揭示基因的功能,缺乏系统、快速、有效的鉴定手段,且研究内容较为单一。因此,认为利用生物信息学初步筛选马铃薯关键耐旱性调控因子,构建其互作网络,建立完整的马铃薯耐旱性调控因子库,最终确定核心调控因子应作为重点研究对象。
5.3 解析马铃薯抗旱性分子新机制
由于马铃薯广泛种植在缺水地区,而且随着全球气候变暖可能会进一步加剧干旱的严重性。因此,了解马铃薯中抗旱性分子精确调控机制对于提高马铃薯产量至关重要。虽然目前已经鉴定了少量的马铃薯响应干旱胁迫基因的功能,但对这些基因作用网络,分子机制认识尚浅。在今后的研究中应重点关注核心调控因子的作用机制,从而解析马铃薯抗旱的分子新机制。
5.4 定向改良马铃薯抗旱性,培育耐旱新品种
粮食安全关乎国民生计。马铃薯对中国的粮食安全战略具有至关重要的作用。如何利用分子技术定向改良马铃薯的抗旱性,培育耐旱、高品质的新品种成为马铃薯育种的主要方向之一。因此,解析马铃薯抗旱分子机制,建立关键调控因子的互作网络,利用定点编辑技术,获得优良性状的马铃薯品种可能是有效的方式之一。通过人工智能设计育种方案,建立有效的育种模型,选择高效、准确、省时的育种方式,从而构建具有培育耐旱新品种的育种体系。
猜你喜欢 抗旱性块茎光合作用 遮阴处理对白及块茎产量和有效成分的影响安徽农业大学学报(2022年2期)2022-11-09云南小麦品种(系)萌发期抗旱性评价作物研究(2022年4期)2022-09-21环境与植物激素对马铃薯块茎休眠与萌发的影响研究中国种业(2022年7期)2022-07-21体育人类学研究中的块茎范式新尝试——《作为文化块茎的传统武术:南部侗族黑虎拳的民族志研究》序体育科技文献通报(2022年5期)2022-06-05短期窖藏下马铃薯块茎品质指标的变化趋势今日农业(2021年15期)2021-11-26不同玉米品种萌发期和苗期抗旱性鉴定与评价种子(2020年11期)2020-12-05不同抗旱性小麦品种耗水量及产量形成的差异*中国生态农业学报(中英文)(2020年2期)2020-02-13家居布艺的光合作用Coco薇(2016年5期)2016-06-03例析净光合作用相关题型解题中的信息提取错误与矫正考试周刊(2016年6期)2016-03-11爱上光合作用少儿科学周刊·儿童版(2015年10期)2015-11-07







