Tim-3/aPKC-ι,通路在英夫利西单抗治疗克罗恩病病程判断中的作用
时间:2022-12-10 09:00:03 来源:雅意学习网 本文已影响 人 
孙华文 王秋爽 周佳伟
武汉大学人民医院胃肠外科 湖北 武汉 430060
克罗恩病(Crohn"s disease,CD)免疫主要为由Th1 介导的细胞免疫,Tim-3 只表达于Th1 细胞,Tim-3 有关通路在克罗恩病的相关免疫细胞起主要作用。我们的前期研究表明,极化调节蛋白非典型蛋白激酶C(atypical protein kinase C,aPKC)与CD纤维化有关。aPKC-ι 是其新亚型,近年来,生物免疫靶向治疗药物英夫利西(infliximab,IFX)已在CD治疗中取得良好疗效,能控制免疫细胞浸润和炎性反应发生[1],本研究使用IFX 治疗活动期CD 患者,分析在不同时间外周血及肠黏膜组织内Tim-3 和aPKC-ι mRNA 表 达水平,探讨Tim-3/aPKC-ι 通路对英夫利西单抗治疗克罗恩病病程临床判断作用。
1.1 病例收集收集2009 年6 月至2019 年7 月武汉大学人民医院的住院CD 患者45 例,临床诊断资料完整、彼此无血缘关系,诊断标准依据中华医学会消化病学分会炎症性肠病协作组制定的《中国炎症性肠病诊断治疗规范的共识意见》,其中男25 例,女20 例,年龄中位数34 岁;
患者的疾病活动指数(CD activity index,CDAI)为(348.45±18.50)分;
平均病史(6.24±2.68)年;
CD 患者纳入标准:所有患者均已确诊且在入选时均未接受过免疫抑制剂和生物制剂治疗,未合并其他自身免疫性疾病、感染性疾病、肿瘤等。健康对照组纳入标准:选择同期接受结肠镜检查并留取活组织标本和外周静脉血标本的16 名健康体检者为健康对照组,其中男10名,女6 名,年 龄21~50 岁,年 龄 中 位 数32.5 岁。CD 患者与健康对照者年龄及性别组成差异无统计学意义。所有研究对象均签署知情同意书,本研究经本院临床试验注册和经过医院伦理委员会批准。CD 患者均于第0、2、6 周分别接受静脉滴注IFX(5 mg/kg)诱导缓解治疗。分别在第0、5、10、15 周评估患者状况,抽取外周静脉血,进行内镜检查和活组织检查,观察CDAI、血沉(ESR)、C-反应蛋白(CRP)的变化。
1.2 方法
1.2.1外周血T 细胞亚群的检测 采集静脉血1 mL,EDTA 抗凝。取50 μL 抗凝全血细胞悬液,分别加入荧光标记单克隆抗体即鼠抗人CD4-FITC、CD8-FITC、CD28-PE 各10 μL,阴性对照管中加入鼠IgG-FITC 和IgG-PE 各10 μL,混匀置室温20 ℃避光孵育25 min,加入溶血素0.5 mL,放置15 min,洗涤、离心后检测。标本置流式细胞仪内,做双色荧光流式细胞检测。以不同双荧光素标记组合分析CD4+,CD8+,CD8+CD28+,CD8+CD28-,CD28+的T 细胞亚群,每次每样本淋巴细胞计数均大于5 000 个。荧光标记单克隆抗体购自Sigma 公司,流式细胞仪型号为美国Coulter 公司产品。
1.2.2靶向RNA 干扰Tim-3 慢病毒载体的构建及包装 应用RNAQiDesigner 网站针对Tim-3 基因序列设计并构建4 个慢病毒小发卡结构RNA(small hairpin RNA,shRNA 序列和1 个对照序列,根据干扰RNA 序列,完成了对病毒载体(pMAGic4.1)框架构建,由上海华生公司代为合成了有关干扰oligo 片段,并包装转染慢病毒载体。
1.2.3慢病毒载体转染T 细胞 将包装好的慢病毒载体转染细胞(均由Sigma 公司提供),操作根据转染试剂盒说明书进行,实验共分为3 组:T 细胞组、空载体转染(V-T 细胞)组以及Tim-3 转染组(Tim-3-T)。
1.2.4引物的设计与合成 根据GenBank 中人aPKC-ι(gi:89142743)和GAPDH(gi:33871196)的mRNA 序 列,利 用Primer Express 2.0 软 件 设 计 基因专一性的引物。aPKC-ι 的上游引物5"-GGCTGTTACGATGGTTTATGATGT -3",下 游 引 物5"-AATCAAAGGCATCATTTTAGGGATA-3",扩 增 子 82 bp;
P5:5" - AAAGATCTATGTTTTCAGGTCTTACCCTCAAC - 3", P6:5" - CGGGATCCTCAGGATGGCTGCTGGCTGTTGAC-3",该对引物扩增Tim-3 全长编码区,扩增目的片段大小为846 bp;
GAPDH 的上游引物5"-CCATCAATGACCCCTTCATTG-3",下 游 引物5"-CATGGGTGGAATCATATTGGAAC-3",扩增子66 bp。引物设计完成后,分别检测所得总RNA 的质量和浓度。然后进行cDNA 的合成和荧光定量PCR 检测反应完成后设定基线值(baseline)和阈值(threshold),读取阈循环(Ct)值。根据公式△Ct=Ct(目的基因)-Ct(内参基因)和△△Ct=△Ct(处理组)-△Ct(对照组),计算2-△△Ct,即为处理组aPKC-ι 表达量相对于正常组的倍数。
1.2.5体外试验 检测T 细胞转染效果对aPKC-ι的影响,确认Tim-3/aPKC-ι 通路的存在:取上述的外周血的上清液,按组进行试验,具体如下:ELISA分析各组上清白细胞介素(IL)-12、干扰素(IFN)-γ、肿瘤坏死因子(TNF)-β;
使用荧光定量PCR 方法分析各组上清Tim-3 和aPKC-ι mRNA 基因表达水平变化。
1.2.6治疗和检测
1.2.6.1CD 患者均于第0、2、6 周分别接受静脉滴注IFX(5 mg/kg)诱导缓解治疗。分别在第0、5、10、15 周评估患者状况,抽取外周静脉血,进行内镜检查和活组织检查,观察CDAI、ESR、CRP 的变化。具体方法:采集空腹静脉血5 mL,室温下放置20 min,然后离心10 min,取上层血清样本分装于EP管,每管100 mL。存放于-80 ℃冰箱保存备用。用于 检 测Tim-3 和aPKC-ι mRNA 的 表 达。
1.2.6.2肠黏膜组织内后Tim-3 和aPKC-ι mRNA表达水平 根据文献[1]的方法,从肠黏膜组织中提取总RNA 后,用于检测Tim-3 和aPKC-ι mRNA的表达。
1.3 统计学分析CD 患者IFX 治疗前与健康对照组的比较符合正态分布,采用独立样本t检验,IFX 治疗前后的比较采用配对样本t检验。P<0.05 为差异有统计学意义。
2.1 靶向RNA 干扰Tim-3 的结果T 组半定量分析比值为4.62±0.12,而Tim-3-T 细胞则为1.74±0.04,2 组差异有统计学意义(P<0.05),而T 细胞、V-T 细胞无统计学差异,V-T 细胞(1.45±0.14)与Tim-3-T 细胞有显著性差异(P<0.05),表明靶向RNA 干扰Tim-3 慢病毒重组载体构建成功(图1)。
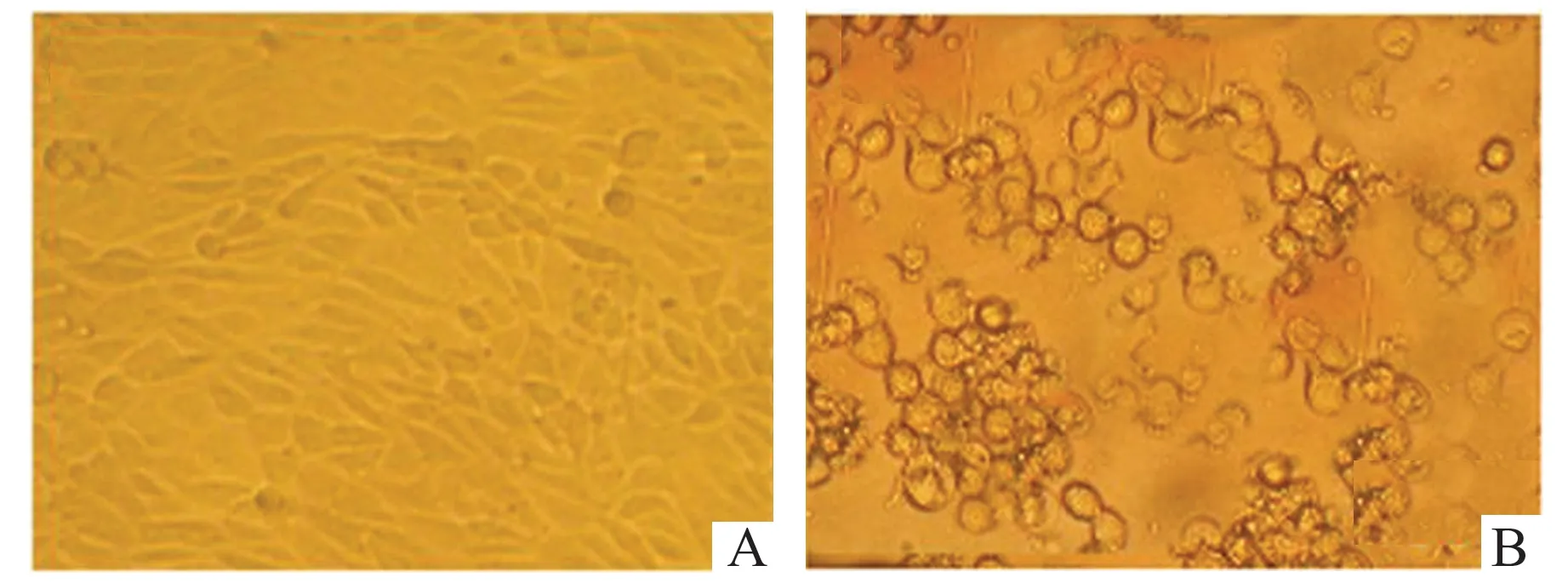
图1 光镜下CD4+ Th 细胞(×400)
2.2 Tim-3 低表达T 细胞对细胞因子分泌的影响ELISA 结果显示:经细胞共培养以后,T 细胞分泌IL-12、IFN-γ 因子表达水平明显低于T 细胞、V-T 细胞组(P<0.05),提示Th1 类细胞因子分泌降低(表1、2,图2、3)。
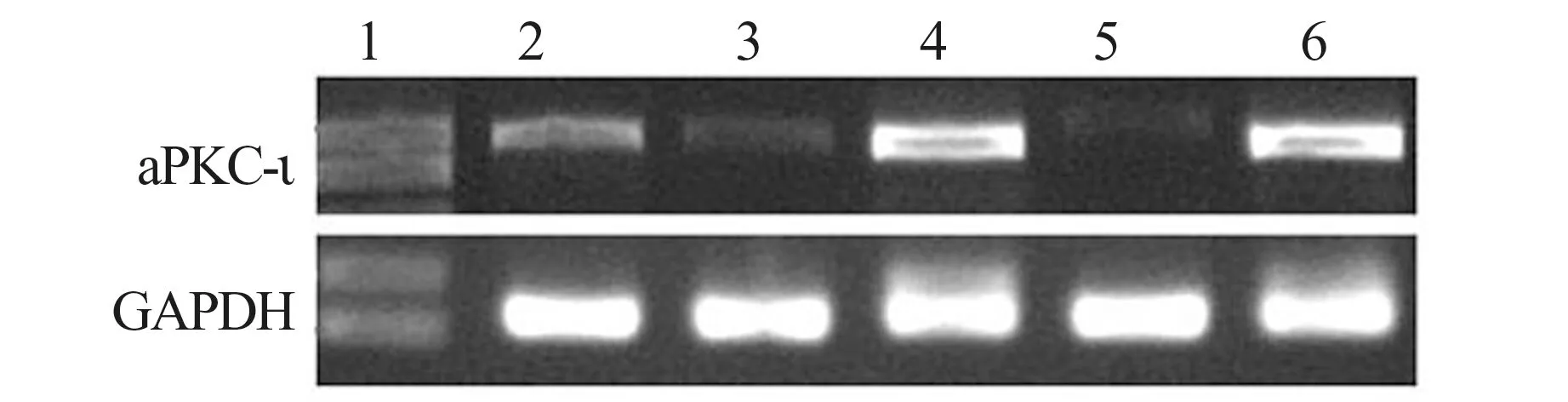
图2 aPKC-ι mRNA 表达水平
表1 体外shRNA(Tim-3)干扰T 细胞细胞因子的表达(pg/mL,±s)

表1 体外shRNA(Tim-3)干扰T 细胞细胞因子的表达(pg/mL,±s)
与T 细胞组和V-T 细胞组比较,*P<0.05
TNF-β 378.09±19.87 370.54±17.27 113.21±45.88*组别T 细胞组V-T 细胞组Tim-3-T 细胞IL-12 405.12±12.56 456.25±11.25 105.18±13.53*IFN-γ 320.54±23.78 343.23±13.44 119.16±8.56*
2.3 IFX 治疗开始前(0 周)和治疗第5、10 和15 周ESR、CRP 和CDAI 的变化治疗前,患者的ESR、CRP 和 CDAI 分 别 为(46.81±0.56)mm/h、(48.43±11.51)mg/L、348.42±18.53,治疗后第5周变化不明显,第10 和15 周ESR、CRP 和CDAI 的变化具有显著性意义,差异均有统计学意义(t=9.568,均P<0.05)。见表3。
表2 体外shRNA 干扰T 细胞后Tim-3 和aPKC-ι mRNA基因表达水平变化(倍,±s)
表2 体外shRNA 干扰T 细胞后Tim-3 和aPKC-ι mRNA基因表达水平变化(倍,±s)
与T 细胞组和V-T 细胞组比较,*P<0.05
aPKC-ι mRNA 4.20±0.67 3.76±0.49 1.21±0.89*组别T 细胞组V-T 细胞组Tim-3-T 细胞Tim-3 3.61±0.75 4.17±0.48 1.14±0.16*
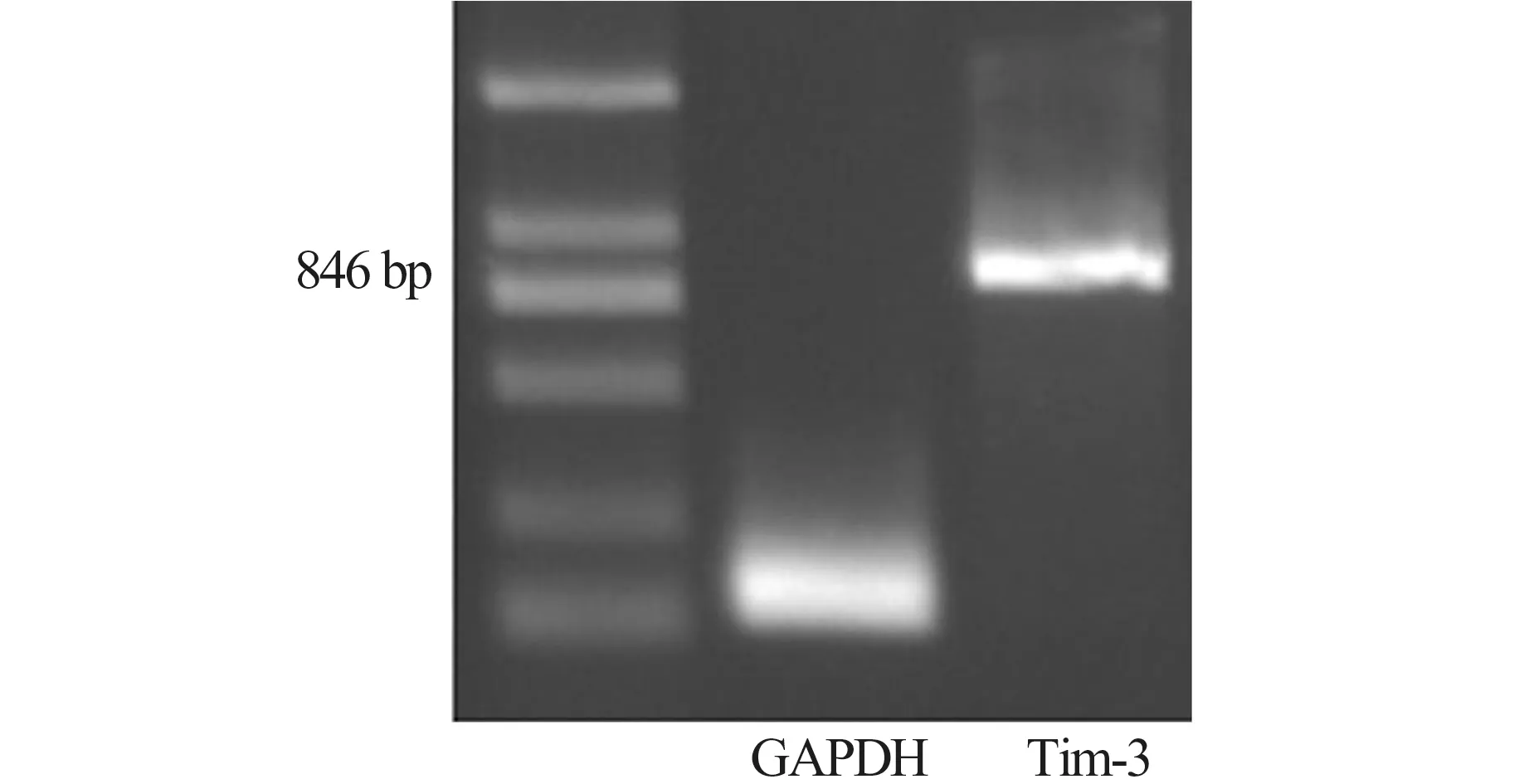
图3 治疗前Tim-3 mRNA 表达水平(RT-PCR 法)
表3 IFX 治疗前后ESR、CRP 和CDAI 的变化(±s)

表3 IFX 治疗前后ESR、CRP 和CDAI 的变化(±s)
与第0 和第5 周比较,*P<0.05
15 周8.32±1.17*11.32±1.88*56.82±1.15*指标ESR(mm/h)CRP(mg/L)CDAI 0 周46.82±0.56 48.41±11.50 348.45±18.50 5 周42.82±8.52 41.64±4.61 299.12±14.90 10 周15.32±1.74*17.32±1.54*121.56±1.15*
2.4 IFX 治疗前后CD 患者外周血和肠黏膜组织内Tim-3 和aPKC-ι mRNA 基因表达水平治疗前,CD 患者外周血和肠黏膜组织内Tim-3 和aPKC-ι mRNA 表 达 水 平(分 别 为5.25±0.89 和5.11±0.45)均明显高于健康对照者(分别为2.25±0.41 和1.44±0.18),差异均有统计学意义(均P<0.05)。治疗后第5 周时,CD 患者外周血和肠黏膜组织内Tim-3 和aPKC-ι mRNA 表达水平下降不明显,相对应的临床ESR、CRP 和CDAI 的变化也不显著;
但是,治疗后第10 和15 周时,CD 患者外周血和肠黏膜组织内Tim-3 和aPKC-ι mRNA 表达水平均明显低于治疗前(均P<0.05)。见表4。
表4 外周血和肠黏膜组织内Tim-3 和aPKC-ι mRNA 表达水平变化(倍,±s)
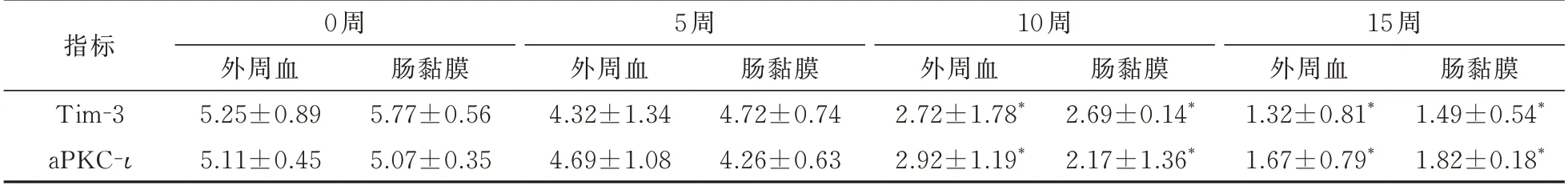
表4 外周血和肠黏膜组织内Tim-3 和aPKC-ι mRNA 表达水平变化(倍,±s)
与第0 和第5 周比较,*P<0.05
指标 肠黏膜1.49±0.54*1.82±0.18*Tim-3 aPKC-ι 0 周外周血5.25±0.89 5.11±0.45肠黏膜5.77±0.56 5.07±0.35 5 周外周血4.32±1.34 4.69±1.08肠黏膜4.72±0.74 4.26±0.63 10 周外周血2.72±1.78*2.92±1.19*肠黏膜2.69±0.14*2.17±1.36*15 周外周血1.32±0.81*1.67±0.79*
Th1 细胞的过度活化是克罗恩病主要的致病机制。Monney 等[2]、Dardalhon 等[3]和Meyers 等[4]发现了一种新的蛋白:Tim-3,一种具有多态性的细胞表面膜蛋白,属于T 细胞免疫球蛋白黏蛋白家族成员,其只表达于Th1 细胞,是一种负性免疫调控因子,通过产生抑制信号导致Th1 细胞和Tc1 细胞的凋亡,因而,Tim-3 可抑制Th1 细胞的功能,影响Th1 细胞分泌的细胞因子,起到免疫抑制的作用,与慢性感染、自身免疫性疾病、哮喘及肿瘤等疾病有关[5,6],Tim-3 由281 个氨基酸组成的Ⅰ型跨膜蛋白,编码Tim 蛋白的基因定位于人染色体5q33.2,鼠染色体11B1.1,这些部位都是与克罗恩病等自体免疫疾病高度相关的部位[7,8]。
Tim-3 其只表达于Th1 细胞,目前还不明确Tim-3 有关通路在克罗恩病如何起作用。研究发现:单纯Tim-3 的单克隆抗体治疗克罗恩病的临床疗效并不理想,其原因在于Tim-3 的有关通路下游基因的作用机制不明[9,10]。极化调节蛋白aPKC 是细胞极化调节的中心环节,aPKC-ι 是其新亚型,是调控上皮细胞、间质细胞转化和极化重建的关键分子,也有研究[11,12]发现:aPKC-ι 也可以导致纤维化细胞在相应致纤维化的细胞介质作用下激活,从而发生致纤维化作用,研究表明aPKC-ι 与肠道的病变密切相关,可以动态反映克罗恩病的治疗效果,因而可能成为一种反映克罗恩病的治疗效果新型标志物,极可能是Tim-3 的下游基因,克罗恩病的发病机制中存在Tim-3/aPKC-ι 通路。
aPKC-ι 在炎症性肠病的发生发展过程中起促炎作用[13],能诱导外周血T 细胞活化,分泌高水平的促炎细胞因子。aPKC-ι 还可通过诱导巨噬细胞炎性蛋白-3 表达,进而诱导阳性T 细胞向肠黏膜组织内聚集,引起炎性反应。aPKC-ι 在炎症性肠病患者的T 细胞中高表达,增强T 细胞活性及杀伤活性,产生促炎细胞因子,诱导Th17 细胞分化,进一步引起炎性反应。传统的逐级递增CD 治疗方案虽能避免糖皮质激素、免疫抑制剂所致损害,但不能有效降低CD 相关并发症的发生率[14]。
本文先利用RNA 干扰技术体外确认CD 患者发病机制存在Tim-3/aPKC-ι 通路,我们的检测显示:Tim-3 shRNA-T 细 胞 组IL-12 和IFN-γ 以 及TNF-β 的 分 泌 均 明 显 低 于 对 照 组(P<0.05)。RNA 干扰Tim-3 基因在T 细胞表达后,可抑制下游的aPKC-ι mRNA 表达水平以及T 细胞增殖的作用,提示CD 患者体内存在Tim-3/aPKC-ι 通路;
本文明确Tim-3/aPKC-ι 通路与英夫利西(IFX)治疗的疗效存在关联,IFX 治疗前,CD 患者在外周血Tim-3 和aPKC-ι mRNA 表 达 水 平(5.25±0.89,5.11±0.45)和 肠 黏 膜 组 织 内Tim-3 和aPKC-ι mRNA 表达水平(5.77±0.56,5.07±0.35)均明显高于健康对照者,差异均有统计学意义(均P<0.05)。第5 周开始,在第10 周和15 周时,CD 患者外周血Tim-3 和aPKC-ι mRNA 表达水平和肠黏膜组织内Tim-3 和aPKC-ι mRNA 表达水平均明显低于治疗前,差异均有统计学意义(P<0.05)。治疗前CD 患者的ESR、CRP 和CDA1 和治疗后相比无 显 著 性 差 别,说 明IFX 激 活Tim-3/aPKC-ι 通 路的作用的剂量-效应没有达到一定时间和强度,在第10 周 和 第15 周ESR、CRP 和CDAI 的 变 化 逐 步 下降,第10 周和第15 周ESR、CRP 和CDAI 的变化差异均有统计学意义(均P<0.05)。
IFX 是通过基因工程合成的鼠人杂合抗TNF单克隆抗体,可以经补体依赖的细胞毒作用、抗体依赖细胞介导的细胞毒作用和T 细胞凋亡诱导作用,溶解产生TNF 的细胞[15]。目前IFX 已被应用于中重度糖皮质激素依赖且传统药物治疗无效的活动期CD 患者。我们发现,IFX 治疗5 周以后,肠黏膜上皮以及固有层中性粒细胞浸润减少,单核细胞下降,CD4+、CD8+、和巨噬细胞数量减少,结肠上皮人类白细胞抗原DR 等位基因异常和固有层细胞间黏附分子-1 表达水平明显下降,表达TNF 的细胞数量减少[16,17]。本研究发现:CD 患者经3 次IFX 诱导治疗后,疾病活动指标均显著改善,外周血CD4 T细胞Tim-3 和aPKC-ι mRNA 表达水平和肠黏膜组织内Tim-3 和aPKC-ι mRNA 表达水平均显著下降。提示IFX 治疗可能通过Tim-3/aPKC-ι 通路而抑制肠黏膜炎性反应,控制CD 患者疾病进展。
本研究结果显示:RNA 干扰技术体外确认CD患者发病机制存在Tim-3/aPKC-ι 通路;
IFX 在中和TNF 的 同 时,肠 黏 膜Tim-3 和aPKC-ι 的 表 达 水 平也 下降。Tim-3/aPKC-ι 通路在IFX 治疗CD 中,对IFX 的疗效和病程判断具有重要的临床意义。








