乳腺癌组织中ASNS和MBP表达水平及临床意义
时间:2022-12-07 20:05:04 来源:雅意学习网 本文已影响 人 
鲁诗勇,王 毅,胡清林
(1.成都市青白江区妇幼保健院普外科,成都 610500;
2.成都医学院第一附属医院甲乳外科,成都 610599)
乳腺癌是女性常见恶性肿瘤,全世界每年乳腺癌新发例数达196万例[1]。目前乳腺癌的治疗以手术、放化疗及内分泌治疗等为主,但部分患者即使经积极治疗后仍可出现复发及转移,导致患者死亡[2]。因此,有必要深入研究乳腺癌发生的病因和机制,寻找新的早期诊治及预后判断的标志物。门冬酰胺合成酶(asparagine synthetase,ASNS)基因位于人类7号染色体,编码的蛋白质参与天冬酰胺的合成,参与正常细胞的氨基酸代谢、能量代谢等过程[3]。ASNS在人类多种肿瘤,包括肝癌[4]、肺癌[5]等恶性肿瘤中表达均显著上调,其通过激活癌基因KRAS的表达,促进肿瘤细胞的恶性增殖,导致肿瘤进展。髓鞘碱性蛋白(myelin basic protein,MBP)编码基因位于人类18号染色体,编码蛋白是少突胶质细胞和雪旺细胞髓鞘的主要成分。近年来发现,MBP在颅脑部肿瘤[6]、肺癌[7]中异常表达,检测脑脊液或组织中MBP水平有助于肿瘤的早期诊断及预后判断。有学者[8]报道,ASNS能够通过调控肝激酶B1(liver kinase B1,LKB1)的活性,抑制MBP的表达,促进肿瘤细胞的增殖,抑制凋亡,导致肿瘤进展。但目前ASNS和MBP在乳腺癌中的表达和临床预后价值还不明确。本研究分析乳腺癌中ASNS和MBP的表达,分析两者与预后的关系,探讨其临床意义。
1.1 研究对象
以2017年2月至2018年2月于成都市青白江区妇幼保健院诊治的90例乳腺癌患者为研究对象。纳入标准:1)经术后病理检查诊断明确;
2)首次诊治;
3)临床和随访资料完整,患者及家属对本研究知情同意。排除标准:1)合并急性乳腺炎等乳腺感染性疾病;
2)伴有其他器官恶性肿瘤;
3)合并类风湿关节炎等自身免疫疾病。90例患者均行手术治疗,年龄33~68岁,平均(59.6±3.1)岁;
月经情况:绝经前44例,绝经后46例;
病理类型:浸润型导管癌60例,非浸润型导管癌30例;
组织分化:高中分化49例,低分化41例;
肿瘤分期:Ⅰ—Ⅱ期65例,Ⅲ期25例;
伴淋巴结转移40例,无淋巴结转移50例;
肿瘤直径:<3 cm者42例,≥3 cm者48例;
是否三阴性:是27例,否63例。术后随访3~36个月,平均(32.45±2.13)个月。本研究经本院伦理委员会审核通过。
1.2 免疫组织化学检测ASNS、MBP表达
将癌和癌旁组织用10%组织固定液固定24 h,石蜡包埋后切片,65 ℃烤片3 h后二甲苯脱蜡;
梯度乙醇水化;
抗原热修复10 min;
3%双氧水阻断内源性过氧化物酶20 min;
1%羊血清封闭30 min;
一抗4 ℃条件孵育16 h(ASNS、MBP兔单抗购自Abcam公司,货号ab40850、ab209328);
山羊抗兔二抗37 ℃孵育2 h;
辣根过氧化物酶标记三抗37 ℃孵育1 h;
显色液镜下显色1 min;
苏木精染核1 min;
梯度乙醇脱水后,中性树脂封片。200倍显微镜下观察组织染色情况,并进行免疫组织化学染色评分。根据阳性染色强度评分与染色面积评分乘积计算免疫组织化学染色评分[9]。染色强度评分:不着色为0分,淡黄色为1分,棕黄色为2分,深褐色为3分;
染色面积评分:<25%为1分,25%~50%为2分,>50%为3分。免疫组织化学评分>2分为阳性。
1.3 统计学方法
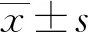
2.1 ASNS mRNA、MBP mRNA表达
TCGA数据库研究表明,相比于癌旁组织,乳腺癌组织中ASNS mRNA表达明显较高,而MBP mRNA表达明显较低,差异有统计学意义(P<0.000 1)。见图1。
*P<0.0001。
2.2 ASNS、MBP表达
ASNS黄褐色染色主要位于癌组织中的细胞质,MBP黄褐色染色主要分布于癌旁组织中的细胞质(图2)。癌及癌旁组织中ASNS阳性率分别为73.33%(66/90)、24.44%(22/90),MBP阳性率分别为27.78%(25/90)、86.67%(70/90)。癌组织中ASNS阳性表达率明显高于癌旁组织(χ2=21.679,P<0.001),MBP阳性表达率明显低于癌旁组织(χ2=45.139,P<0.001)。Spearman秩相关分析结果,乳腺癌组织中ASNS、MBP蛋白呈显著负相关(r=-0.569,P<0.001)。

图2 乳腺癌中ASNS、MBP蛋白表达(200×)
2.3 ASNS、MBP表达与乳腺癌临床病理特征的关系
不同肿瘤分期及淋巴结转移患者癌组织中ASNS、MBP阳性率差异有统计学意义(均P<0.05),不同年龄、月经情况、肿瘤大小、病理类型、分化程度及是否三阴性患者ASNS、MBP阳性率差异无统计学意义(均P>0.05)。见表1。

表1 ASNS、MBP与乳腺癌临床病理特征的关系
2.4 ASNS、MBP表达与乳腺癌患者生存预后的关系
随访期间患者死亡18例,3年总体生存率为80.00%(72/90)。ASNS阳性组及阴性组3年总体生存率分别为75.76%(50/66)、91.67%(22/24)。ASNS阳性组的3年总体生存率显著低于ASNS阴性组(χ2=5.113,P=0.001);
MBP阳性组及阴性组3年总体生存率分别为88.57%(31/35)、63.07%(41/65),MBP阳性组的3年总体生存率显著高于阴性组(χ2=7.335,P=0.007)。见图3。
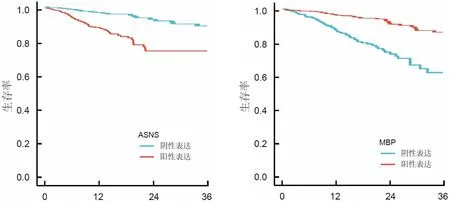
生存时间/月 生存时间/月
2.5 单因素及多因素COX回归分析影响乳腺癌预后的因素
单因素COX分析结果示ASNS、MBP、肿瘤分期及淋巴结转移状态是影响乳腺癌患者生存预后的因素,多因素COX回归分析结果示乳腺癌组织中ASNS阳性、MBP阴性、肿瘤分期Ⅲ期及淋巴结转移是影响乳腺癌预后的的独立危险因素。见表2。
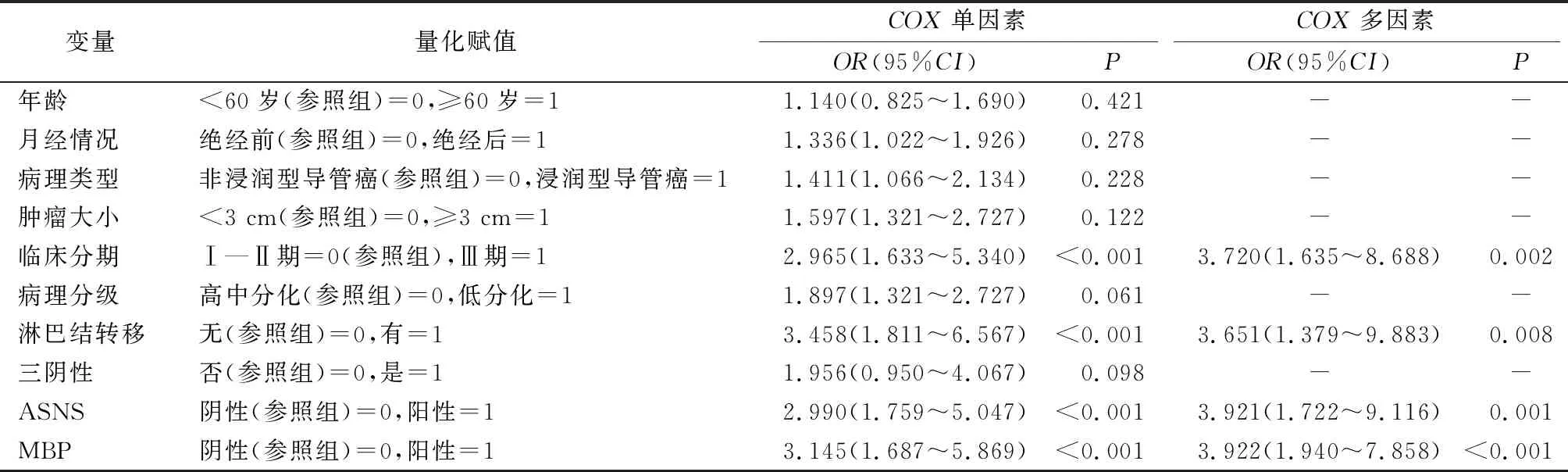
表2 单因素及多因素COX回归分析影响乳腺癌预后的因素
近年来,我国乳腺癌的发病率逐渐升高,发病率为46.74/10万,病死率为10.14/10万,并且有逐渐年轻化的趋势[10]。虽然乳腺癌的诊治水平提高,如高危人群的早期筛查检测、分子靶向治疗药物的应用等一定程度上改善了患者的临床预后,但仍然不能彻底治愈[11]。因此,深入探索乳腺癌疾病机制,寻找新的预后评估的分子指标,对于实现肿瘤患者的个体化治疗和临床决策,具有重要的意义。
肿瘤的发生发展需要相应的能量和物质基础,为满足肿瘤细胞快速增殖所需的能量,肿瘤细胞代谢异常活跃,并且具有与正常细胞不同的特征性改变,是肿瘤的基本特征之一[12]。ASNS编码蛋白属于转氨酶家族。结构上,ASNS由2个结构域组成:N端催化谷氨酰胺水解,C端催化天冬氨酸的羧酸盐。功能上,ASNS以ATP依赖性方式将谷氨酰胺和天冬氨酸催化为谷氨酸和天冬酰胺。有研究[13]表明,ASNS在肿瘤细胞增殖生长中发挥了重要调控作用,通过促进天冬酰胺的合成,促进肿瘤细胞的恶性增殖,是新的肿瘤标志物。本研究乳腺癌组织中ASNS蛋白表达阳性率均明显高于癌旁组织,提示乳腺癌中ASNS表达上调。分析其原因,可能与肿瘤细胞中ASNS基因拷贝数扩增有关。THOMAS等[13]研究表明,胶质瘤中ASNS基因的扩增促进ASNS的表达,同时促进肿瘤的增殖及转移。本研究癌组织中ASNS的表达与肿瘤分期及淋巴结转移有关,提示ASNS促进肿瘤的恶性进展。分析其原因,可能是ASNS参与对肿瘤代谢的调节过程。有研究[14]表明,天冬氨酸作为ASNS的底物,能够挽救肿瘤细胞中的线粒体电子传递链缺陷,促进线粒体氧化磷酸化,证实其具有抑制肿瘤细胞增殖的能力。此外,天冬酰胺作为ASNS的产物,能够协助肿瘤细胞摄取其他氨基酸,并激活雷帕霉素靶蛋白信号通路,进而促进肿瘤细胞的恶性增殖[15]。肿瘤中ASNS的过度表达消耗天冬氨酸,同时产生大量天冬酰胺,促进肿瘤的发生发展。本研究分析癌组织中ASNS表达的临床预后价值,发现ASNS阳性表达的乳腺癌患者生存预后较差,并且多因素分析发现ASNS阳性是患者不良预后独立危险因素,表明检测癌组织中ASNS的表达有助于乳腺癌患者的预后判断。
MBP是一种强碱性蛋白质,主要由胶质细胞和雪旺氏细胞合成。MBP是髓鞘蛋白的主要成分之一,在神经细胞分化、髓鞘的发生和形成等生理过程中发挥重要作用。近年来发现,MBP在调控肿瘤细胞增殖及凋亡过程中发挥重要作用,如在胶质瘤中,MBP的高表达能够促进肿瘤细胞的增殖,并抑制凋亡,发挥肿瘤促进功能[16]。但亦有研究[17]报道,MBP能够促进T淋巴细胞等免疫细胞的免疫杀伤功能,进而抑制肿瘤细胞的恶性增殖。目前MBP在乳腺癌中的表达及临床意义尚不清楚。本研究发现,乳腺癌中MBP蛋白表达均显著降低。分析其原因,可能与MBP的转录后调控异常有关。研究表明,乳腺癌中微小RNA(miR)-24表达水平显著上调[18],而miR-24能够结合MBP信使RNA,抑制MBP的表达[19]。因此,乳腺癌中MBP的表达下调可能受到miR-24等非编码RNA的表达调控。本研究中,MBP的表达与肿瘤分期及淋巴结转移有关,提示乳腺癌中MBP的低表达促进肿瘤的恶性进展。分析其机制,可能与MBP对肿瘤微环境中免疫细胞功能的调控有关。有研究[20]证实,MBP能够结合并激活T淋巴细胞,同时抑制Th1型和Th17型免疫反应,参与促进自身免疫疾病的发生。此外,MBP能够诱导免疫细胞分泌产生刺激促炎性细胞因子如白介素-6、11等,激活机体免疫细胞的正常免疫功能[21]。体外白细胞黏附试验[22]亦证实,培养基中加入MBP能够促进白细胞与肿瘤细胞之间的黏附,促进白细胞的肿瘤杀伤作用。因此,肿瘤中MBP的表达下调可能导致免疫微环境中淋巴细胞的杀伤功能减弱,进而促进肿瘤的恶性进展。本研究进一步分析MBP表达的临床预后意义,发现MBP阴性表达是乳腺癌患者不良预后独立危险因素。表明乳腺癌中MBP的表达可能是新的乳腺癌预后判断的肿瘤标志物,值得临床进一步研究。
本研究乳腺癌组织中ASNS与MBP表达呈显著负相关,提示两者之间可能存在一定的调控关系,共同促进乳腺癌的恶性进展。DENG等[8]研究证实,肿瘤细胞中ASNS的过度激活导致天冬酰胺的水平升高,天冬酰胺通过抑制LKB1的功能,进而抑制LKB1底物MBP的表达和磷酸化激活,从而促进肿瘤细胞的增殖。但目前乳腺癌中ASNS与MBP关系尚不清楚,仍有待深入研究。
综上所述,乳腺癌中ASNS表达升高,MBP表达降低,癌组织中ASNS、MBP表达与肿瘤分期及淋巴结转移有关,两者共同参与肿瘤的恶性进展。ASNS阳性、BMP阴性是乳腺癌患者不良生存预后的独立危险因素,可能是新的乳腺癌预后判断的肿瘤标志物。本研究存在不足之处,由于乳腺癌不同分型可能作为一种混肴因素对本研究结果造成一定的影响,因此有待今后扩大样本量进行亚组分析,进一步验证本研究结果。
猜你喜欢 阴性恶性染色 无限路及其笛卡尔积、直积的孪生α-距离边染色西北民族大学学报(自然科学版)(2022年2期)2022-07-06玉簪属种质资源收集筛选及耐阴性研究安徽农业科学(2022年9期)2022-05-17探讨促甲状腺激素与甲状腺球蛋白联合检测在甲状腺良恶性结节诊断中的效果健康之家(2021年19期)2021-05-23探讨超声检查在甲状腺肿块良恶性鉴别中的诊断价值医学食疗与健康(2021年27期)2021-05-13△(G)=8且不含有三角形,4—圈的平面图的完备染色商情(2018年9期)2018-03-29类比法在图染色中的应用考试周刊(2018年8期)2018-01-19两类图的b—染色数和研究中国市场(2017年5期)2017-03-15神回复意林(2013年15期)2013-05-14因为恶性通涨而消失的货币(下)微型计算机·Geek(2009年8期)2009-12-15







