SIRT3在早发型子痫前期胎盘组织中的表达及作用*
时间:2023-06-29 20:45:02 来源:雅意学习网 本文已影响 人 
朱盛兰,都园渊,王少帅,张慧婷,江 一,张婧怡,周 璇,冯 玲
(华中科技大学同济医学院附属同济医院妇产科,武汉 430000)
子痫前期(preeclampsia,PE)作为一种妊娠期严重并发症,影响着全球3%~12%的孕产妇,是孕产妇死亡的主要原因之一[1]。妊娠34周前发病称为早发型子痫前期(early-onset preeclampsia,eoPE),其病情进展快、症状较重且预后较差,常伴随胎儿生长受限,成为大多数PE研究的焦点。PE发病机制是多因素、多机制及多通路的,但具体机制仍不清。普遍认为,eoPE是一种“胎盘源性疾病”[2]。沉默信息调节因子3(silence information regulator 3,SIRT3)属于Sirtuins家族,广泛表达于肝脏、心脏及肾脏等富含线粒体、新陈代谢快的器官[3]。SIRT3具有广泛且重要的生物学活性,通过去乙酰化反应,参与细胞增殖和凋亡、氧化应激、细胞周期、细胞自噬等过程,调控神经和心血管疾病等[4]。研究发现,SIRT3在孕晚期胎盘组织中的表达水平低于孕早、中期,且SIRT3在PE患者胎盘中表达降低,但其在胎盘源性疾病,如eoPE中的作用尚不清楚[5-7]。本研究通过检测eoPE患者胎盘组织中SIRT3表达,以妊娠早期绒毛外滋养细胞HTR-8/SVneo为研究对象,探索SIRT3对滋养细胞生物学功能的调控及其机制,以期揭示SIRT3在eoPE发生发展中的作用。
1.1 临床样本 选取2019年3月至2019年12月在华中科技大学同济医学院附属同济医院住院分娩的早发型PE患者10例(eoPE组),同期选取年龄和孕周相匹配的10例非感染性早产患者作为对照组(NC组)。eoPE诊断标准参照《妇产科学》第9版[8]。两组孕妇均为单胎、剖宫产分娩。排除标准:多胎、生殖器官畸形、先天性遗传性疾病以及其他妊娠相关合并症(如高血压、糖尿病、甲状腺疾病史等);
前置胎盘、胎盘早剥、羊水量异常。eoPE组和NC组的年龄、孕周、孕次和产次比较,差异无统计学意义(P>0.05),见表1。本研究通过医院伦理委员会批准。
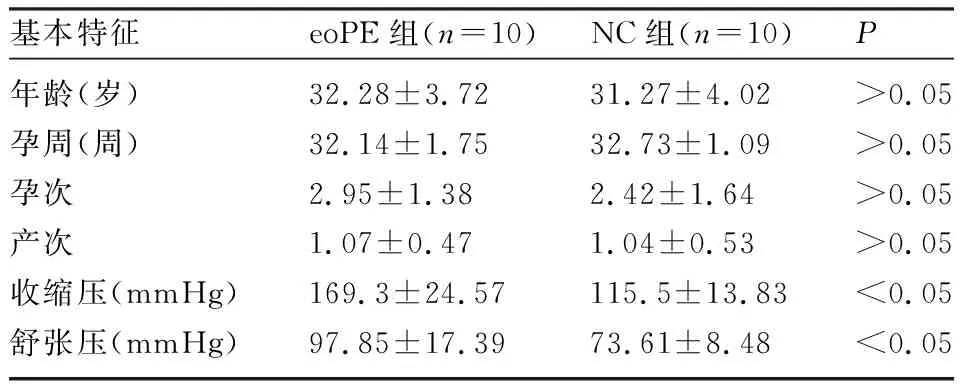
表1 患者基本资料
1.2 方法
1.2.1 样本采集和处理 胎盘娩出后,避开梗死及钙化等组织部位,迅速以脐带插入点为中心分四个象限,于母体面四个象限各取1.0cm×1.0cm×1.0cm大胎盘组织,冰浴无菌PBS充分漂洗,无菌纱布吸干水分。一部分分装后-80℃冻存用于提取RNA和蛋白;
一部分多聚甲醛固定,梯度酒精脱水后石蜡包埋并切片,用于免疫组化实验。
1.2.2 免疫组化 组织蜡块连续切片,65℃常规烘片、二甲苯脱蜡及梯度酒精水化,3%过氧化氢室温孵育,柠檬酸修复液高温抗原修复。其余严格按免疫组化试剂盒说明书进行(武汉Servicebio公司)。一抗为兔抗人SIRT3单克隆抗体(1∶100稀释,英国Abcam公司),PBS为阴性对照。显微镜下观察并取不同视野拍照,利用Image pro plus软件对免疫组化结果进行定量分析,得到平均光密度值(Mean Density)后进行统计学分析。
1.2.3 细胞培养和细胞转染 HTR-8/SVneo细胞购自ATCC,复苏后用含10% FBS的RPMI 1640培养基(美国Gibco公司),加1%青链霉素(武汉Servicebio公司),置5%CO2、37℃恒温培养箱培养。待细胞生长至对数生长期时,将细胞按4×105/孔接种至六孔板。细胞密度达60%~80%时,按NeofectTMDNA转染试剂说明书进行转染(北京Neofect公司)。EMPTY组和SIRT3组分别转染pCMV-MCS-3*Flag和pCMV-MCS-3*Flag-SIRT3(济南维真生物)。转染后48h,qRT-PCR和Western blot法验证转染效率。
1.2.4 实时荧光定量PCR Trizol法提取各组细胞总RNA,采用逆转录试剂盒将其逆转录,合成cDNA后进行实时荧光定量PCR(南京Vazyme公司)。SIRT3引物序列:上游为5"-GCTCTACACGCAGAACATCG-3",下游为5"-CATCACGTCAGCCCGAAT-3";
β-actin上游为5"-TGACGTGGACATCCGCAAAG-3",下游为5"-CTGGAAGGTGGACAGCGAGG-3"。采用2-△△CT相对定量法进行分析。
1.2.5 Matrigel侵袭和划痕实验检测细胞侵袭和迁移能力 Matrigel侵袭实验:提前制备铺好基质胶(美国BD公司)的小室(Matrigel基质胶:无血清培养基=1∶7),下室加600μL含10% FBS的RPMI 1640培养基,上室均匀滴加100μL无血清RPMI 1640培养基重悬为2×105/mL细胞悬液,培养24h,取出小室(美国Corning公司),4%多聚甲醛固定,结晶紫染色,显微镜拍照,Image J统计穿膜细胞数。划痕实验:六孔板中的细胞转染24h,待细胞贴壁生长至80%时用相同型号的移液管进行划痕,PBS轻柔清洗去除细胞碎片,0h和24h在相同位置拍摄图像,使用Image J分析。
1.2.6 细胞氧化应激模型建立 细胞生长至对数生长期时,按4×105细胞/孔接种至六孔板。细胞贴壁后,给予含不同浓度CoCl2(0、100、200、300和400μmol/L)的RPMI 1640培养基继续处理细胞24h。Western blot法检测细胞内SIRT3表达。
1.2.7 ROS检测 使用ROS试剂盒(碧云天生物)测定六孔板细胞内ROS水平,加2mL无血清1640培养基稀释的DCFH-DA(1∶1000),37℃避光孵育30min,PBS洗涤2次去除未进细胞内的荧光探针,激光共聚焦显微镜观察,取不同视野下拍照。
1.2.8 氧化应激指标检测 使用总SOD活性检测试剂盒(WST-8法)、脂质氧化(MDA)检测试剂盒、总谷胱甘肽过氧化物酶检测试剂盒测定胎盘组织和细胞内总SOD、MDA和总GSH的含量水平(碧云天生物)。所有步骤均按说明书进行操作,通过酶标仪设定特定波长(总SOD检测波长:450nm;
MDA检测波长:532nm;
总GSH检测波长:340nm)检测各孔OD值,计算结果。
1.2.9 Western blot法检测蛋白表达 RIPA裂解液(含1% PMSF和磷酸酶抑制剂)提取胎盘组织和细胞蛋白,BCA法测量蛋白浓度(碧云天生物)。SDS-PAGE凝胶电泳,冰浴下300mA恒流将蛋白转移至PVDF膜(Millipore)。5% BSA封闭1h,4℃摇床孵育一抗过夜。一抗有SIRT3兔单抗(1∶1000,Abcam);
Akt(pan)兔单抗、Phospho-Akt(Thr308)兔单抗、PDK1兔多抗、Phospho-PDK1(Ser241)兔单抗、Phospho-GSK-3β(Ser9)兔单抗、Phospho-c-Raf(Ser259)兔单抗(1∶1000,CST);
β-actin鼠单抗(1∶10000,Abbkine)。次日TBST洗膜3次,室温摇床上孵育二抗1h,TBST洗膜3次后ECL发光法显影曝光。Image J软件对条带进行灰度数据分析。

2.1 两组胎盘组织中SIRT3表达情况 免疫组化和Western blot检测结果显示,SIRT3在eoPE组胎盘组织中的表达水平显著低于对照组,差异有统计学意义(P<0.05),见图1、2。

图1 免疫组化法图片(100×)

图2 胎盘组织中SIRT3蛋白表达
2.2 两组产妇胎盘组织氧化应激因子水平 与对照组比较,eoPE组胎盘组织SOD和GSH-Px水平明显降低,MDA水平明显升高,差异均有统计学意义(P<0.05),见图3。

图3 各组胎盘组织氧化应激因子水平
2.3 过表达SIRT3对HTR-8/SVneo细胞迁移和侵袭的影响 SIRT3组细胞SIRT3 mRNA和蛋白相对表达量显著高于EMPTY组细胞(P<0.001),见图4。通过划痕实验与Matrigel侵袭实验,检测过表达SIRT3后HTR-8/SVneo细胞迁移和侵袭能力的改变。结果表明,与EMPTY组相比,SIRT3组 HTR-8/SVneo细胞的迁移和侵袭能力分别增加1.49倍和1.74倍,差异有统计学意义(P<0.05)。

图4 HTR-8/Svneo细胞过表达SIRT3表达效率验证
2.4 CoCl2对滋养细胞SIRT3表达的影响 加CoCl2处理HTR-8/SVneo细胞24h后,Western blot结果显示,滋养细胞中SIRT3表达随着CoCl2浓度增加逐渐下降,300μmol/L CoCl2处理24h的滋养细胞中SIRT3表达明显减少(P<0.05),见图5。

图5 Western blot法检测CoCl2处理24h后各组细胞中SIRT3表达水平*P<0.05 vs 0μmol/L CoCl2
2.5 CoCl2诱导滋养细胞氧化应激 HTR-8/SVneo细胞中加300μmol/L CoCl2处理24h。激光共聚焦显微镜观察发现,活性氧含量明显增加,见图6。检测氧化应激相关分子,发现CoCl2可明显地降低滋养细胞内SOD活性(P<0.05),提升MDA水平(P<0.05),而对GSH-Px活性并无明显影响(P>0.05)。见图7。

图6 激光共聚焦显微镜下观察HTR-8/SVneo细胞中活性氧含量

图7 CoCl2诱导HTR-8/SVneo细胞的氧化应激相关分子变化
2.6 过表达SIRT3抑制滋养细胞氧化应激 向过表达SIRT3的滋养细胞及EMPTY组中分别加300μmol/L CoCl2处理24h。激光共聚焦显微镜下观察发现过表达SIRT3可使HTR-8/SVneo细胞活性氧含量明显减少,见图8。过表达SIRT3明显增强HTR-8/SVneo细胞中SOD和GSH-Px水平,且能减少MDA生成(P<0.05),见图9。
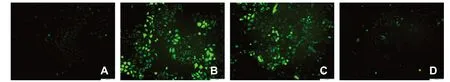
图8 激光共聚焦显微镜下观察HTR-8/SVneo细胞中活性氧含量
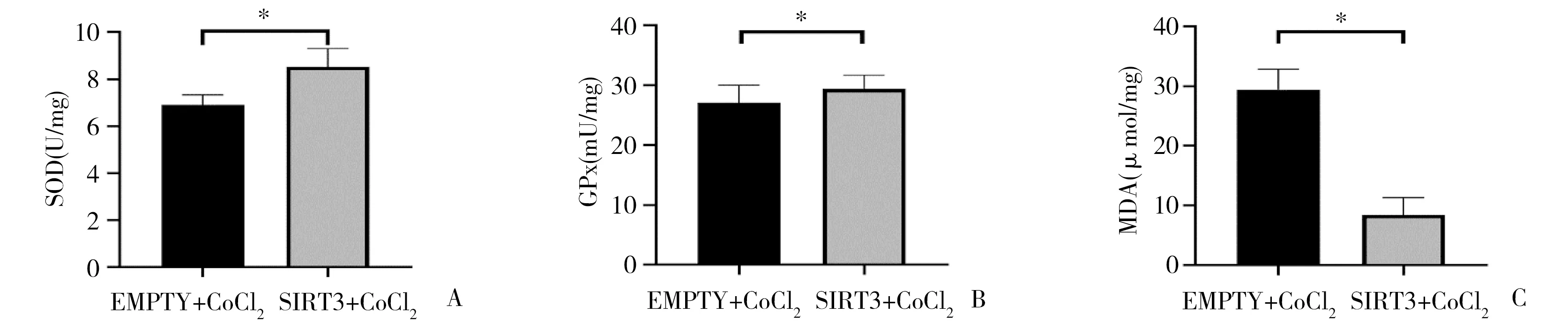
图9 过表达SIRT3显著缓解了CoCl2诱导的HTR-8/SVneo细胞氧化应激相关分子变化
2.7 SIRT3调节Akt信号通路蛋白表达 与EMPTY组相比,上调HTR-8/SVneo细胞中SIRT3蛋白表达后,SIRT3组细胞Akt(pan)、p-Akt(Thr308)、p-GSK-3β(Ser9)、PDK1及p-c-Raf(Ser259)蛋白表达明显增加,而p-PDK1(Ser241)蛋白表达明显下降(P<0.05),见图10。

图10 Western blot法检测Akt信号通路相关蛋白表达水平
目前PE的发病机制最为认可的是“两阶段”学说[9]。以34孕周为界,可将PE分为早发型和晚发型PE两种亚型。这两种亚型在病因、临床表现和预后上都存在着明显差异。普遍认为,早发型PE是一种胎盘源性疾病;
而晚发型PE患者常伴有代谢异常或心血管疾病,多被认为是为母源性疾病,因此二者需区分看待[2]。胎盘中线粒体含量丰富,负责补充胎盘组织所需ATP[10]。胎盘线粒体功能异常可造成ROS产生过多,氧化应激和细胞凋亡增加,修饰脂肪酸氧化以及导致线粒体损伤。这些改变引起血管内皮细胞损伤和影响子宫螺旋动脉收缩,引起胎盘功能障碍,造成PE尤其是eoPE发生。
SIRT3主要位于线粒体基质,可通过去乙酰化修饰多种线粒体蛋白,影响线粒体形态与功能,参与调节能量代谢、ROS清除、细胞内信号传导、侵袭及迁移等[11-12]。SIRT3蛋白主要表达于细胞滋养细胞、合体滋养细胞和间质绒毛外滋养细胞的细胞浆[5]。本研究Western blot结果显示,eoPE患者胎盘组织中SIRT3蛋白表达明显下降。eoPE组对应的对照组原则上应为年龄和孕周相匹配且无感染因素的早产孕妇,而这类孕妇早产的病因尚不清楚,临床病例数也较少,这也致使此研究存在一定限制。为了进一步验证SIRT3对滋养细胞生物学功能的影响,HTR-8/SVneo细胞转染质粒上调SIRT3表达,结果表明过表达SIRT3促进HTR-8/SVneo细胞迁移与侵袭。
氧化应激被定义为活性氧(ROS)或活性氮(RNS)的生成与细胞抗氧化能力间的不平衡[13]。健康孕妇血清中ROS含量较未妊娠时增加,这是由全身炎性反应引起的正常生理现象,与胚胎发育及妊娠维持等相关[14]。ROS含量增加,打破抗氧化防御系统的代偿平衡时,就会出现氧化应激。研究表明,eoPE患者胎盘组织中总氧化水平升高和抗氧化能力减弱,eoPE患者体内氧化应激与免疫耐受和免疫调节异常也存在关联[15]。本研究检测发现,eoPE胎盘组织中SOD和GSH-Px水平明显降低,MDA水平明显升高,这与文献报道一致[16-17]。SIRT3作为线粒体抗氧化应激中重要调控因子,通过显著提升抗氧化系统里各类酶活性,使得线粒体中的ROS清除率有效增加,发挥抗氧化应激的作用。如SIRT3可直接去乙酰化来激活抗氧化因子锰超氧化物歧化酶(MnSOD)和异柠檬酸脱氢酶2(IDH2)[18]。因此,用300μmol/L CoCl2处理HTR-8/SVneo细胞24h模拟胎盘氧化应激环境[19]。本研究发现,滋养细胞中SIRT3表达随着CoCl2浓度增加而减少,这与eoPE孕妇胎盘中SIRT3表达下调一致,表明滋养细胞氧化应激模型可行,也证明SIRT3与滋养细胞氧化应激状态有相关性。后续实验发现,过表达SIRT3的HTR-8/SVneo细胞活性氧含量明显减少,SOD和GSH-Px活性显著增强,MDA产生减少。这提示SIRT3在eoPE患者胎盘组织中表达减少可能通过调节滋养细胞功能,引起胎盘线粒体功能障碍,影响子宫螺旋动脉重构,从而导致eoPE发生。
Akt信号通路在PE发生发展中发挥了重要作用,与滋养细胞的侵袭、迁移和氧化应激等密切相关[20]。研究报道,在非小细胞肺癌细胞系中,SIRT3能与Akt免疫共沉淀并与Akt共定位,这表明SIRT3通过转录后修饰促进Akt通路的激活[21]。此外,SIRT3过表达通过抑制ROS积累和激活Akt/FoxO信号通路来拮抗高糖诱导的HK-2细胞凋亡[22]。因此,推测SIRT3可能通过Akt信号通路调控滋养细胞功能。本研究结果显示,过表达SIRT3滋养细胞中Akt和p-Akt(Thr308)蛋白表达明显增加,且p-GSK3β(Ser9)和p-c-Raf表达增加,而p-PDK1蛋白表达减少。PDK1对Akt的磷酸化是激活Akt的重要机制,PDK1/Akt通路的激活可影响各项细胞活动,如促进细胞增殖、侵袭转移[23]。过表达SIRT3滋养细胞中p-PDK1/PDK1下调,似乎不能解释p-Akt(Thr308)升高。但表明SIRT3可能分别对PDK1和Akt直接调节,这可能是其复杂功能的基础。后续还需在滋养细胞氧化应激模型上,使用Akt信号通路的激动剂和抑制剂进一步验证。
综上所述,SIRT3可能通过调控Akt信号通路上关键蛋白的表达,促进滋养细胞侵袭迁移,缓解滋养细胞氧化应激,其表达失调参与eoPE的发生和发展。今后将从细胞实验水平和动物模型整体水平深入探究滋养细胞中SIRT3的表达调控机制,以期为eoPE防治提供新的方向和理论基础。
猜你喜欢单抗免疫组化线粒体FOLFOXIRI联合贝伐单抗±阿替利珠单抗治疗转移性结直肠癌实用肿瘤学杂志(2022年3期)2022-11-30棘皮动物线粒体基因组研究进展海洋通报(2021年1期)2021-07-23线粒体自噬与帕金森病的研究进展生物学通报(2021年4期)2021-03-16司库奇尤单抗注射液皮肤性病诊疗学杂志(2020年4期)2020-09-02夏枯草水提液对实验性自身免疫性甲状腺炎的治疗作用及机制研究浙江医学(2020年9期)2020-07-01婴幼儿原始黏液样间叶性肿瘤一例及文献复习浙江中西医结合杂志(2019年4期)2019-05-05结直肠癌组织中SOX9与RUNX1表达及其临床意义浙江医学(2019年2期)2019-01-23使用抗CD41单抗制备ITP小鼠的研究中国卫生标准管理(2015年16期)2016-01-20子宫瘢痕妊娠的病理免疫组化特点分析中国继续医学教育(2015年1期)2016-01-06NF-κB介导线粒体依赖的神经细胞凋亡途径癌变·畸变·突变(2014年1期)2014-03-01








