大叶种茶酯型儿茶素含量测定及其亚细胞定位研究
时间:2023-06-15 13:20:18 来源:雅意学习网 本文已影响 人 
王冬雪,满佳旭,武思敏,高梓琪,罗桂琴,张冬英
(云南农业大学,云南 昆明 650201)
云南是我国茶叶的发源地、原产地,拥有丰富的茶叶资源以及大叶茶种资源,经过数十年的调查和采集,已经形成了世界上最大的全国大叶茶种质资源基地[1]。云南大叶种茶树最显著的特征是“叶大,芽肥,多毫,梗嫩”[2]。目前,以大叶种茶为试样的研究多集中于茶多酚、咖啡碱等含量的分析和测定上,对于酯型儿茶素的研究则多集中于生物合成、水解和含量分析等,其亚细胞水平的研究文献相对较少[3-9]。因此,准确定位茶树中酯型儿茶素的亚细胞对于研究酯型儿茶素的生物合成途径、生理功能是十分必要的。由于普通的组织化学定位染色试剂不能特异性地识别酯型儿茶素,所以茶树中酯型儿茶素的亚细胞定位一直存在争议。免疫组织化学染色法是利用抗原与特异性抗体结合的原理,通过化学反应使带有荧光素、酶、金属离子、同位素等标记的特异性抗体结合,来确定组织细胞内抗原的一种研究方法。就大叶种茶的酯型儿茶素定位而言,该方法相较于其他方法更可靠[10-16]。
本试验通过高效液相色谱法(HPLC)对5种大叶种茶进行酯型儿茶素含量测定;
探究了不同固定时间对茶叶中酯型儿茶素亚细胞定位的影响;
观察了不同染色法对茶叶组织的细胞结构、形态的处理效果;
应用免疫组织化学染色法对茶树中酯型儿茶素进行了亚细胞定位研究,以期明确酯型儿茶素的亚细胞定位,为大叶种茶资源的开发利用研究提供数据支撑。
1.1 试验材料
选取云瑰、紫鹃、长叶白毫、云梅、短节白毫茶样的1芽1~2叶,均来源于云南普洱茶树良种场。
1.2 试剂
中性红购于上海源叶生物科技有限公司;
OCT包埋剂、ABC试剂盒、苏木素均购于美国;
多聚甲醛购于天津市科密欧化学试剂有限公司;
中性树胶购于中国上海标本模型厂;
DAB试剂盒购于天根生化科技有限公司;
PBS购于北京索莱宝科技有限公司;
三氟乙酸购于德国MERCK;
氯化钙购于西陇化工股份有限公司;
酯型儿茶素抗体,由本实验室自制。
1.3 仪器
高效液相色谱仪,由安捷伦有限公司生产;
电热恒温培养箱,由上海—恒科学仪器有限公司生产;
冷冻切片机、荧光显微镜,均由Leica有限公司生产;
烘片仪,由HESTION有限公司生产;
低速离心机,由中佳有限公司生产;
超声波清洗机,由上海科导超声仪器有限公司生产;
漩涡混合器,由上海凡劲仪器设备有限公司生产;
4 ℃、-80 ℃冰箱,由海尔特种设备有限公司生产。
2.1 HPLC法测定茶树中酯型儿茶素含量
将茶叶用清水冲洗,擦干后用液氮研磨至茶粉状;
取茶粉0.2 g放入10 mL的离心管中,加入5 mL 70%甲醇水溶液(70 ℃水浴锅预热),震荡均匀后,立即放入70 ℃的水浴锅,浸提10 min,冷却至室温,重复3次,离心10 min,转速为3500 r/min,取上清液至10 mL的容量瓶中。重复上述步骤再次提取剩余物。将2次的萃取液混合到10 mL容量瓶摇匀,用0.45 μm有机相滤膜过滤。取2 mL上清液至另一个10 mL的容量瓶,用稳定溶液定容至刻度,摇匀,用0.45 μm的有机相滤膜过滤,待用。高效液相色谱条件参见文献[16]。
2.2 不同染色法对茶叶组织的细胞结构、形态的处理效果
新鲜茶样切片:将新鲜幼嫩茶叶固定于福尔马林中24 h后,用UP水清洗3次,使用刀片将茶芽横切,使用OCT包埋剂进行包埋。将包埋好的样品置于-80 ℃冰箱中冷冻定型,定型后使用冷冻切片机将茶样沿横截面切成5~10 μm的薄片,并黏附于载玻片上,然后将载玻片置于37 ℃烘箱中烘干30 min,然后,置于流水轻轻冲洗15 min,除去多余的包埋剂。显微镜观察,拍照。
中性红染色法:取新鲜的茶树芽样品于福尔马林中固定24 h,用刀片切至5 mm长的小段,用OCT包埋剂包埋,放在-80 ℃冰箱中冰冻,然后用冷冻切片机快速切片、展片。用蒸馏水冲洗,随后用0.5%中性红溶液染色,再用自来水缓慢冲洗20 min,显微镜观察,拍照。
苏木素染色法:取新鲜的茶树芽样品于福尔马林中固定24 h后,用手术刀片切至5 mm长的小段,用OCT包埋剂包埋,放在-80 ℃冰箱中冰冻,用冷冻切片机快速切片、展片。用蒸馏水水洗,随后用苏木素染料染色,再用自来水缓慢洗涤,显微镜观察,拍照。
2.3 不同固定时间对茶叶中酯型儿茶素亚细胞定位的影响
为了探究不同固定时间对酯型儿茶素亚细胞定位效果的影响,取新鲜的茶树嫩芽芽样,分成10份分别放入50 mL离心管中,分别固定1、3、5、7、11、15、20、28、35、42 d后,包埋冷冻切片,进行免疫组织化学染色,显微镜下观察,拍照。
2.4 酯型儿茶素亚细胞的定位
应用本实验室自制的酯型儿茶素抗体进行染色。具体步骤:取新鲜幼嫩茶叶于福尔马林中固定24 h,将固定好的茶叶置于UP水中清洗3次。用刀片切至5 mm长的小段,用OCT包埋剂包埋,在-80 ℃冰箱中冷冻定型;
再用冷冻切片机快速切成5~10 μm的薄片,展片。将载玻片置于37 ℃烘箱中烘干30 min。用免疫组化笔划定抗体铺放区域[16],用4% PFA在室温下固定1 min,用PBS洗3次/2 min。用0.5% PBT在室温下处理1 min,加过氧化物酶阻断剂B,在37 ℃孵育箱中孵育20 min,再用PBS洗5 min。随后用封闭血清封闭,在37 ℃孵育箱中孵育30 min,倾去血清,铺一抗置于4 ℃冰箱中过夜,次日回收一抗,用PBS洗5 min。铺生物素标记的二抗在37 ℃孵育箱中孵育30 min;
用PBS洗5 min,加ABC试剂在37 ℃孵育箱中孵育30 min;
用PBS洗5 min,加过氧化物酶底物(DAB)室温避光孵育15 min,用流水缓慢冲洗5 min,苏木素染色,流水缓慢冲洗15 min后,中性树胶封片,烘片仪上烘干,显微镜观察,拍照[17]。
2.5 数据处理
利用Excel 2010软件对数据进行统计和整理,采用GraphPad Prism 8软件进行聚类分析和方差分析。
3.1 大叶种茶树中酯型儿茶素含量的测定结果
酯型儿茶素主要由EGCG和ECG组成,是茶叶中主要的功能性成分,对茶树的生长发育具有极其重要的作用。通过HPLC法测定,茶树中酯型儿茶素的含量见表1。由表1可知,EGCG的含量大小依次为紫鹃(19.7%)>云瑰(19.2%)>长叶白毫(13.1%)>短节白毫(10.4%)>云梅(6.4%)。ECG的含量大小依次为云瑰(28.5%)>紫鹃(6.1%)>长叶白毫(5.1%)>云梅(0.8%)>短节白毫(0)。酯型儿茶素含量:云瑰最高,为47.7%;
紫鹃、长叶白毫、云梅、短节白毫的酯型儿茶素含量分别为19.8%、18.2%、12.3%、11.2%。
3.2 不同染色法对茶叶组织的细胞结构、形态的处理效果
在本研究中,以核特异性染料苏木精染色后可以观察细胞核的大小、形态,中性红染色后可以观察细胞的液泡大小、形态(图1)。从图1A中可知,中间海绵组织、栅栏组织中含大量深紫色的粒子,为细胞核。图1B中,暗红色圆形小泡是液泡,大量液泡呈现暗红色,轮廓清晰,染色效果良好。液泡周围散布着许多小的椭圆形和不规则的叶绿体。图1C为图1B放大后,在10×100倍油镜下观察的效果图,可以更清晰地观察到中性红染色后的液泡形态,同时也可以与叶绿体形态进行对比和鉴别。图1D为新鲜叶片未进行染色,直接在10×100倍油镜下观察的液泡与叶绿体形态,为后期酯型儿茶素的亚细胞定位研究提供了细胞形态辨别的基础。
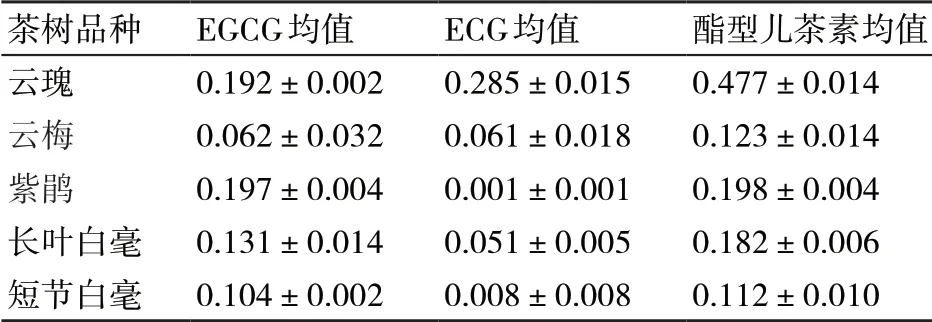
表1 各品种鲜茶叶的酯型儿茶素含量 g/100 g

图1 不同染色法对茶叶组织的细胞结构、形态的处理效果
3.3 不同固定时间对茶叶中酯型儿茶素亚细胞定位的影响
从组织学角度分析,固定可以维持细胞和组织固有的形态结构,从而减少内源或外源性酶之间的反应,防止细胞自溶、抗原扩散,保持组织的抗原性,避免免疫组化染色时背景颜色过深而影响免疫组化的最终效果和判断。故不同固定时间对酯型儿茶素亚细胞定位会产生不同的影响,可以对其保存时间进行筛选,以确认茶叶的保存期限,即可以避免实验只能短期内进行的困扰,延长实验周期。
不同固定时间酯型儿茶素染色效果见图2。结合前期课题组的实验结果,从图2可以看出,茶叶切片中分布较多的黄绿色、椭圆形的部分是液泡,在不同固定时间下,液泡形态和抗体结合的效果都保持较好,无明显差异。将固定时间延长至42 d,茶叶组织状态无明显差异,免疫组织化学染色法染色后抗体结合效果依旧良好,表明茶叶的固定时间至少为42 d,且对茶叶中酯型儿茶素亚细胞定位无影响。

图2 不同固定时间对茶叶中酯型儿茶素的染色效果
3.4 酯型儿茶素在亚细胞中的定位
研究表明,酯型儿茶素可以在植物细胞的众多部位积累,如光滑内质网、粗糙内质网、叶绿体、高尔基体、液泡、细胞壁甚至细胞核内都有多酚类物质的积累,但目前认为酯型儿茶素主要积累于叶绿体和液泡中,但茶树中酯型儿茶素的亚细胞定位究竟是在叶绿体还是在液泡中则一直存在着争议[16]。本文选取云南种云瑰(A)、云梅(B)、紫鹃(C)、长叶白毫(D)、短节白毫(E)5种大叶种的茶芽切片进行免疫组织化学染色。结果如图3所示,在10×100倍油镜下观察,5种茶样内部剖面略有差别,在茶树芽组织中,酯型儿茶素抗体结合部位均呈椭圆状,与3.2中的中性红染色后液泡结合位置一致;
而叶绿体未着色,可以确定在亚细胞水平上,5种茶样的酯型儿茶素在亚细胞水平上定位于液泡中。

图3 茶芽中酯型儿茶素的亚细胞定位结果
酯型儿茶素作为儿茶素的重要组成成分,是茶饮料的抗氧化、抗菌、抗病毒和抗动脉硬化等保健功效的主要成分。酯型儿茶素不能人工合成,茶叶是其唯一来源,茶树中酯型儿茶素的生物合成途径及其亚细胞定位研究也一直备受茶业界的关注。免疫组织化学法被广泛应用于生物化学研究中,能定位细胞或组织中小分子物质的特定表位。就茶树中酯型儿茶素的亚细胞定位而言,免疫组织化学染色法非常适用于酯型儿茶素这种小分子的定位。徐欢欢[16]对大叶种云抗十号茶树芽样品进行了亚细胞定位研究,发现酯型儿茶素在亚细胞水平上在液泡中累积。本文在此基础上选取了5种大叶种茶树进行进一步实验验证,通过HPLC分析,确定了茶树中酯型儿茶素的含量,并探究了不同固定时间对于酯型儿茶素的影响,将固定时间延长至42 d,细胞状态保持较好,染色效果无差异,表明茶叶的固定时间至少为42 d,且对茶叶中酯型儿茶素亚细胞定位无影响。采用不同染色法对茶叶组织中的细胞结构、形态处理的效果进行观察,所获结果为后期酯型儿茶素亚细胞定位研究奠定了基础。应用免疫组织化学染色法对茶样中酯型儿茶素进行亚细胞定位,根据植物学组织形态进行判断,抗体结合位置与液泡位置重合度较高,说明茶树中酯型儿茶素在亚细胞水平上主要定位于液泡中,这为酯型儿茶素的合成、运输、储存和生理作用的研究奠定了理论基础,同时为大叶种茶叶的选育、品质改善等提供了较好的参考依据[18-20]。
猜你喜欢 液泡染色法儿茶素 女性下生殖道分泌物检测中革兰氏染色法的应用分析中国典型病例大全(2022年12期)2022-05-13抗酸染色法、细菌培养法和实时荧光PCR法在分枝杆菌检查中的应用比较中国典型病例大全(2022年7期)2022-04-22超高效液相色谱法测定茶叶中的儿茶素食品安全导刊(2021年20期)2021-08-30植物液泡膜H+-ATPase和H+-PPase 研究进展中国农业科技导报(2020年1期)2020-03-15白念珠菌液泡的致病性作用中国真菌学杂志(2019年1期)2019-01-23表没食子儿茶素没食子酸酯对顺铂诱导大鼠肾损伤的改善作用中成药(2017年7期)2017-11-22一测多评法测定心脑健胶囊(片)中6种儿茶素中成药(2017年3期)2017-05-17PCR技术、抗酸染色法在肺结核病理学诊断中应用比较中外医疗(2016年15期)2016-12-01烟草合子时期特异表达基因的克隆与分析江苏农业科学(2016年5期)2016-07-23改良抗酸染色法在结核性浆膜炎临床诊断中的价值医学研究杂志(2015年8期)2015-06-22







