压力诱导兔视网膜干细胞向视网膜神经节细胞分化研究
时间:2023-06-09 08:15:29 来源:雅意学习网 本文已影响 人 
戴敏 亢泽峰 胡竹林 李妍
1云南大学附属医院眼科 云南省眼科医院 云南省眼科研究所 云南省眼科疾病防治研究重点实验室 云南省第二人民医院白内障与眼底疾病防治省创新团队 云南省姚克专家工作站 云南省眼部疾病临床医学研究中心 云南省眼科疾病临床医学中心,昆明 650021;
2中国中医科学院眼科医院,北京 100040
青光眼是世界上主要的致盲眼病,可导致视盘凹陷性萎缩和视野缺损,研究表明病理性眼压升高是其主要危险因素[1]。青光眼可引起视网膜神经节细胞(retinal ganglion cells,RGCs)凋亡,导致视功能不可逆损害。RGCs的病理改变和凋亡机制在青光眼的发病过程中发挥着重要作用,RGCs的丢失率可以更好地评估青光眼进展[2]。如果能够找到有效的方法保护RGCs或促进其再生,对于青光眼的治疗具有重要意义。既往认为,成年哺乳动物视网膜损伤后无再生和修复能力。近来研究发现,成年哺乳动物眼中存在未分化的视网膜干细胞(retinal stem cells,RSCs)。Ahmad等[3]首先从成年E17大鼠的视网膜中分离出RSCs,其显示出许多神经干细胞的特征:(1)可以增生,并表达神经外胚层标志物巢蛋白(Nestin)及视网膜细胞胚胎发育阶段的特异性标志物Chx-10;
(2)具有多能性;
(3)可以自我更新[3-5]。这些干细胞可以在一定条件下被激活和分化,修复受损的视网膜神经元[6]。然而,RSCs的定向诱导分化机制十分复杂,主要受细胞外微环境因素和内在细胞因子的共同调控。本课题组既往研究发现,SD大鼠RGCs的条件培养基增加了大鼠RSCs向视网膜神经节样细胞的分化,并且在一定压力范围内分化程度随着周围压力的升高而增加[7]。为了进一步揭示压力对与RGCs共培养的RSCs分化的影响,本研究拟探讨在压力升高的情况下,RSCs与RGCs共培养是否能够促进RSCs分化为神经节样细胞。
1.1 材料
1.1.1实验动物 选取SPF级新生新西兰大白兔及孕22 d兔6~8只[昆明医科大学实验动物中心提供,许可证号:SYXK(滇)K2015-0002]。实验动物的饲养和使用符合国家科学技术委员会颁布的《实验动物管理条例》。本研究经云南大学附属医院实验动物伦理委员会审核批准(批文号:KPRC-IACUC17008)。
1.1.2主要试剂及仪器 胎牛血清(fetal bovine serum,FBS)、DMEM/F12(含B27、N2、肝素、谷氨酰胺)、质量分数0.25%胰蛋白酶(美国Gibco公司);
上皮生长因子(epithelial growth factor,EGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)(美国Sigma公司);
免疫荧光试剂盒(上海碧云天生物技术有限公司);
溴脱氧核苷尿嘧啶(bromodeoxyuridine,BrdU)细胞增生检测试剂盒(南京凯基生物科技发展有限公司);
RNA提取试剂盒、RT-qPCR试剂盒(日本TaKaRa公司);
Transwell培养皿(美国Corning公司);
小鼠抗Nestin抗体(sc-23927)、小鼠抗Brn3b抗体(sc-514474)、小鼠抗Thy1.1抗体(sc-19614)、小鼠抗GS抗体(sc-74430)、小鼠抗GAPDH抗体(sc-47724)(美国Santa Cruz公司);
iFluor 488标记羊抗小鼠二抗(16735,美国AAT Bioquest公司);
羊抗小鼠二抗(ab6789,英国Abcam公司)。解剖显微镜(S9)、荧光显微镜(Mica,德国Leica公司);
离心机(LC-LX-HLR250D,上海力辰仪器科技有限公司);
血压计(江苏鱼跃医疗设备及用品有限公司);
CO2培养箱、PCR仪(Step One Plus)(美国Thermo Fisher公司)。
1.2 方法
1.2.1兔RSCs和RGCs的培养及鉴定
1.2.1.1兔RSCs的培养 取孕龄22 d新西兰大白兔,耳缘静脉注入空气处死,取出胚胎6~8只。在解剖显微镜下取出视网膜睫状缘色素上皮组织,用剪刀剪成糜状,加入质量分数0.1%胰蛋白酶37 ℃消化10 min,终止消化,加入0.01 g/L DNA酶,反复轻轻吹打制成单细胞悬液,离心半径21 cm,1 500 r/min离心5 min,弃上清,用含EGF和bFGF的DMEM/F12培养基重悬沉淀,过200 μm筛网,接种于25 cm2细胞培养瓶,置于37 ℃、体积分数5% CO2培养箱中培养,之后每3天半量换液,每5~7天传代1次,传至第3~4代,进行后续实验。
1.2.1.2免疫荧光法及流式细胞术鉴定兔RSCs (1)Nestin免疫荧光染色鉴定 采用Nestin抗体(1∶ 200)检测培养的RSCs,按免疫荧光试剂盒说明书进行免疫荧光染色鉴定,Nestin呈绿色荧光,细胞核均采用DAPI染色,呈蓝色;
(2)BrdU流式细胞术分析 参照BrdU细胞增生检测试剂盒使用说明书,在兔RSCs的培养体系中加入BrdU至终浓度为50 μmol/L,孵育24 h。对细胞进行固定、通透和DNA变性处理后,加入FITC-BrdU抗体5 μl(0.125 μg)进行标记,4 ℃条件下避光孵育30 min,采用流式细胞仪检测;
(3)RSCs自发分化细胞免疫荧光检测及流式细胞术分析 将正常培养的兔RSCs放入多聚赖氨酸包被的培养板中,并换为含体积分数1% B27和1% N2的DMEM/F12分化培养基,每3天换液1次。分化10 d,获取并重悬细胞;
按免疫荧光试剂盒说明书进行操作,采用Brn3b抗体(1∶ 200)和GS抗体(1∶ 200)检测分化所得细胞,荧光显微镜下观察。分别采用红色及绿色荧光的二抗对分化细胞进行免疫荧光染色,采用流式细胞术双色分析检测Brn3b阳性细胞及GS阳性细胞在分化细胞中所占的比例。
1.2.1.3兔RGCs的原代培养及免疫荧光染色法鉴定 取出生1~2 d的新西兰大白兔6只,颈椎脱臼法处死。无菌条件下取出眼球,漂洗3次。在显微镜下分离出视网膜神经上皮层组织。漂洗3次,置于0.5 g/L胰蛋白酶中,37 ℃消化30 min,加入含体积分数10% FBS的DMEM终止消化。40 μm滤网过滤。离心半径21 cm,1 500 r/min室温离心5 min,弃上清,加入DMEM完全培养基。调整细胞密度后,接种至细胞培养瓶中。置于37 ℃、5% CO2培养箱中培养7~10 d。获取细胞,采用Brn3b抗体(1∶ 200)及Thy1.1抗体(1∶ 200)进行免疫荧光染色鉴定,Brn3b阳性表现为细胞核内出现绿色荧光,Thy1.1阳性表现为细胞核及细胞质内出现绿色荧光。
1.2.2RSCs与RGCs在不同压力下共培养 RSCs与RGCs置于Transwell培养皿上下层构建共培养体系进行培养,接种1×105个RGC至上室培养皿中,5×105个RSCs至下室培养皿中。用剪刀将装有500 ml生理盐水的袋子底部剪开,倒出生理盐水。将培养皿放入空袋中,并使用塑料信封机将底部密封。利用血压计将空气泵入袋中,并使用该仪器测量压力。使用该方法在37 ℃、CO2培养箱中以不同压力(0、20、40、60、80 mmHg)(1 mmHg=0.133 kPa)处理细胞48 h。
1.2.3实时荧光定量PCR法检测不同压力下实验兔RSCs及分化所得细胞Nestin和Thy1.1的表达 采用Trizol提取液提取各组细胞总RNA,按逆转录试剂盒说明将0.5 μg总RNA逆转录为cDNA,反应条件为42 ℃水浴60 min,70 ℃加热10 min。将获得的cDNA模板与实时荧光定量PCR引物进行扩增。引物设计见表1,引物由上海生工生物有限公司提供。PCR反应条件:95 ℃预变性2 min;
95 ℃变性15 s,58 ℃退火15 s,72 ℃延伸40 s,以上3步循环42次。PCR在CFX96 TouchTMreal-time PCR检测系统中完成。以GAPDH为内参,检测各基因的相对表达量。实验重复3次,结果取平均值。

表1 引物序列Figure 1 Primer sequences引物引物序列(5"-3")扩增片段长度(bp)NestinThy1.1GAPDH正向:AAGATGGAGAAACGGT-GACG反向:TCCTGGTTCTCCTTTTGT-GG正向:CATGAGAACAC-CACGAGCGT反向:GTACCTGCTGGTGAAGT-TGGT正向:TGGTGAAGGTCGGAGT-GAAC反向:TGCCGTGGGTGGAAT-CATAC208156135 注:Nestin:巢蛋白;Thy:胸腺嘧啶;GAPDH:甘油醛-3-磷酸脱氢酶 Note:Thy:thymine;GAPDH:glyceraldehyde-3-phosphate dehydro-genase
1.2.4Western blot法检测不同压力下实验兔RSCs及分化所得细胞Nestin及Thy1.1的表达 加入蛋白抽提裂解液充分裂解各组细胞,进行物理超声后,采用BCA法蛋白定量试剂盒进行蛋白定量。并采用1倍磷酸盐缓冲液将蛋白浓缩至5 μg/μl。以40 μg总蛋白/孔上样,用10%SDS-PAGE凝胶电泳,将蛋白转移至PVDF膜。室温封闭2 h,一抗1∶ 500稀释,4 ℃孵育过夜。内参GAPDH抗体1∶ 1 000稀释。HRP标记的二抗1∶ 2 000稀释,室温下孵育2 h。清洗膜后,将其暴露在暗室中并显影。采用ImageJ软件分析各条带灰度值,目的蛋白相对蛋白表达量=目的蛋白灰度值/GAPDH灰度值。实验重复3次。
1.3 统计学方法
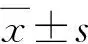
2.1 兔RSCs的培养及鉴定
2.1.1Nestin免疫荧光染色鉴定 分离的兔RSCs聚集成细胞球形态,细胞球内大部分细胞均显示RSCs特异性标志物Nestin阳性(图1)。

图1 Nestin抗体免疫荧光染色鉴定兔RSCs A:光学显微镜下可见分离的兔RSCs聚集成细胞球形态,悬浮于培养基中(×200,标尺=200 μm)B:免疫荧光染色鉴定显示,细胞球内大部分细胞均显示Nestin阳性,呈绿色荧光,细胞核均呈DAPI蓝染(FITC ×200,标尺=200 μm) Nestin:巢蛋白;
DAPI:二脒基苯基吲哚Figure 1 Immunofluorescence staining of nestin antibody to identify rabbit RSCs A:The isolated rabbit RSCs aggregated into cell spheres and suspended in the medium (×200,bar=200 μm) B:Most cells in the cell spheres were nestin-positive and presented green.The nuclei stained with DAPI showed blue (FITC ×200,bar=200 μm) DAPI:diamidine phenylindole
2.1.2兔RSCs增生细胞数 流式细胞术分析结果显示,BrdU阳性细胞占分离的RSCs细胞的(92.26±3.28)%(图2)。

图2 BrdU流式细胞术分析检测实验兔RSCs增生细胞数 BrdU阳性细胞率为(92.26±3.28)% A:培养体系中加入BrdU B:培养体系中未加入BrdU FITC:异硫氰酸荧光素;
BrdU:溴脱氧核苷尿嘧啶Figure 2 Proliferation of cultured rabbit RSCs detected by BrdU cell proliferation assay kit The percentage of BrdU-positive RSCs was (92.26±3.28)% A:Rabbit RSCs cultured with BrdU B:Rabbit RSCs cultured without BrdU FITC:fluorescein isothiocyanate;
BrdU:bromodeoxyuridine
2.1.3RSCs自发分化所得细胞免疫荧光检测及流式细胞术分析 免疫荧光检测结果显示,RSCs分化细胞中,部分细胞Brn3b抗体表达阳性,部分细胞GS抗体表达阳性,均呈绿色荧光。流式细胞术双色分析结果显示,Brn3b阳性细胞率为(13.00±3.06)%,GS阳性细胞率为(31.60±3.67)%(图3)。

图3 RSCs自发分化细胞免疫荧光检测及流式细胞术分析 A:部分细胞Brn3b抗体表达阳性,呈绿色荧光(FITC ×200,标尺=100 μm) B:部分细胞GS抗体表达阳性,呈绿色荧光(FITC ×200,标尺=100 μm) C:流式细胞术双色分析显示,Brn3b阳性细胞率为(13.00±3.06)%,GS阳性细胞率为(31.60±3.67)% DAPI:二脒基苯基吲哚Figure 3 Immunofluorescence staining and flow cytometry of spontaneously differentiated rabbit RSCs A:Some cells were Brn3b-positive and showed green fluorescence (FITC ×200,bar=200 μm) B:Some cells were GS-positive and presented green fluorescence (FITC ×200,bar=200 μm) C:Two-color flow cytometry analysis showed that the proportion of Brn3b-positive cells was (13.00±3.06)%,and the proportion of GS-positive cells was (31.60±3.67)% in the differentiated cells DAPI:diamidine phenylindole
2.2 RGCs的培养及鉴定
原代分离的兔RGCs可见多个树突状突起。大部分培养的细胞Brn-3b及Thy1.1抗体染色阳性(图4)。

图4 RGCs的培养及鉴定(FITC ×200,标尺=100 μm) 体外培养的兔RGCs可见多个树突状突起,大部分培养的细胞Brn3b抗体(细胞核内出现绿色荧光)和Thy1.1抗体(细胞核及细胞质内出现绿色荧光)染色阳性 Thy:胸腺嘧啶Figure 4 Culture and identification of RGCs (FITC ×200,bar=200 μm) Multiple dendritic protrusions could be seen in rabbit RGCs cultured in vitro,and most cells were Brn3b-positive showing green fluorescence in the nucleus,and the Thy1.1-positive showing green fluorescence in the nucleus and cytoplasm Thy:thymine
2.3 不同压力条件RSCs及分化所得细胞Nestin和Thy1.1 mRNA相对表达量比较
不同压力条件下室RSCs及分化所得细胞的Nestin和Thy1.1 mRNA相对表达量总体比较差异均有统计学意义(F=127.600,P=0.005;
F=137.400,P<0.001),其中与0 mmHg组相比,20、40、60、80 mmHg条件下Nestin mRNA相对表达量降低,Thy1.1 mRNA相对表达量升高,差异均有统计学意义(均P<0.05)。40 mmHg时,Nestin mRNA相对表达量最低,Thy1.1 mRNA相对表达量最高(表2)。

表2 不同压力条件RSCs及分化所得细胞Nestin和Thy1.1 mRNA相对表达量比较(x±s)Table 2 Comparison of relative expressions of nestin andThy1.1 mRNA in RSCs and differentiated cells amongdifferent pressures (x±s)压力(mmHg)样本量Nestin mRNA相对表达量Thy1.1 mRNA相对表达量0 31.003±0.0551.003±0.0852030.490±0.035a3.833±0.280a4030.257±0.015a5.330±0.455a6030.550±0.026a2.277±0.211a8030.650±0.066a1.360±0.135aF值127.600137.400P值0.005<0.001 注:与0 mmHg相比,aP<0.05(单因素方差分析,LSD-t检验) RSCs:视网膜干细胞;Nestin:巢蛋白;Thy:胸腺嘧啶 1 mmHg=0.133 kPa Note:Compared with 0 mmHg,aP<0.05 (One-way ANOVA,LSD-t test) RSCs:retinal stem cells;Thy:thymine 1 mmHg=0.133 kPa
2.4 不同压力条件RSCs及分化所得细胞Nestin和Thy1.1蛋白相对表达量比较
随压力升高,Nestin蛋白表达条带减弱,40 mmHg时最弱,Thy1.1蛋白表达条带增强,40 mmHg时最强(图5)。不同压力条件下室RSCs及分化所得细胞Nestin和Thy1.1蛋白相对表达量总体比较差异均有统计学意义(F=82.480、158.700,均P<0.001),其中与0 mmHg相比,20、40、60、80 mmHg条件下Nestin蛋白相对表达量降低,Thy1.1蛋白相对表达量升高,差异均有统计学意义(均P<0.05)。40 mmHg时,Nestin蛋白相对表达量最低,Thy1.1蛋白相对表达量最高(表3)。

图5 不同压力条件RSCs及分化所得细胞Nestin和Thy1.1蛋白表达电泳图 随压力升高,Nestin蛋白表达条带减弱,40 mmHg时最弱,Thy1.1蛋白表达条带增强,40 mmHg时最强 Nestin:巢蛋白;
Thy:胸腺嘧啶;
GAPDH:甘油醛-3-磷酸脱氢酶 1 mmHg=0.133 kPaFigure 5 Expression of nestin and Thy1.1 proteins in RSCs and differentiated cells under different pressures detected by Western blot As the pressure increased,the nestin protein bands were weakened,and the Thy1.1 protein bands were strengthened.When the pressure was 40 mmHg,the nestin protein band was the weakest,and the Thy1.1 protein band was the strongest Thy:thymine;GAPDH:glyceraldehyde-3-phosphate dehydrogenase 1 mmHg=0.133 kPa

表3 不同压力条件RSCs及分化所得细胞Nestin和Thy1.1蛋白相对表达量比较(x±s)Table 3 Comparison of relative expression of nestin andThy1.1 proteins in RSCs and differentiated cells amongdifferent pressures (x±s)压力(mmHg)样本量Nestin蛋白相对表达量Thy1.1蛋白相对表达量031.020±0.0850.420±0.0502030.580±0.030a0.807±0.038a4030.293±0.052a1.303±0.087a6030.450±0.035a0.828±0.074a8030.653±0.099a0.672±0.111aF值82.480158.700P值<0.001<0.001 注:与0 mmHg相比,aP<0.05(单因素方差分析,LSD-t检验) RSCs:视网膜干细胞;Nestin:巢蛋白;Thy:胸腺嘧啶 1 mmHg=0.133 kPa Note:Compared with 0 mmHg,aP<0.05 (One-way ANOVA,LSD-t test)RSCs:retinal stem cells;Thy:thymine 1 mmHg=0.133 kPa
近年来,干细胞成为神经节细胞再生研究的一种新趋势[8-10]。根据移植细胞的来源不同分为2种:(1)眼组织干细胞,包括视网膜神经干细胞、视网膜Müller细胞去分化的前体细胞;
(2)非眼组织干细胞,包括胚胎干细胞、骨髓间充质干细胞、脑源性神经干细胞,及近年展开研究的脂肪干细胞[11-13]。1998年,Reh等[14]提出哺乳动物睫状体色素上皮中可能存在RSCs,多年来,RSCs已成为细胞移植治疗视网膜病变的研究重点。RSCs是具有自我更新能力和多方向分化潜能的神经干细胞,其可分化为多种视网膜细胞,表达神经细胞和神经胶质细胞特异性标志物[15]。本研究从孕龄22 d的孕兔胚胎中分离了RSCs进行原代培养,分离的兔RSCs聚集成细胞球形态,可以传代多次,传代后对新细胞球进行鉴定,仍然表达Nestin,表明这些细胞具有神经干细胞特性。采用BrdU流式细胞术分析检测发现,培养的兔RSCs在体外具有良好的增生能力,同时进行自发分化鉴定,发现部分兔RSCs分化为神经节样细胞和神经胶质细胞,表明本研究成功分离得到兔RSCs。
既往研究表明,视网膜损伤可能会刺激RSCs自我修复的潜力[16-17]。有研究发现,干细胞抗原可在人胚胎的视网膜部分表达10~13周,并且可以在体外分化为视网膜细胞[18]。Aoki等[19]已将RSCs应用于视网膜损伤的治疗。Huang等[20]从胚胎大鼠分离出RSCs,移植到视神经损伤大鼠左眼视网膜下腔后,植入的细胞可以迁移并整合到视网膜中,甚至可以分化为视网膜细胞。本研究在体外构建了RSCs和RGCs的共培养体系,使用一种简单的方式施加外周压力,通过压力计保证量化和压力的重复性,模拟眼压升高时压力对与RGCs共培养的RSCs分化的影响,结果发现随着压力的升高,RSCs中Nestin表达水平下降,说明RSCs分化增多。分化所得细胞中RGCs的标志物Thy1.1表达逐渐增多,40 mmHg时RSCs分化程度最大,Nestin mRNA及蛋白表达量最低,分化所得细胞中Thy1.1 mRNA及蛋白表达量最高。但当压力超过40 mmHg时,分化细胞Thy1.1 mRNA及蛋白表达逐渐减少。这表明压力升高会诱导RSCs分化为神经节样细胞。然而,长期或过高的压力不仅会对RGCs造成不可逆转的损害,还会损害RSCs,使其分化能力下降。说明在一定范围内,压力能够促进与RGCs共培养的RSCs分化,压力过大会损害RSCs并抑制其分化。然而,分化所得的视网膜神经节样细胞虽然能够表达RGCs的特异基因,但是否具备RGCs的功能以及在青光眼模型中RSCs移植中具体将会发生何种作用,都值得我们进一步研究。
综上所述,本研究表明,在一定压力范围内,压力能够促进与RGCs共培养的RSCs分化为神经节样细胞,压力过大会损害RSCs并抑制其分化。如果能够通过移植RSCs,促进其向有功能的RGCs分化,补充缺失的RGCs,同时修复视网膜功能,这将给青光眼未来的治疗带来希望。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明戴敏:实验操作、论文撰写、数据整理、统计分析;
亢泽峰:实验设计、论文修改及定稿;
胡竹林:论文修改;
李妍:部分实验操作









