环介导等温扩增技术在SARS-CoV-2核酸检测中的应用研究
时间:2023-06-01 21:05:10 来源:雅意学习网 本文已影响 人 
何祯硕,高 盼,张丽月 综述,刘万红△ 审校
1.武汉大学基础医学院,湖北武汉 430070;
2.河北省衡水市第六人民医院检验科,河北衡水 053200
2019年出现的新型冠状病毒感染给全球公共卫生系统带来了巨大挑战,2020年2月国际病毒分类委员会将该新型冠状病毒命名为严重急性呼吸系统综合征冠状病毒2(SARS-CoV-2),由SARS-CoV-2感染而引起的疾病命名为COVID-19。虽然COVID-19的病死率不及2003年的SARS以及2012年的中东呼吸综合征(MERS)[1-3],但是SARS-CoV-2传播速度快、传播能力强等特点使其防控难度显著增加。感染SARS-CoV-2的症状主要为干咳、发热、乏力以及肌肉酸痛等[4-5],该症状与普通流行性感冒症状很难区分,对临床医师通过症状筛查来说是一种巨大的挑战。目前SARS-CoV-2在分子诊断中的金标准为实时反转录聚合酶链反应(RT-PCR)技术[6-8]。虽然RT-PCR技术在检测SARS-CoV-2方面具有高度特异性与灵敏度,但它需要特殊的核酸检测实验室以及经验丰富的专业检验人员对结果进行分析,而且检测周期较长,这在发展落后的地区很难实现大规模应用。因此有必要研究一种简单、方便、廉价、特异性强且不需要专门仪器设备的检测方法。环介导等温扩增技术(LAMP)以及基于LAMP的各种联合检测技术在SARS-CoV-2检测中的迅速发展,使其有望取代传统的PCR技术成为一种更加灵敏且特异的SARS-CoV-2检测方法。本文详细综述了SARS-CoV-2的结构特点、人类感染机制、LAMP检测原理以及LAMP技术在SARS-CoV-2检测中的研究进展。
1.1冠状病毒特点与分类 冠状病毒通常为典型的球形或多形性,得名于刺突蛋白突出的低聚物,这些低聚物在病毒粒子周围形成冠状边缘,形似日冕[9]。在病毒基因结构方面,冠状病毒都有相似的结构特点,即单股正链RNA病毒,全基因组长度26~32 kb,是套病毒目中最大的一组病毒科。冠状病毒包含一段约30 kb不分节段的正义RNA基因组,该基因组包含一个5′帽结构与一个3′多聚A尾结构[10]。
5′帽结构当中包含两个不同区域,即前导序列与非翻译区(UTR),在5′的UTR区域中包含多个RNA复制和翻译所需的颈环结构;
3′端的UTR区域还包括病毒RNA复制与合成所需的RNA结构。冠状病毒含有4种主要的结构蛋白,分别为刺突(S)、膜(M)、包膜(E)、核衣壳(N)蛋白[11]。
冠状病毒科进一步可细分为4个属即α、β、γ、δ[10]。到目前为止能够引起人类感染的冠状病毒主要包括7种,分别为α属的HCoV-229E、HCoV-NL63,β属的HCoV-OC43、HCoV-HKU1以及2003年的SARS-CoV、2012年的MERS冠状病毒(MERS-CoV)与2019年的SARS-CoV-2[12-14]。
1.2SARS-CoV-2特点
1.2.1SARS-CoV-2结构特点 SARS-CoV-2是一种单股正链RNA有包膜的冠状病毒。基因组大小为29 891个核苷酸,编码9 860个氨基酸,G+C含量约为38%。SARS-CoV-2基因包含2个非翻译区与1个编码多聚蛋白的长开放阅读框,基因组排列顺序为5′-复制酶(ORF1a/b)-结构蛋白[S蛋白-E蛋白-M蛋白-N蛋白]-3′,整个结构缺乏血凝素酯酶基因。在SARS-CoV-2中,ORF1a/b编码16种非结构蛋白,约占整个基因组的67%,这些非结构蛋白包括两种病毒性半胱氨酸蛋白酶[木瓜蛋白酶样蛋白酶(nsp3)和胰凝乳蛋白酶(nsp5)],RNA依赖的RNA聚合酶(nsp12)、解旋酶(nsp13),以及其他可能参与病毒转录复制的非结构蛋白[15]。
SARS-CoV-2与SARS-CoV的主要区别在于ORF3b、S蛋白和ORF8,其中在S蛋白S1和ORF8中尤为明显,这两个位点之前被认为是重组的热点。ZHOU等[16]的分析发现,部分SARS-CoV-2基因与SARS-CoV的核苷酸序列同源性低于80%。然而,ORF1a/b区域中用于分类的7个保守复制酶域氨基酸序列在SARS-CoV-2与SARS-CoV中同源性却高达94.4%。他们还发现,一种蝙蝠冠状病毒(BatCoV RaTG13)的RNA依赖的RNA聚合酶(RdRp)短区与SARS-CoV-2具有极高的序列同源性,全基因组序列一致性高达96.2%。在所有的序列当中,RaTG13表现出与SARS-CoV-2最近的亲缘关系,这与其他与SARS相关的冠状病毒(SARSr-CoVs)形成了截然不同的谱系。其次,在SARS-CoV-2中,S基因所编码的受体结合S蛋白与其他SARS-CoV的S蛋白存在很大差异,而与RaTG13 S蛋白的一致性高达93.1%,SARS-CoV-2与RaTG13的S蛋白长度远高于其他与SARS相关的冠状病毒S蛋白。同样,在LU等[17]的分析中证明SARS-CoV-2编码的S蛋白较SARS-CoV和MERS-CoV的S蛋白更长。
1.2.2SARS-CoV-2的感染机制 冠状病毒的感染机制主要与S蛋白相关。S蛋白是一个相对分子质量约180×103的跨膜同源三聚体糖蛋白,为Ⅰ类融合蛋白。对于大多数冠状病毒来说,宿主蛋白将S蛋白切割处理成两个亚基即S1和S2,它们在预融合构象中以非共价结合形式存在[18-22]。SARS-CoV-2的S1亚基主要功能区包括N端结构域(NTD)、受体结合域(RBD)以及受体结合基序(RBM),S2亚基包括两个七肽重复序列(HR)即HR1与HR2,跨膜结构域(TM)、胞质域(CP)以及融合肽(FP)[23]。S1亚基主要负责与宿主细胞受体结合,而S2亚基在介导病毒与宿主细胞融合并进入宿主细胞中起关键作用,HR1与HR2可以相互作用形成六螺旋束(6-HB),从而使病毒与细胞膜接近,以便相互融合。
与SARS-CoV、MERS-CoV一样,SARS-CoV-2 S蛋白S1亚基中的RBD区域能够特异性识别宿主受体血管紧张素转换酶2(ACE2),并使其作为自身功能性受体而进入宿主细胞[16,24-25]。人类ACE2由一个N端肽酶结构域(PD)与一个C端收集素样结构域(CLD)组成,CLD末端有一个跨膜螺旋和一个约40个残基的包内段[26]。有研究表明,SARS-CoV-2 S蛋白的胞外域主要与人类ACE2的PD区域结合,其亲和力约15 nmol/L,较SARS-CoV S蛋白的亲和力高约10~20倍[27]。另外,SHANG等[28]的研究发现,与SARS-CoV RBM区域相比,SARS-CoV-2 RBM区域形成更大的结合界面,与人类ACE2的接触面积更多,其原因可能为SARS-CoV-2和SARS-CoV RBM的一种结构(即人类ACE2结合脊的环状构象)存在显著差异。人类和果子狸SARS-CoV毒株以及蝙蝠冠状病毒Rs3367在这个环状结构中都含有一个3个残基基序(脯氨酸-脯氨酸-丙氨酸),而SARS-CoV-2和蝙蝠冠状病毒RaTG13都含有甘氨酸-缬氨酸/谷氨酰胺-谷氨酸/苏氨酸-甘氨酸4个残基基序,两个相对庞大的残基和两个柔韧的甘氨酸使这种环状结构差异显著。在SARS-CoV-2 RBM区域中,因为这些结构上的差异,Asn487和Ala475之间形成了一个额外的主链氢键,导致脊状构象更紧凑,包含Ala475的环更靠近人类ACE2。因此,SARS-CoV-2 RBM中的脊与人类ACE2 N端螺旋的接触更多。SARS-CoV-2 S区域对人ACE2的高亲和力可能是导致SARS-CoV-2在人与人之间更易传播的原因[29]。
LAMP首次由日本学者NOTOMI等[30]提出,是一种在等温条件下对核酸进行扩增的方法。该方法主要包括一种具有链置换活性的DNA聚合酶与4种专门设计的引物,4种引物能够识别目标DNA上的6个不同序列。6个不同序列主要包括5′端的B1、B2、B3区以及3′端的F1c、F2c、F3c。引物分为内引物与外引物,内引物当中包括一条上游正向内部引物(FIP)与一条下游反向内部引物(BIP),每条引物都包含两个不同的序列分别对应目标DNA的有义与反义序列(FIP主要包括F1c、一段TTTT间隔区以及一条与目标基因3′端F2c互补的F2序列;
BIP包括一条与B1互补的B1c序列、一段TTTT间隔区以及B2序列),一条内引物用于第一阶段的启动,另一条用于第二阶段的自我启动。两条外引物包括下游外部引物B3(与B3c 区域互补)与上游外部引物F3(与F3c互补)。外引物引发链置换DNA的合成,释放出单链DNA,它作为DNA合成的模板,由第二对内外引物启动DNA的合成(即内外引物与目标DNA的另一端进行杂交,产生茎环结构)。在随后的LAMP循环中,一个内引物与产物上的环进行杂交并启动链置换DNA的合成,产生原始茎环DNA与一个比原始茎长两倍的新茎环DNA。最终产物是具有多个靶标反向重复序列的茎环DNA结构与具有多个环状结构的花椰菜样结构。
迄今为止,已有大量关于LAMP以及基于LAMP为基础的联合检测技术应用于SARS-CoV-2检测的报道。在这些检测技术中,检测/扩增一管化、结果可视化、引物组设计以及减少假阳性概率等是研究人员所面临的主要问题。
3.1检测/扩增一管化方案 SARS-CoV-2检测中,简化核酸检测与扩增步骤是缩短检测时间的关键,EL-THOLOTH等[31]以LAMP为基础,构建了用于检测COVID-19的两阶段等温扩增(COVID-19 Penn-RAMP),实现了检测与扩增的一管化方案。他们的研究结果显示,在检测纯化RNA目标时COVID-19 Penn-RAMP的灵敏度比COVID-19 LAMP和COVID-19 RT-PCR高10倍,在检测模拟患者标本时,灵敏度比COVID-19 LAMP和COVID-19 RT-PCR高100倍。但是,由于当时缺乏COVID-19感染病例导致他们无法用真实患者的标本进行测试。随后,LAMB等[32]的研究证明,在经过RNA提纯的模拟SARS-CoV-2感染以及实际COVID-19患者的标本中,RT-LAMP检测均能在30~45 min特异性地检测出SARS-CoV-2的存在,然而,当对未经RNA提纯的COVID-19患者标本进行检测时,RT-LAMP的特异度与灵敏度却显著下降。
3.2标本处理与优化 TAKI等[33]的研究中得出,在经过RNA提纯步骤的唾液与鼻咽拭子标本当中,利用RT-LAMP方法检测的灵敏度与特异度两者均分别为97%与100%。而当检测未经RNA提纯的鼻咽拭子与唾液标本时,两者的灵敏度降低到只有71%与47%。如何在未进行RNA提纯步骤的前提下提高检测灵敏度与特异度是困扰研究人员的难题之一。
LALLI等[34]通过实验证明,当对唾液标本进行65 ℃ 15 min以及95 ℃ 5 min加热处理并冷却至4 ℃后,RT-LAMP对标本中SARS-CoV-2的检测限能够达到59个粒子拷贝数,其灵敏度与特异度得到了显著提高。HOWSON等[35]在进行RT-LAMP检测之前,用MucolyseTM1∶1稀释唾液标本,然后用10% (w/v) Chelex 100 Resin再次稀释,98 °C加热2 min,经过这两步处理的唾液标本利用RT-LAMP在短短5 min 43 s内就被检测到了SARS-CoV-2的存在。他们的实验证明,对唾液标本的预处理在一定程度上能够缩短检测周期。但是由于唾液预处理以及下游分析过程仍然需要一些特殊的培训以及设备,使其在大规模核酸检测中的应用仍然受到一定限制。
3.3基于LAMP的联合检测技术 以LAMP为基础的联合核酸检测技术正逐渐受到研究人员的关注。例如,一些研究人员基于RT-LAMP,建立了一种基于CRISPR-Cas12蛋白快速检测SARS-CoV-2的方法[36]。这种方法能够灵敏且特异性地检测出患者呼吸道标本中SARS-CoV-2的存在,其阳性预测值达95%,阴性预测值达100%。WANG等[37]开发了一套基于CRISPR/Cas12的“多相复式非连续生产法”用于检测SARS-CoV-2的系统,俗称“一锅法” (opv CRISPR) ,将RT-LAM与Cas12a裂解整合在一个反应体系中。这与前面EL-THOLOTH等[31]的研究有相似之处,即RT-LAMP试剂在试管底部孵育,而在试管顶部加入CRISPR/Cas12a反应试剂。研究表明opv CRISPR的灵敏度与RT-PCR相当,比RT-LAMP约高10倍,Cas12a的切割提高了RT-LAMP的灵敏度,使其检测灵敏度提高到接近单分子水平,opv CRISPR的诊断结果与美国疾病控制与预防中心(CDC)批准的定量RT-PCR检测结果100%一致。但是两项研究在面对未提纯的标本时其检测的灵敏度与特异度均出现不同程度的下降。
3.4引物组设计与结果可视化研究 LAMP反应需要6种引物,到目前为止公开的LAMP引物设计工具很少,现有的工具没有充分考虑到LAMP反应的复杂性,其次可视化反应容易受外界环境因素影响而使结果产生假阳性,因此特异性的引物组设计以及稳定的颜色变化也是提高灵敏度与特异度不可或缺的步骤。HUANG等[38]分别针对SARS-CoV-2的ORF1a/b、S基因以及N基因区域设计了4组引物(O117、S17、N1和N15),结果发现,引物N1与S17的检测限最低均达到80 copy/mL。然而由于他们所应用的可视化原理主要是通过pH的变化来实现,其结果受临床环境因素影响较大,易产生假阳性。在后续的研究中,他们在引物FIP的5′端连接了6-羧基荧光素(FAM)使显色结果变得更加稳定,但仍然没有解决标本纯化问题。
HUANG等[39]以病毒扩增所需的总时间(TT)以及假阳性率(FP)将所设计出的引物进行评分(总分4分,评分越低表明假阳性概率越低)并结合一种生物信息学算法筛选出了22种新型特异性引物(N7~N28)。其中,N7、N25和N27的总体表现最好,TT均小于20 min,FP评分均为1分。除此之外,他们还设计了6对针对M基因以及7对针对S基因的引物。在所有研究的引物中N7、N27、M以及M6表现最佳。在进一步的研究当中,他们将表现最佳的4种引物两两联合,利用多重RT-LAMP法对SARS-CoV-2感染患者唾液标本不提纯直接检测,其检测限达到了1.5 copy/μL的病毒载量。临床结果表明该方法与标准RT-PCR方法总体灵敏度与特异度相当。在这项研究中他们成功解决了RNA提纯问题,一定程度上缩短了检测周期(各种LAMP为基础的SARS-CoV-2检测方法汇总见表1)。NAGURA-IKEDA等[41]在自行采集的唾液中,对SARS-CoV-2的6项分子诊断试验和一项快速抗原试验的临床表现进行评估的实验中证明RT-LAMP在临床中应用具有足够的灵敏度与特异度(已上市产品试剂盒列举见表2)。

表1 以LAMP为基础的SARS-CoV-2核酸检测方法总结

表2 已获批的基于LAMP的SARS-CoV-2核酸检测试剂盒
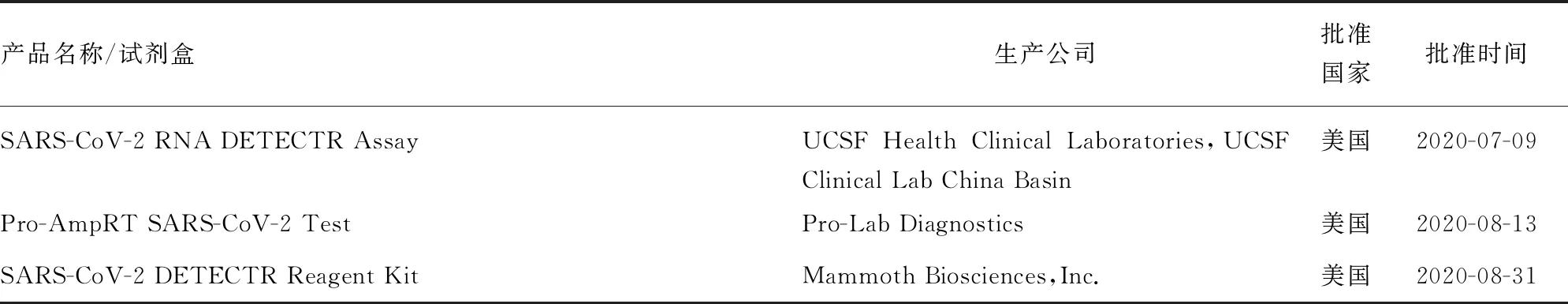
续表2 已获批的基于LAMP的SARS-CoV-2核酸检测试剂盒
SARS-CoV-2感染的爆发给全球社会经济带来了巨大的灾难,也导致生命科学等领域的爆发式发展,尤其在分子诊断领域。SARS-CoV-2变异毒株的不断出现是全球分子诊断领域所共同面临的一项巨大挑战,RT-LAMP作为一种新型检测技术在SARS-CoV-2检测方面正表现出越来越突出的优势[42-44]。LAMP的不断改进与完善使其逐渐克服了之前的瓶颈,例如引物组设计、标本处理以及可视化等问题。而在ZHU等[40]的研究当中,利用多重RT-LAMP与纳米颗粒侧流生物传感器相结合的方法,成功解决了检测结果显色等问题,显著降低了外部环境因素的干扰。
与传统RT-PCR相比,LAMP虽然不能定量,但却表现出了更高的灵敏度与特异度。更重要的是,LAMP对SARS-CoV-2的检测只需几十甚至几分钟就能够简单通过肉眼对结果进行识别。这在SARS-CoV-2大流行期间对SARS-CoV-2感染疑似病例进行大规模筛查至关重要。以LAMP为基础的联合检测技术有望取代传统的RT-PCR技术,成为一种对SARS-CoV-2检测更加快速、简便且具有明显成本-效益的方法。
猜你喜欢 灵敏度引物标本 甜菜全基因组SSR引物的筛选与评价中国农学通报(2022年12期)2022-06-01不明原因肝损害的32例肝组织活检标本的29种微量元素测定昆明医科大学学报(2022年4期)2022-05-23基于机电回路相关比灵敏度的机电振荡模式抑制方法现代电力(2022年2期)2022-05-23玉米品种德美亚多重SSR-PCR系统的建立及应用中国糖料(2022年2期)2022-04-06花菜类杂交种纯度鉴定SSR 核心引物筛选中国种业(2021年11期)2021-11-25巩义丁香花园唐墓出土器物介绍黄河·黄土·黄种人(华夏文明)(2021年6期)2021-09-28COVID-19大便标本采集器的设计及应用现代仪器与医疗(2021年1期)2021-06-09科学思维视角下PCR 的深度学习教学考试(高考生物)(2021年2期)2021-05-31Beta-blocker therapy in elderly patients with renal dysfunction and heart failureJournal of Geriatric Cardiology(2021年1期)2021-03-03吸气式高超声速飞行器多参数灵敏度分析北京航空航天大学学报(2017年5期)2017-11-23







