UPLC-MS/MS检测转基因大豆及其副产物中的草甘膦及代谢物
时间:2023-06-06 16:50:24 来源:雅意学习网 本文已影响 人 
徐君辉,沈飚,高卓瑶 *,倪鲁波,吕款款,徐依婷
1.舟山海关综合技术服务中心(舟山 316000);
2.浙江海洋大学食品与药学学院(舟山 316000);
3.舟山市食品药品检验检测研究院(舟山 316000)
大豆富含脂肪、蛋白质、磷脂等营养物质,还是重要的油料作物,其副产物豆粕还可作为动物的蛋白质饲料添加物[1]。我国是全球转基因大豆进口量和压榨量最大的国家[2]。草甘膦(glyphosate,GLY)是一种非选择性有机磷除草剂,具有高效、低毒、易降解等特点,是目前世界上应用范围最广、生产量最大的除草剂[3]。草甘膦残留是转基因大豆中最主要的农药残留问题。2015年,草甘膦被国际癌症研究机构(International Agency for Research on Cancer,IRAC)列为2A类致癌物后,各国对其用量和残留限量进行严格控制。但在我国GB 2763—2021《食品安全国家标准 食品中农药最大残留限量》,尚未对转基因大豆中的草甘膦最大残留限量作出规定[4-6]。
检测草甘膦主要方法有气相色谱法(gas chromatography,GC)[7-8]、高效液相色谱法(high performance liquid chromatography,HPLC)[9-11]、气相色谱-质谱联用法(gas chromatography-mass spectrometry,GCMS)[12-14]、液相色谱-质谱联用法(liquid chromatography mass spectrometry,LC-MS)[15-20]、离子色谱法(ion chromatography,IC)[21-22]和毛细管电泳法(capillary electrophoresis,CE)[23]。IC不适用于转基因大豆这类高脂肪、高蛋白的复杂基质。GC和GC-MS在上机检测前需将目标化合物转为可气化物质,耗费试剂较多,过程复杂,耗时过长。HPLC和LC-MS对前处理要求较高,受基质干扰影响较大,灵敏度不高。柱前衍生-液质联用法是近几年来检测草甘膦和氨甲基膦酸的常用方法,但现有报道主要针对于水、土壤、茶叶等基质[24-25]。
试验针对转基因大豆及其副产物基质的特点,采用0.1%盐酸溶液提取,二氯甲烷脱脂,RM固相萃取柱净化后,与四硼酸钠溶液和芴甲氧羰酰氯溶液衍生,通过超高效液相色谱-串联质谱仪进行测定,同位素内标法定量。该方法前处理过程简单、灵敏度高、稳定性好,不仅能满足日常检测要求,还可为相关监管部门提供有力的技术支持。
1.1 材料与试剂
转基因大豆样品(随机购买自浙江省各农贸市场及超市);
豆粕和大豆油(转基因大豆压榨而得)。
草甘膦标准品、氨甲基膦酸标准品、同位素1,2-C13N15草甘膦标准品(纯度≥95%,上海安谱实验科技股份有限公司);
乙腈、二氯甲烷、盐酸、四硼酸钠、FMOC-Cl(色谱纯,中国医药集团有限公司);
甲醇(色谱纯,德国默克公司);
草甘膦检测基质方法包(SBEQ-CA5866,上海安谱实验科技股份有限公司);
试验用水(经Milli-Q净化的超纯水,美国Milli-pore公司)。
1.2 仪器与设备
Waters Xevo TQ-XS超高效液相色谱-三重四极杆串联质谱仪(美国沃特世公司);
Multi Reax多孔位旋涡混合器(德国海道尔夫公司);
AVANTIJ-E高速冷冻离心机(美国贝克曼库尔特公司);
KQ-600DV数控超声波清洗器(中国江苏昆山超声仪器有限公司);
Milli-Q超纯水仪(美国Milli-pore公司);
BSA224S-CW电子天平(赛多利斯科学仪器有限公司)。
1.3 试验方法
1.3.1 标准溶液的配制
GLY、AMPA混合标准储备液:准确称取10 mg草甘膦标准品和氨甲基膦酸标准品于同一个10 mL容量瓶中,用纯水溶解并定容至标准刻度线,混匀,配制成质量浓度为1 mg/mL的混合标准储备液,于4 ℃冰箱保存。
GLY、AMPA混合标准中间液:准确吸取0.1 mL GLY、AMPA混合标准储备液于100 mL容量瓶中,用纯水定容至标准刻度线,混匀,配制成质量浓度1 μg/mL的混合标准中间液,于4 ℃冰箱保存。
GLY、AMPA混合标准工作溶液:分别吸取1 μg/mL GLY、AMPA混合标准中间液0.1,0.2,0.5,1.0,2.0,5.0和10.0 mL于7只100 mL容量瓶,用纯水定容至标准刻度线,得1.0,2.0,5.0,10.0,20.0,50.0和100.0 ng/mL混合标准工作溶液。
同位素内标溶液:准确称取0.10 mg同位素1,2-C13N15草甘膦标准品于100 mL容量瓶中,用纯水定容至标准刻度线,混匀,配制成质量浓度1 μg/mL的同位素内标溶液。
1.3.2 样品的前处理
提取:将大豆置于粉碎机粉碎,过0.250 mm孔径(60目)筛得到质化后的转基因大豆样品,准确称取2 g均质后的大豆样品于50 mL离心管中,加入50 μL 1 μg/mL 同位素内标溶液,加入10 mL 0.1%盐酸溶液,涡旋混合1 min(转速2 000 r/min),加入100 mg草甘膦检测基质方法包,涡旋混合1min(转速2 000 r/min),加入10 mL二氯甲烷,涡旋混合1 min(转速2 000 r/min),在40 kHz频率下超声提取15 min,在10 000 r/min下离心5 min,取上清液,待净化。
移动评价对于邻域结构的搜索耗时问题具有重要影响,精确方法存在计算耗时的问题,近似方法能够快速对新解进行评价,过滤出最有可能引导算法搜索到改进解的移动,甚至有时可能比精确方法更准确。FJSP跨机器移动工序和同机器移动工序时,近似评价方法分别具体如下:
净化:取5 mL上清液过RM固相萃取柱(使用前先用6 mL甲醇活化,用6 mL去离子平衡),收集后2.5 mL净化液,待衍生。
衍生:取1 mL净化液于5 mL离心管中,加入0.2 mL 5%四硼酸钠缓冲溶液和0.2 mL 1 mg/mL FMOC-Cl乙腈溶液,涡旋混合30 s(转速2 000 r/min),密封,置于40 ℃烘箱内下衍生2 h,冷却至室温,过0.22 μm有机微孔滤膜得待测液,上机检测。
1.3.3 仪器分析参数
1.3.3.1 色谱条件
色谱柱ACQUITY UPLC BEH C18(2.1 mm×100 mm,1.7 μm);
柱温45 ℃;
进样量10 μL;
流速0.30 mL/min;
流动相A为0.1%甲酸乙腈;
流动相B为含0.1%甲酸的5 mmol/L乙酸铵水溶液;
洗脱方式采用梯度洗脱;
洗脱程序:0~3.5 min时,A相体积分数由10%逐渐增加至30%,3.5~3.7 min时,A相体积分数由30% 逐渐增加至95%,3.7~10 min时,A相体积分数保持在95%,10~10.2 min 时,A相体积分数由95%逐渐减少至10%,10.2~12.0 min,A相体积分数保持在10%,平衡5 min。
1.3.3.2 质谱条件
质谱条件为:离子源采用电喷雾电离(ESI);
扫描方式采用正离子扫描方式;
采集模式采用多反应监测模式(MRM);
毛细管电压1.0 kV;
雾化器温度500 ℃;
锥孔气流速50 L/h;
雾化气流速1 000 L/h;
离子源温度150 ℃。目标化合物的质谱参数见表1。
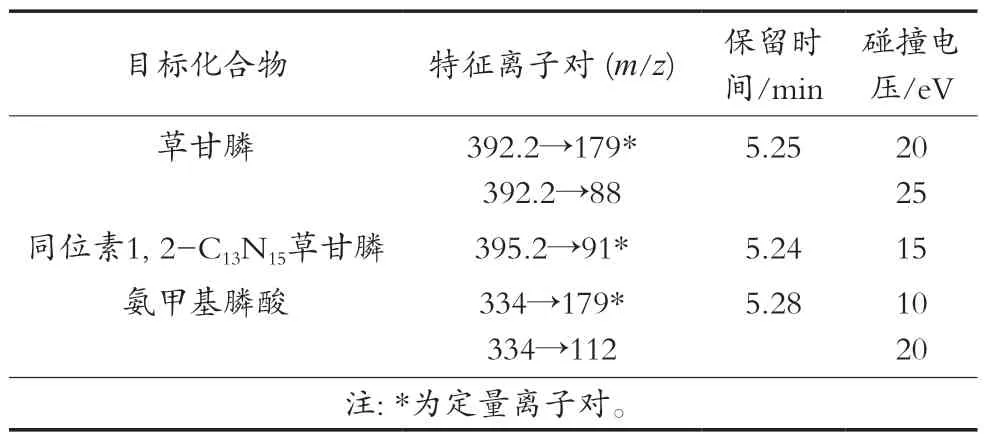
表1 草甘膦和氨甲基膦酸的质谱参数
1.4 数据处理
所有试验数据均采用Qrigin 8.0进行作图分析。
2.1 提取溶剂的选择
草甘膦及其主要代谢物氨甲基膦酸都属于强极性物质,易溶于水,难溶于丙酮、乙醇等有机溶剂,因此,试验选用水作为主要提取溶剂。此外,转基因大豆含有丰富的脂肪和蛋白质,且大部分呈水溶性,能溶解在水中。在提取溶剂中加入适量的盐酸可起到沉淀提取液中蛋白质的作用。对比水、0.1%盐酸溶液、0.5%盐酸溶液、1.0%盐酸溶液4种不同溶剂的提取效果。以转基因大豆加标样品为例,分别采用4种溶剂进行提取,保持其他条件一致。由图1可知,0.1%,0.5%和1.0%盐酸溶液提取后回收率均高于纯水提取,且使用0.1%盐酸溶液时,提取效果最好,因此选择0.1%盐酸溶液作为提取试剂。
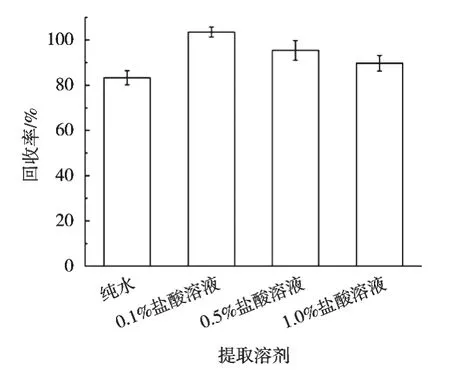
图1 不同溶剂对草甘膦和氨甲基膦酸回收率的影响(n=3)
2.2 衍生条件优化
柱前衍生指待测液在进行色谱柱分离前,通过与化学试剂反应,将难于分析检测的目标化合物定量转化成另一种易于分析检测的化合物。衍生温度高低和衍生时间长短都是影响衍生反应的重要因素。在1.0 mL质量浓度100 ng/mL的GLY、AMPA混合标准工作溶液中加入0.2 mL 5%四硼酸钠缓冲溶液和0.2 mL 1 mg/mL FMOC-Cl乙腈溶液,并分别置于20,30,40和50℃烘箱内进行衍生,其他条件保持一致,结果如图2所示。衍生温度40 ℃时,草甘膦和氨甲基膦酸的回收率最佳。在1.0 mL质量浓度100 ng/mL的GLY、AMPA混合标准工作溶液中加入0.2 mL 5%四硼酸钠缓冲溶液和0.2 mL 1 mg/mL FMOC-Cl乙腈溶液,分别衍生1,2,4,6和12 h,其他条件保持一致,结果如图3所示。在衍生时间2~6 h范围内,草甘膦和氨甲基膦酸的回收率均能达到要求,综合考虑,衍生时间为2 h。
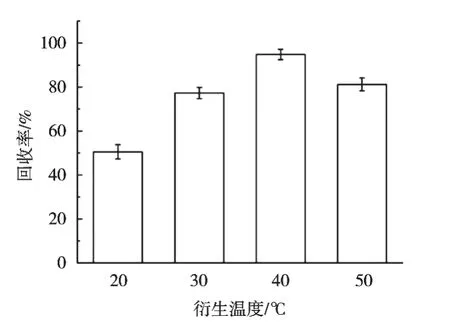
图2 衍生温度对草甘膦和氨甲基膦酸回收率的影响(n=3)
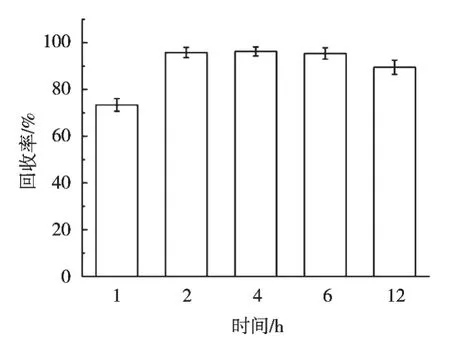
图3 衍生温度对草甘膦和氨甲基膦酸回收率的影响(n=3)
2.3 UPLC-MS/MS条件优化
分别对比HSS T3(2.1 mm×100 mm,1.8 μm)、BEH C18(2.1 mm×100 mm,1.7 μm)、BEH HILIC(2.1 mm×100 mm,1.7 μm)和BEH Amide(2.1 mm×100 mm,1.7 μm)4种ACQUITY UPLC色谱柱对草甘膦和氨甲基膦酸的分离效果。结果表明,采用ACQUITY UPLC BEH C18(2.1 mm×100 mm,1.7 μm)色谱柱时,目标化合物的分离效果相对较好,不受杂峰干扰,响应值高。因此,选择ACQUITY UPLC BEH C18色谱柱为分离柱。
按1.3.3选定的色谱条件,根据草甘膦和氨甲基膦酸的电离性质,采用ESI正离子模式对衍生后的混合标准工作液进行全扫描分析,对碰撞电压、去簇电压等关键质谱参数进行优化,通过对比响应值高低来确定目标化合物的最佳质谱条件,具体质谱参数见表1,色谱峰结果见图4。
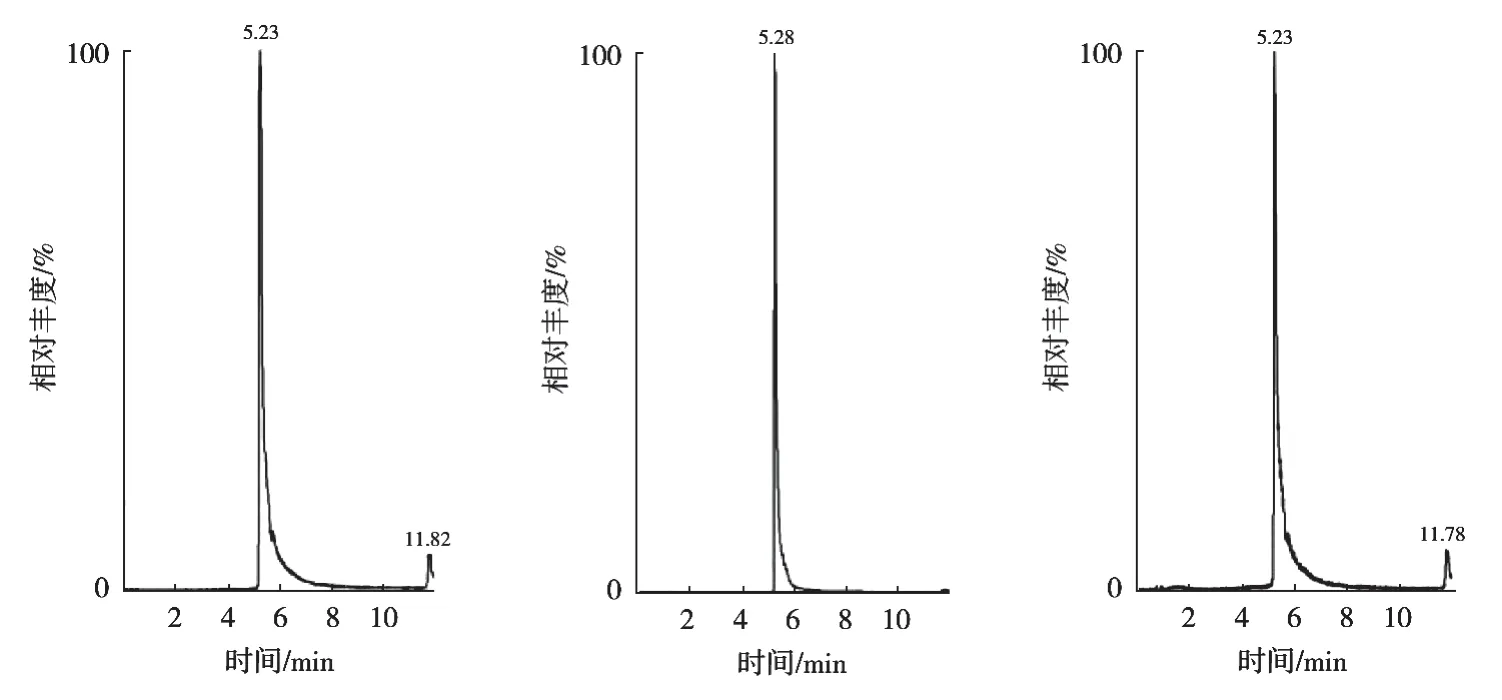
图4 目标化合物的MRM色谱图
2.4 线性范围、检出限和定量限
准确吸取适量GLY、AMPA混合标准中间液和同位素内标溶液,用纯水分别定容至质量浓度1.0,2.0,5.0,10.0,20.0,50.0和100.0 ng/mL的系列混合标准工作溶液(同位素内标质量浓度均为5 ng/mL)。按1.3.2所述方法衍生后,用UPLC-MS/MS进行分析检测。将定量离子与同位素内标峰面积比值作为纵坐标(Y),质量浓度与内标浓度比值为横坐标(X),绘制标准工作曲线,计算线性回归方程和相关系数,结果见表2。
选用阴性转基因大豆样品,加入适量GLY、AMPA混合标准工作溶液,按1.3.2所述方法对样品进行前处理,在1.3.3的仪器工作条件下进行分析测定,分别以3倍信噪比(rSN)和10倍信噪比(rSN)计算目标化合物的检出限和定量限,结果见表2。结果表明,草甘膦和氨甲基膦酸在1.0~100.0 ng/mL质量浓度范围内线性关系良好,相关系数均大于0.996,检出限为0.05 mg/kg,定量限为0.10~0.15 mg/kg,能满足定量分析的需求。

表2 草甘膦和氨甲基膦酸的线性范围、回归方程、相关系数、检出限和定量限
2.5 准确度与精密度
选用阴性样品,分别添加0.05,0.20和0.50 mg/kg 3个水平的GLY、AMPA混合标准工作溶液,按1.3.2所述方法对样品进行前处理,在1.3.3的仪器工作条件下进行分析测定,每个水平重复测定6次,并计算回收率和相对标准偏差,结果见表3。目标化合物的加标回收率为90.7%~109.3%,测定结果的相对标准偏差为2.44%~7.56%。因此,该方法具有良好的准确度与精密度,能满足转基因大豆中草甘膦和氨甲基膦酸的日常检测需求。
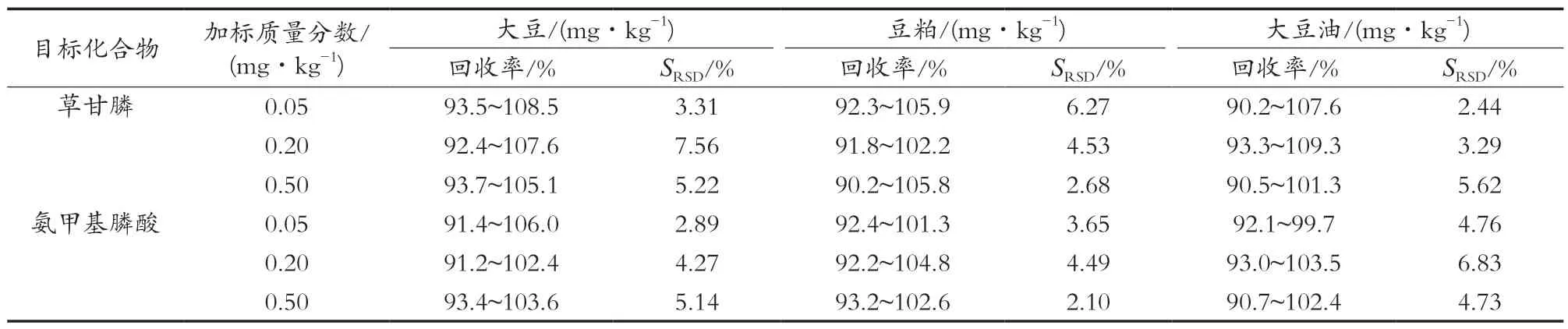
表3 样品中草甘膦和氨甲基膦酸的回收率及相对标准偏差(n=6)
2.6 实际样品检测
采用建立的柱前衍生-UPLC-MS/MS-内标法对来自浙江农贸市场、超市等场所的转基因大豆及其副产物中的草甘膦和氨甲基膦酸进行分析检测。结果见表4,草甘膦在大豆和豆粕中的检出率较高,实测最高值分别为0.253和0.114 mg/kg,而大豆油中则未检出;
氨甲基膦酸在大豆、豆粕和大豆油中均未检出。通过对实际样品的检测应用,说明该方法可用于转基因大豆及其副产物中草甘膦和氨甲基膦酸的日常分析检测。
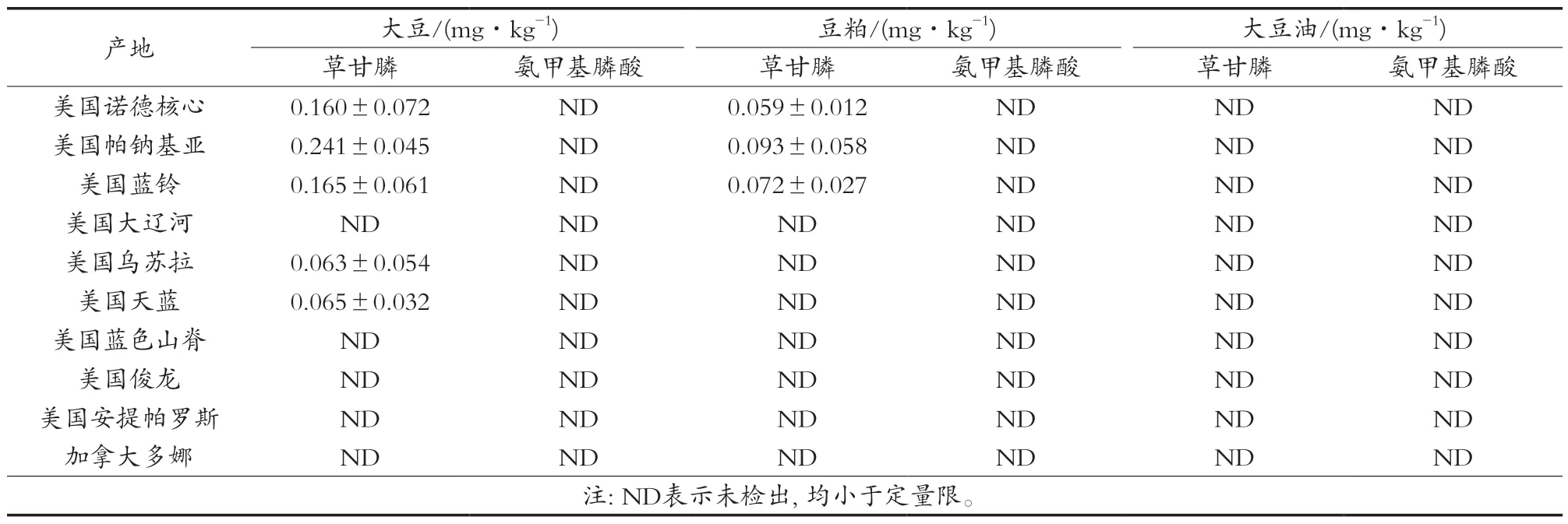
表4 实际样品中草甘膦和氨甲基膦酸的检测结果
针对转基因大豆及其副产物高脂肪、高蛋白的特点,采用二氯甲烷和RM固相萃取柱净化有效去除基质中的杂质干扰,建立柱前衍生-UPLC-MS/MS-内标法测定转基因大豆及其副产物中草甘膦和氨甲基膦酸残留的分析方法。该方法前处理过程操作简单、提取率高、净化效果好,回收率与精密度均能达到检测要求,可为相关部门监管转基因产品提供有力技术支持,也能为完善我国转基因产品检测体系提供参考。
猜你喜欢 草甘膦内标甲基 UIO-66热解ZrO2负载CoMoS对4-甲基酚的加氢脱氧性能分子催化(2022年1期)2022-11-021,2,4-三甲基苯氧化制备2,3,5-三甲基苯醌的技术进展化学工业与工程(2022年1期)2022-03-29电感耦合等离子体质谱法测定硼的内标选择性研究浙江化工(2022年1期)2022-02-19气相色谱内标法测洗涤剂中的甲醇口腔护理用品工业(2021年4期)2021-11-02中成药中非法添加二硫去甲基卡波地那非的检测中成药(2019年12期)2020-01-04法国拟2020年废除草甘膦的使用农药科学与管理(2019年6期)2019-11-23血液中乙醇含量测定-异丁醇内标标准曲线法中国科技纵横(2019年23期)2019-02-14禁用草甘膦或将导致农民杂草防除成本增加世界农药(2019年2期)2019-01-06草甘膦 三季度有望吹响反攻号角营销界(2015年23期)2015-02-28凝胶渗透色谱法测定3-叠氮甲基-3-甲基氧丁环均聚物相对分子质量及其分布火炸药学报(2014年3期)2014-03-20







